Meerrettichperoxidase
Die Meerrettichperoxidase – meist als HRP, von engl. horseradish peroxidase, abgekürzt – ist eine Peroxidase aus dem Meerrettich, die als eines der drei häufigst verwendeten Reporterenzyme in der Biochemie eingesetzt wird.
| Meerrettichperoxidase CA1 (Armoracia rusticana) | ||
|---|---|---|
 | ||
| nach PDB 1W4W[1] | ||
| Masse/Länge Primärstruktur | 308 Aminosäuren, 44.174 Dalton | |
| Sekundär- bis Quartärstruktur | Monomer | |
| Kofaktor | 2 Calcium, Häm B | |
| Präkursor | (323 aas) | |
| Bezeichner | ||
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 1.11.1.7, Peroxidase | |
| Substrat | Donor + H2O2 | |
| Produkte | oxidierter Donor + H2O | |
Eigenschaften
Die Meerrettichperoxidase katalysiert die Reduktion von verschiedenen Peroxiden, meistens Wasserstoffperoxid. Sie ist ein Metalloenzym aus der Ferroprotoporphyringruppe der Peroxidasen. Sie besitzt eine Molmasse von etwa 44 kDa, die sich aus dem Proteinanteil (33.890 Dalton), Hämin und Ca2+-Ionen (circa 700 Dalton) und der Glykosylierung (9.400 Dalton) zusammensetzt.[3] Für die katalysierte Redoxreaktion wird Häm als Cofaktor im aktiven Zentrum verwendet.
In geringem Umfang wird die HRP durch die Dismutation von Wasserstoffperoxid inaktiviert, dagegen werden Nitroxide wie 2,2,6,6-Tetramethyl-piperidin-N-oxyl (TPO) oder 4-OH-TPO zugesetzt.[4] Die Stabilität der HRP nimmt in Anwesenheit von Phosphaten ab.[5][6] Der optimale pH-Wert-Bereich für maximale Enzymaktivität liegt zwischen pH 6 und 6,5. Bei pH 7,5 liegt die Enzymaktivität bei 84 % des Maximalwerts. Die Proteinfaltung und die Enzymaktivität sind stabil zwischen pH 5 und 9.[7]
Die Meerrettichperoxidase liegt in sieben Isoenzymen vor,[8] deren isoelektrische Punkte zwischen pH 3 und pH 9 liegen. Die Isoenzyme unterscheiden sich auch in ihren Glykosylierungen und den Anteilen an Galactose, Arabinose, Xylose, Fucose, Mannose, Mannosamin und Galactosamin.[8]
Inhibitoren
Hemmstoffe der HRP sind Natriumazid, Cyanid, L–Cystin, Dichromat, Ethylenthioharnstoff, Hydroxylamin, Sulfid, Vanadat, p-Aminobenzoesäure, Cd2+, Co2+, Cu2+, Fe3+, Mn2+, Ni2+ und Pb2+.[9]
Gewinnung
Die Meerrettichperoxidase wird industriell aus Meerrettich isoliert. Bei der Proteinreinigung der HRP wird die Reinheitszahl (RZ) als Verhältnis der Extinktionen bei den Wellenlängen 403 und 275 nm bestimmt. Dabei wird der Hämingehalt bestimmt, der nicht unbedingt mit einer hohen Enzymaktivität einhergeht. Die RZ sollte bei der HRP für eine Kopplung an Antikörper über 3 liegen. Als Kopplungsmethoden für die Meerrettichperoxidase werden unter anderem Oxidation mit Natriumperiodat und die reduktive Aminierung mit Natriumcyanoborhydrid (an den Glykosylierungen), die Reaktion mit Sulfosuccinimidyl-4-(N-maleimidomethyl)cyclohexan-1-carboxylat (Sulfo-SMCC) und 2-Mercaptoethylamin oder die Reaktion mit SMCC, N-Succinimidyl-S-acetylthioacetat (SATA) und Succinimidyl-3-(2-pyridyldithio)propionat (SPDP) eingesetzt.
Eine Herstellung der HRP als rekombinantes Protein in E. coli führt zu Ausbeuten, die in höheren Produktionskosten resultieren.[10][11]
Verwendung
Die HRP wird zur Herstellung von optisch aktiven Hydroperoxiden verwendet. Sie wird auch bei einer Immunfärbung als Teil eines Immunkonjugates eingesetzt, das z. B. bei immunhistochemischen Techniken in der Histologie, beim ELISA, beim Western Blot und beim ELISPOT. Die HRP besitzt sechs Lysine, die zur Molekülmarkierung verwendet werden können. Daneben kann auch ein Molekül an Cysteine in vier Disulfidbrücken der HRP gekoppelt werden.[12] Als Vernetzer der HRP mit anderen Proteinen werden unter anderem Periodsäure und Glutaraldehyd verwendet.[13] Der Meerrettichperoxidase wird Wasserstoffperoxid als eines der beiden Substrate angeboten. Aus der Spaltung des Wasserstoffperoxids wird das vorher fast farblose Chromogen zu seinem farbigen Endprodukt oxidiert.
Alternativ werden die alkalische Phosphatase (AP) und die β-Galactosidase (βGal) als Reporterenzyme eingesetzt. Im Vergleich zur AP ist die HRP kleiner, stabiler und kostengünstiger. Die HRP hat zudem eine höhere Wechselzahl als beide Alternativen, wodurch höhere Produktbildungsraten entstehen, die bei einer Chemilumineszenz oftmals gewünscht sind.[14] Aufgrund der Glykosylierungen der HRP entstehen weniger unspezifische Protein-Protein-Interaktionen durch hydrophobe Effekte.[15]
Weiterhin wird die HRP zur Oxidation von Aromaten mit Hydroxygruppe aus industriellen Abwässern untersucht.[16]
Substrate
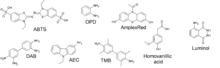
Die Chemolumineszenzreaktion des Luminols oder anderer Dioxetane lässt sich durch diese Peroxidase katalysieren. Daneben bildet die HRP mit verschiedenen Chromogenen farbige oder fluoreszente Reaktionsprodukte.
Substrate für Chemilumineszenz
Substrate für Fluoreszenz
- Tyramin
- Homovanillinsäure
- 4-Hydroxyphenylessigsäure
Substrate für Farbreaktionen
- ABTS
- AEC (3-Amino-9-ethylcarbazol) bildet ein in Wasser unlösliches rosenrotes Endprodukt
- CN (4-Chlor-1-naphthol) reagiert unter Bildung eines blauen Farbstoffs
- DAB (3,3′-Diaminobenzidin) bildet ein in Wasser unlösliches braunes Endprodukt
- TMB (Tetramethylbenzidin) bildet ein in Wasser unlösliches blaues Endprodukt, welches beim Abstoppen der Reaktion mit Schwefelsäure einen stabilen gelben Farbkomplex bildet
- ortho-Phenylendiamin bildet einen löslichen Farbstoff
Literatur
- N. C. Veitch: Horseradish peroxidase: a modern view of a classic enzyme. In: Phytochemistry. 65 (3), February 2004, S. 249–259. doi:10.1016/j.phytochem.2003.10.022. PMID 14751298.
- A. M. Azevedo, V. C. Martins, D. M. Prazeres, V. Vojinović, J. M. Cabral, L. P. Fonseca: Horseradish peroxidase: a valuable tool in biotechnology. In: Biotechnology annual review. Band 9, 2003, S. 199–247, PMID 14650928
- J. A. Akkara, K. J. Senecal, D. L. Kaplan: Synthesis and characterization of polymers produced by horseradish peroxidase in dioxane. In: Journal of Polymer Science. 29 (11), October 1991, S. 1561–1574. doi:10.1002/pola.1991.080291105.
- Y. P. Chau, K. S. Lu: Investigation of the blood-ganglion barrier properties in rat sympathetic ganglia by using lanthanum ion and horseradish peroxidase as tracers. In: Acta Anatomica. 153 (2), 1995, S. 135–144. doi:10.1159/000313647. PMID 8560966.
- S. Avrameas, T. Ternynck: Peroxidase labelled antibody and Fab conjugates with enhanced intracellular penetration. In: Immunochemistry. Band 8, Nummer 12, Dezember 1971, S. 1175–1179, PMID 5150003.
- P. K. Nakane, A. Kawaoi: Peroxidase-labeled antibody. A new method of conjugation. In: The journal of histochemistry and cytochemistry : official journal of the Histochemistry Society. Band 22, Nummer 12, Dezember 1974, S. 1084–1091, doi:10.1177/22.12.1084, PMID 4443551.
- J. W. Lichtman, D. Purves: Cell marking with horseradish peroxidase. Principles of neural development. Sinauer Associates, Sunderland, Mass 1985, ISBN 0-87893-744-7, S. 114.
Einzelnachweise
- Carlsson GH, Nicholls P, Svistunenko D, Berglund GI, Hajdu J: Complexes of horseradish peroxidase with formate, acetate, and carbon monoxide. In: Biochemistry. 44, Nr. 2, Jan 2005, S. 635–42. doi:10.1021/bi0483211. PMID 15641789.
- Gajhede M, Schuller DJ, Henriksen A, Smith AT, Poulos TL: Crystal structure of horseradish peroxidase C at 2.15 A resolution. In: Nature Structural Biology. 4, Nr. 12, Dec 1997, S. 1032–8. doi:10.1038/nsb1297-1032. PMID 9406554.
- Henry Delincee, Bertold J. Radola: Fractionation of Horseradish Peroxidase by Preparative Isoelectric Focusing, Gel Chromatography and Ion-Exchange Chromatography. In: European Journal of Biochemistry. 52, 1975, S. 321, doi:10.1111/j.1432-1033.1975.tb04000.x.
- A. Samuni, E. Maimon, S. Goldstein: Nitroxides protect horseradish peroxidase from H2O2-induced inactivation and modulate its catalase-like activity. In: Biochimica et Biophysica Acta. [elektronische Veröffentlichung vor dem Druck] März 2017, doi:10.1016/j.bbagen.2017.03.021, PMID 28365302.
- L. Haifeng, L. Yuwen, C. Xiaomin, W. Zhiyong, W. Cunxin: Effects of sodium phosphate buffer on horseradish peroxidase thermal stability. In: Journal of Thermal Analysis and Calorimetry. 93, 2008, S. 569, doi:10.1007/s10973-007-8407-y.
- Sedigheh Asad, Seyed-Fakhreddin Torabi, Mehrnoosh Fathi-Roudsari, Nasser Ghaemi, Khosro Khajeh: Phosphate buffer effects on thermal stability and H2O2-resistance of horseradish peroxidase. In: International Journal of Biological Macromolecules. 48, 2011, S. 566, doi:10.1016/j.ijbiomac.2011.01.021.
- D. Schomburg, M. Salzmann, D. Stephan (Herausgeber): Enzyme Handbook 7, (1993). Kapitel EC 1.11.1.7:1–6. ISBN 978-3-642-48964-8.
- L. M. Shannon, E. Kay, J. Y. Lew: Peroxidase isozymes from horseradish roots. I. Isolation and physical properties. In: The Journal of biological chemistry. Band 241, Nummer 9, Mai 1966, S. 2166–2172, PMID 5946638.
- Helmward Zollner: Handbook of Enzyme Inhibitors, 2. Auflage, Teil A, S. 367–368 (1993).
- T. Gundinger, O. Spadiut: A comparative approach to recombinantly produce the plant enzyme horseradish peroxidase in Escherichia coli. In: Journal of biotechnology. [elektronische Veröffentlichung vor dem Druck] März 2017, doi:10.1016/j.jbiotec.2017.03.003, PMID 28288816.
- V. G. Grigorenko, I. P. Andreeva, M. Y. Rubtsova, A. M. Egorov: Recombinant horseradish peroxidase: production and analytical applications. In: Biochemistry. Biokhimiia. Band 80, Nummer 4, April 2015, S. 408–416, doi:10.1134/S0006297915040033, PMID 25869357.
- O. Ryan, M. R. Smyth, C. O. Fágáin: Horseradish peroxidase: the analyst's friend. In: Essays in biochemistry. Band 28, 1994, S. 129–146, PMID 7925315.
- Edward A. Greenfield: Antibodies: A Laboratory Manual. Cold Spring Harbor Laboratories, 1988. ISBN 0-87969-314-2. S. 346–348.
- Beyzavi K, Hampton S, Kwasowski P, Fickling S, Marks V, Clift R: Comparison of horseradish peroxidase and alkaline phosphatase-labelled antibodies in enzyme immunoassays. In: Annals of Clinical Biochemistry. 24 ( Pt 2), Mar 1987, S. 145–52. PMID 3035992.
- S. S. Deshpande: Enzyme Handbook 7: Class 1.5–1.12: Oxidoreductases. Springer, 1994, ISBN 978-3-642-48964-8. S. 169–171.
- Salehe Ghasempur, Seyed-Fakhreddin Torabi, Seyed-Omid Ranaei-Siadat, Mehdi Jalali-Heravi, Nasser Ghaemi, Khosro Khajeh: Optimization of Peroxidase-Catalyzed Oxidative Coupling Process for Phenol Removal from Wastewater Using Response Surface Methodology. In: Environmental Science & Technology. 41, Nr. 20, 1. Oktober 2007, ISSN 0013-936X, S. 7073–7079. doi:10.1021/es070626q.
- Y. L. Kapeluich,. Rubtsova MYu, A. M. Eg: Enhanced chemiluminescence reaction applied to the study of horseradish peroxidase stability in the course of p-iodophenol oxidation. In: Journal of bioluminescence and chemiluminescence. Band 12, Nummer 6, 1997 Nov-Dec, S. 299–308, doi:10.1002/(SICI)1099-1271(199711/12)12:6<299::AID-BIO459>3.0.CO;2-S, PMID 9509338.
- C. Haan, I. Behrmann: A cost effective non-commercial ECL-solution for Western blot detections yielding strong signals and low background. In: Journal of immunological methods. Band 318, Nummer 1–2, Januar 2007, S. 11–19, doi:10.1016/j.jim.2006.07.027, PMID 17141265.