Polytetrahydrofuran
Polytetrahydrofuran wird durch saure Katalyse bei 30 bis 40 °C aus Tetrahydrofuran hergestellt. Der chemische Name für Polytetrahydrofuran ist Polytetramethylenetherglykol (PTMEG)
| Strukturformel | |||||||
|---|---|---|---|---|---|---|---|
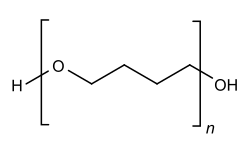 | |||||||
| Allgemeines | |||||||
| Name | Polytetrahydrofuran | ||||||
| Andere Namen |
| ||||||
| CAS-Nummer | 25190-06-1 | ||||||
| Monomer | Tetrahydrofuran | ||||||
| Summenformel der Wiederholeinheit | C4H8O | ||||||
| Molare Masse der Wiederholeinheit | 72,11 g·mol−1 | ||||||
| Art des Polymers | |||||||
| Kurzbeschreibung |
weißer wachsartiger Feststoff[1] | ||||||
| Eigenschaften | |||||||
| Aggregatzustand |
fest | ||||||
| Dichte |
0,982 g/cm3 (30 °C)[1] | ||||||
| Schmelzpunkt |
23–28 °C[1] | ||||||
| Löslichkeit |
< 10 g/l in Wasser bei 20 °C[1] | ||||||
| Sicherheitshinweise | |||||||
| |||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||
Polytetrahydrofuran ist ein Vorprodukt für die Synthese von Textilfasern (Elasthan, Spandex), die sich durch hohe Elastizität auszeichnen. Hierbei bildet Polytetrahydrofuran die Softkomponente. Daneben kann man z. B. auch Polyurethane aus Polytetrahydrofuran produzieren.
Polytetrahydrofuran besteht in der Regel aus einem Gemisch verschiedener Oligomere/Polymere mit einer definierten mittleren molaren Masse. Bei Raumtemperatur ist Polytetrahydrofuran fest, wird daher bei erhöhten Temperaturen, z. B. 60–70 °C, in flüssiger Form gelagert, abgefüllt und transportiert.
Bedeutender Hersteller in Deutschland ist BASF in Ludwigshafen (250.000 Tonnen/Jahr).[3]
Herstellung
Grundstoff für die Herstellung von PolyTHF ist Ethin (Acetylen), welches u. a. aus Erdgas gewonnen werden kann. Dieses wird mit Formaldehyd zu 2-Butin-1,4-diol und durch Hydrierung schließlich zu 1,4-Butandiol umgesetzt. Durch säurekatalysierte Cyclisierung von 1,4-Butandiol wird Tetrahydrofuran (THF) gewonnen.
PolyTHF kann nun säurekatalytisch, beispielsweise über Bortrifluorid oder anderer Lewis-Säuren und Wasser oder einem Alkohol, polymerisiert werden.
PolyTHF kann so mit unterschiedlichen molare Massen hergestellt werden, welches durch Ergänzung einer Ziffer dargestellt wird: So hat PolyTHF 1000 eine mittlere molare Masse von etwa 1000 g·mol−1.[4]
Verwendung
PolyTHF findet in sehr unterschiedlichen Bereichen Verwendung:
Textilindustrie
Die Textilindustrie nutzt PolyTHF zur Herstellung von Spandex- bzw. Elastan-Fasern. Sie verarbeitet die Spandex-Fasern zusammen mit Baumwoll-, Polyamid- oder Polyester-Fasern zu Stoffen, aus denen beispielsweise Stretch-Jeans, Badeanzüge, Socken, Unterwäsche oder Sport-Funktionskleidung hergestellt werden. Spandex-Fasern zeichnen sich vor allem durch ihre hohe Elastizität aus. Außerdem sind sie leicht, formbeständig und schonend zur Haut.
Weitere Anwendungsgebiete
Aus Polytetrahydrofuran werden außerdem thermoplastische Polyurethan-Elastomere (TPU) hergestellt. Diese werden zum Beispiel zu flexiblen und abriebfesten Schläuchen oder Kabelummantelungen verarbeitet. Auch Skateboard- und Inlineskate-Rollen bestehen teilweise aus PolyTHF.
Recycling
Durch Erhitzen von Polytetrahydrofuran in Gegenwart von Katalysatoren lässt sich das Polymer depolymerisieren und das Monomer Tetrahydrofuran kann destillativ zurückgewonnen werden. Das Produkt kann für die Synthese von neuem Polytetrahydrofuran genutzt werden (chemisches Recycling).[5][6]
Einzelnachweise
- Datenblatt PTHF 1000, stabilisiert mit 2,6-Di-tert-butyl-4-methylphenol (PDF) bei Merck, abgerufen am 19. Januar 2011.
- Datenblatt Poly(tetrahydrofuran) average Mn ~1,000 bei Sigma-Aldrich, abgerufen am 29. Mai 2011 (PDF).
- BASF Intermediates Division – PolyTHF.
- BASF SE: Expand your success on elastomers: PolyTHF. BASF SE, abgerufen am 27. November 2018 (englisch).
- S. Enthaler, A. Trautner: Iron-Catalyzed Ring-Closing Depolymerization of Poly(tetrahydrofuran). In: ChemSusChem. Band 6, Nr. 8, 1. August 2013, ISSN 1864-564X, S. 1334–1336, doi:10.1002/cssc.201300380.
- S. Enthaler: Zinc(II)-triflate as catalyst precursor for ring-closing depolymerization of end-of-life polytetrahydrofuran to produce tetrahydrofuran. In: Journal of Applied Polymer Science. Band 131, Nr. 2, 15. Januar 2014, ISSN 1097-4628, S. n/a–n/a, doi:10.1002/app.39791.
