Klippschliefer
Der Klippschliefer (Procavia capensis), mitunter auch Wüstenschliefer oder Klippdachs genannt, ist eine Art in der Ordnung der Schliefer (Hyracoidea). Sein Körperbau erinnert an Meerschweinchen. Die Gliedmaßen sind kurz und kräftig, ein Schwanz fehlt. Am Rücken besteht ein auffallender farbiger Fleck, der eine Drüse umgibt. Markant sind auch die zahlreichen Tasthaare, die das Fell durchsetzen. Von allen heutigen Schliefern hat der Klippschliefer das größte Verbreitungsgebiet. Dieses ist nicht geschlossen, ein Verbreitungsschwerpunkt findet sich im südlichen Afrika, ein weiterer nördlich des Kongobeckens und südlich der Sahara. Von hier zieht das Vorkommen über den nordöstlichen Teil des Kontinents nach Vorderasien. Die bewohnten Lebensräume bestehen aus Wüsten und felsigen Landschaften, zudem aus Offenlandgebieten und Wäldern. Die Tiere sind sowohl im Flachland wie auch in hohen Gebirgslagen anzutreffen. In weiten Teilen Afrikas tritt der Klippschliefer gemeinsam mit dem Buschschliefer auf.
| Klippschliefer | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
_(7042223567).jpg.webp)
Klippschliefer | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name der Gattung | ||||||||||||
| Procavia | ||||||||||||
| Storr, 1780 | ||||||||||||
| Wissenschaftlicher Name der Art | ||||||||||||
| Procavia capensis | ||||||||||||
| (Pallas, 1766) |
Die Lebensweise des Klippschliefers ist gut erforscht. Er bewohnt Felsspalten und Höhlen und tritt vorwiegend tagaktiv auf. Als Hauptnahrung dienen Pflanzen, ihre Zusammensetzung ist abhängig von Jahreszeit und Angebot: in der Trockenzeit bevorzugen die Tiere weiche Pflanzennahrung, in der Regenzeit dagegen härtere. Sie leben gesellig in Kolonien, das Sozialgefüge ist komplex. Eine Gruppe besteht meist aus einem dominanten Männchen, den fortpflanzungsfähigen Weibchen und dem Nachwuchs. Daneben treten noch einzeln lebende Männchen auf. Die Gruppe geht gemeinsam auf Nahrungssuche. Den Großteil des Tages verbringt der Klippschliefer vor allem einzeln oder in Gruppen ruhend, was auf die wenig beständige Körpertemperatur und den niedrigen Stoffwechsel zurückzuführen ist. Das besetzte Territorium wird gegen Eindringlinge verteidigt. Das dominante Männchen stößt zudem markante Rufe aus, die sehr komplex sind. Daneben verfügt der Klippschliefer über eine vielfältige Sozialkommunikation. Nachwuchs kommt einmal jährlich zur Welt, die Weibchen einer Gruppe gebären häufig in kurzen Zeitabständen. Die Jungen sind bei der Geburt weit entwickelt und nach 16 bis 29 Monaten geschlechtsreif. Die jungen Männchen verlassen dann die Kolonie. Bedeutendste Fressfeinde stellen verschiedene Greifvögel und Raubtiere dar.
Zu den frühesten Erwähnungen des Klippschliefers gehören jene aus dem Alten Testament. Modernere Berichte reichen bis in das 17. Jahrhundert zurück. Die wissenschaftliche Erstbeschreibung datiert in das Jahr 1766, vor allem im Verlauf des 19. Jahrhunderts wurde der Klippschliefer in der Gattung Hyrax geführt. Anfänglich galten die Tiere als nahe verwandt mit den Nagetieren, später sah man sie eher in einer engeren Beziehung mit anderen Huftieren. Bis in die 1970er Jahre waren zudem mehrere Arten anerkannt. Daneben bestehen noch einige fossile Vertreter, der älteste Nachweis datiert in das Pliozän vor etwa 5 Millionen Jahren. Der heutige Bestand des Klippschliefers wird als ungefährdet eingestuft.
Merkmale
Habitus


Der Klippschliefer ist der bekannteste Vertreter der Schliefer. In der Körpergröße entspricht er einem Kaninchen. Mehr als 60 untersuchte Individuen aus der Serengeti wiesen eine Gesamtlänge von 39,5 bis 57,8 cm und ein Körpergewicht von 1,8 bis 5,4 kg auf. Weitere 30 vermessene Exemplare aus Südafrika variierten in ihrer Körperlänge von 37,6 bis 62,8 cm bei einem Körpergewicht von 1,5 bis 4,3 kg.[1] Einzelne Individuen werden bis 76,2 cm lang.[2] Männliche und weibliche Tiere sind etwa gleich groß gebaut. Bezüglich der Körpergröße lassen sich Variationen im gesamten Verbreitungsgebiet feststellen. Diese hängen teilweise von der Umgebungstemperatur, so dass der Klippschliefer offensichtlich der Bergmannschen Regel unterliegt.[3] Es gibt niederschlagsbezogene Unterschiede in der Körpergröße. So nimmt in der Regel die Körpermaße in Gegenden mit bis zu 700 mm Jahresniederschlag kontinuierlich zu und fällt dann bei höheren Niederschlägen wieder ab.[4][5][6][1]
Allgemein handelt es sich um äußerlich dem Meerschweinchen oder dem Pfeifhasen ähnelnde Tiere mit einem kompakten Körperbau. Die Beine sind kurz, der Schwanz fehlt. Das Fell ist dicht und besteht aus rund 25 mm langen Haaren, die Unterwolle hat eine dichte, weiche Textur und ist kurz. Die Rückenfärbung reicht von gelblich-bräunlich bis dunkel bräunlich. Häufig wirkt das Fell gesprenkelt, was durch die Einzelhaare mit dunklen Basen und Spitzen sowie einem helleren, unterschiedlich breiten Band am Schaft hervorgerufen wird. Am hinteren Rücken markiert ein abweichend gefärbter Fleck eine etwa 15 mm lange Drüse. Die Färbung des Flecks unterscheidet sich geographisch und kann cremig-gelblich bis bräunlich oder schwärzlich sein. Die Haare des Flecks sind aufrichtbar. Zumeist erscheint die Körperunterseite heller als die Oberseite, die Haare hier werden länger und weisen keine zusätzlichen Schaftbänder auf. Gelegentlich wurden albinotische Tiere beobachtet.[7] Das Fell ist darüber hinaus von 60 bis 70 mm langen, dunklen Tasthaaren durchsetzt. Weitere Vibrissen treten im Gesicht auf, so oberhalb der Augen, an der Oberlippe und am Kinn, ihre Länge beträgt bis zu 100 mm. Die Stirn ist häufig dunkler als der restliche Körper, während über den Augen und am Kinn auch hellere Flecken auftreten. Die Ohrlänge beträgt 27 bis 38 mm, die Pupille des Auges weist eine eiförmige Gestalt auf. Bei starker Sonneneinstrahlung schiebt sich vom oberen Teil der Iris ein zusätzliches Schild hervor, das umbraculum („Schirm“) genannt wird und der Pupille damit eine nierenartige Form verleiht.[8][9] Die Hände verfügen über vier, die Füße über drei Strahlen. Lediglich an der inneren Zehe des Hinterfußes ist eine gebogene Kralle ausgebildet, alle anderen Zehen und Finger tragen platte, hufartige Nägel. Die Sohlen sind dunkel und nackt sowie mit einem ledrigen Hautpolster überzogen, das von zahlreichen Drüsen durchsetzt ist.[4][5][6][1]
Bei Männchen befindet sich der Penis etwa 35 mm vor dem Anus, was eine doppelt so große Distanz gegenüber den Baumschliefern (Dendrohyrax) ist, aber etwa nur der Hälfte des Zwischenraumes beim Buschschliefer (Heterohyrax) entspricht. Der Penis ist einfach gebaut mit einem ovalen Querschnitt.[10] Weibchen verfügen über drei Zitzenpaare, von denen zwei in der Leistengegend liegen, das dritte sich aber im Brustbereich befindet.[4][5][6][1]
Schädel- und Gebissmerkmale

Die größte Länge des Schädels variiert von 80 bis 104,2 mm, die größte Breite von 41,7 bis 64,9 mm. Bezüglich der Schädellänge treten nur wenige Unterschiede zwischen den Geschlechtern auf, die Schädelbreite ist bei Männchen aber deutlich größer, da diese einen stärkeren Jochbogen mit einer massiveren Kaumuskulatur entwickeln.[3] Das Rostrum ist allgemein relativ kurz, die Stirnlinie verläuft gerade, das Hinterhauptsbein steht senkrecht und ist breit. Die Orbita liegen weit auseinander und sind nach vorn gerichtet, sie haben eine ovale Form. Das Os interparietale (ein Schädelknochen zwischen dem Hinterhauptsbein und den Scheitelbeinen) wird zumeist von den Scheitelbeinen überwachsen. Die Temporalleisten liegen eng beieinander und formen teilweise einen Scheitelkamm. Der Postorbitalbogen ist zumeist nicht geschlossen. An der Schädelbasis fällt der lange und spitze Processus paroccipitalis auf, der tiefer reicht als die nur flache Paukenblase. Der Unterkiefer wirkt massiv, der aufsteigende Ast ist sehr breit. Der Winkelfortsatz verbreitert sich nach hinten in eine kleine Platte. Der Kronenfortsatz ragt nur wenig über den Gelenkfortsatz auf. Er ist kurz und leicht nach hinten gebogen. Das Foramen mentale öffnet sich unterhalb des dritten Prämolaren.[11][4][5][12]
_(7042219593).jpg.webp)
Das Gebiss besteht aus 32 Zähnen und bildet folgende Zahnformel: . Dadurch ist die Zahnanzahl gegenüber den anderen Schlieferarten leicht reduziert. Der vorderste untere Prämolar fehlt vor allem bei den südlichen Populationen, was als sicheres Unterscheidungsmerkmal zum Buschschliefer gilt. Bei den Tieren in den nördlichen Verbreitungsarealen kommt der Zahn jedoch häufig vor, ist aber eher klein. Der obere Schneidezahn ähnelt einem Eckzahn (caniniform). Es tritt ein deutlicher Geschlechtsdimorphismus auf, der ausgeprägter ist als bei den anderen Schliefern. Männchen verfügen über einen großen, massiven Oberkieferschneidezahn, der einen dreieckigen Querschnitt aufweist. Er schließt mit dem äußeren unteren Schneidezahn. Bei Weibchen ist er kleiner und rund im Querschnitt, außerdem steht er mittig den beiden unteren Schneidezähnen gegenüber. Die Schneidezähne des Unterkiefers sind flach, Jungtiere weisen häufig noch die für Schliefer typische Aufteilung in drei Höckerchen auf (tricuspid oder trifid), diese geht bei älteren Individuen aber durch Abnutzung verloren. Sowohl die oberen wie auch die unteren inneren Schneidezähne stehen nicht geschlossen. Das Diastema, welches die Schneidezähne vom hinteren Gebiss trennt, ist kurz, im oberen Gebiss aber länger als im unteren. Die Backenzähne haben allgemein hohe Zahnkronen (hypsodont). Im Oberkiefer wird die Mahlzahnreihe länger als die Reihe der Vormahlzähne.[11][4][5][12]
Verbreitung
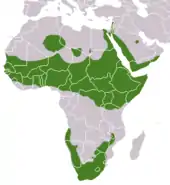
Der Klippschliefer kommt in weiten Teilen Afrikas und in Westasien vor, sein Verbreitungsgebiet ist aber nicht geschlossen. Ein nördlicher Verbreitungsschwerpunkt beschränkt sich auf das Afrika südlich der Sahara und nördlich des Kongobeckens. Es reicht im Westen vom Senegal und dem Süden von Mauretanien nach Osten bis nach Uganda, Kenia und dem Norden von Tansania. Nach Norden zieht es sich dann entlang der östlichen Nilseite über den Sinai nach Israel und den Libanon weiter über die gebirgige Westküste der Arabischen Halbinsel mit Saudi-Arabien, Jemen und Oman. Das Auftreten der Tiere in Syrien und in der Türkei ist unbestätigt. Die Nordgrenze in Afrika ist nicht genau bekannt, es sind einzelne Inselpopulationen aus Algerien und Libyen belegt, so im Akkakus-Gebirge, auf dem Ahaggar-Plateau[13] und im Tibesti. Das südliche Verbreitungsgebiet umfasst das südliche Afrika und schließt weiter nördlich den Osten von Botswana, den Süden von Simbabwe und den Südosten von Sambia ein ebenso wie die Küstenregionen von Namibia und Angola.[5][6][1]
Die Tiere bewohnen eine Vielzahl von Landschaften bestehend aus Wüsten, Savannen und tropischen Regenwäldern. Sie bevorzugen Habitate mit Kopjes, Geröllfeldern oder steilen Kliffs, die zahlreiche Hohlräume und Verstecke als Unterschlupf bieten. Teilweise hat der Klippschliefer Erosionsflächen wie die Karoo erschlossen. In Gebieten mit einer starken Überpopulation weicht er auch in Erdhöhlen des Erdferkels oder von Erdmännchen aus. Die Tiere dringen unter Umständen bis in die Bereiche menschlicher Siedlungen vor, wenn dort zum Beispiel durch städtebauliche Begleitumstände geeignete Unterschlüpfe entstanden sind.[14] Die Höhenverbreitung reicht vom Meeresspiegelniveau bis auf etwa 4300 m wie am Mount Kenya[15] oder 4130 m wie in den Bale Mountains in Äthiopien.[16] In vielen Gebieten Afrikas kommt der Klippschliefer sympatrisch mit dem Buschschliefer vor, beide Arten bewohnen mitunter die gleichen Kopjes. In der Serengeti variiert die Populationsdichte zwischen 5 und 56 Tieren je Hektar Kopje. Die Gruppendichte schwankt über die Zeit wie eine 17-jährige Untersuchung aufzeigt. Dabei nahm an einem 3600 m² großen Kopje die Individuenanzahl kontinuierlich von 2 Tieren im Jahr 1971 auf 18 Tiere im Jahr 1988 zu. An einem weiteren, 2000 m² großen Kopje stieg sie zwischen 1971 und 1976 von 5 auf zunächst 21 Tiere an, fiel dann bis 1984 auf 10 ab und betrug 1988 wieder 11. Lokale Ereignisse können auch zum Aussterben einzelner Gruppen führen, wie 1975 an einem 2500 m² großen Kopje beobachtet.[17][18] Vergleichbare Schwankungen ließen sich während einer 13-jährigen Forschung im Matobo-Nationalpark in Simbabwe ermitteln. Zwischen 1992 und 1996 betrug die Individuendichte 0,73 bis 0,94 Tiere je Hektar, was einer Gesamtpopulation im Schutzgebiet von etwa 31.100 bis 40.000 Tieren entsprach.[19][20] Bis 1998 stieg die Dichte auf rund 1,4 Individuen je Hektar an mit entsprechend geschätzten 59.200 Einzeltieren,[21] reduzierte sich aber bis 2005 wieder auf rund 0,8 Individuen je Hektar. Allerdings gab es im Jahr 2003 noch einmal ein Hoch, das fast bei dem Wert von 1998 lag. Allein von 2003 auf 2004 schrumpfte die Population um 43 %. Die an 28 untersuchten Fundstellen tatsächlich beobachtete Individuenanzahl der beiden Jahre belief sich auf 663 beziehungsweise 378 Tiere.[7][22] Dabei korrelierte ein jeweiliger Anstieg der Population im Untersuchungszeitraum mit regenreichen Perioden und einer erhöhten Anzahl an Nachwuchs. Offensichtlich stellt der Niederschlag einen beeinflussenden Faktor dar.[23] Vergleichbare Zahlen sind auch für die Bale Mountains dokumentiert. Hier wurden in einem Untersuchungszeitraum von 2010 bis 2013 an neun Lokalitäten auf rund 50,3 km² Fläche durchschnittlich bis zu 30.000 Individuen gezählt. Die Populationsdichte reichte gebietsweise von 25 bis 1700 Tieren je Quadratkilometer. Die Anzahl und Dichte der Individuen zeigte signifikante Unterschiede zwischen der Regen- und Trockenzeit, mit jeweils höheren Werten im feuchten Jahresabschnitt.[16][6][1]
Lebensweise
Soziale Organisation


Der Klippschliefer lebt in Kolonien von bis zu 80 Tieren in zerklüfteten, felsigen Landstrichen oder in Regionen mit Kopjes. Hierbei handelt es sich um mehrere Tausend Quadratmeter große Felsformationen, die als „Inselberge“ bis zu 40 m hoch aufragen.[24] Die Kolonien bestehen aus einem dominanten Männchen und mehreren miteinander verwandten Weibchen sowie den Jungtieren. Je nach Ausdehnung der Kopjes sind die Kolonien unterschiedlich groß. In der Serengeti bestand eine in den 1970er Jahren untersuchte Gruppe an einem 2500 m² großen Kopje aus durchschnittlich 9,9 und maximal 15 Individuen. Eine weitere Gruppe auf einem 10.050 m² großen Kopje umfasste durchschnittlich 26 Individuen, sie kam hier gemeinsam mit einer Kolonie von Buschschliefern vor.[17][25] Im En-Gedi-Nationalpark in Israel variierte die Gruppengröße während einer zehnjährigen Dokumentation zwischen 5 und 18, 6 und 10 sowie 7 und 21 Individuen.[26] Entsprechende Zahlen für die Bale Mountains in Äthiopien schwanken zwischen 4 und 86 Individuen je Kolonie bei insgesamt 63 dokumentierten Kolonien. In der Regenzeit besteht hier die Gruppe aus durchschnittlich 49, in der Trockenzeit aus durchschnittlich 38 Individuen. Auch die Anzahl der Kolonien ist jahreszeitabhängig.[16] Kleinere Kopjes werden zumeist von einer Gruppe bewohnt, die das gesamte Areal nutzt. Auf größeren sind auch mehrere Kolonien ansässig, jede der Gruppe besetzt dann ein eigenes Territorium.[6][1]
Innerhalb einer Klippschliefer-Population treten verschiedene Rangstufen von Männchen auf. Das dominante oder territoriale Männchen okkupiert eine weibliche Gruppe und verteidigt diese gegen Rivalen. Es verpaart sich mit den geschlechtsbereiten, ausgewachsenen Weibchen der Gruppe. Auf größeren Kopjes mit mehreren Kolonien treten zusätzlich noch „Randmännchen“ auf. Diese haben keine eigene Gruppe, sondern besiedeln einzelgängerisch die Randgebiete von Kolonien, wo sie eher mit jüngeren Weibchen kopulieren. Unter den einzelnen „Randmännchen“ liegt eine Hierarchie vor, so dass das ranghöchste beim Verschwinden eines territorialen Männchens die Gruppe übernimmt. Darüber hinaus kommen frühe und späte Auswanderer vor. Hierbei handelt es sich überwiegend um junge, ausgewachsene Männchen, die ihre angestammte Familiengruppe verlassen haben und umherwandern. Sie werden zu „Randmännchen“ oder wechseln die Kopjes und gründen neue Familiengruppen.[25][27] Ob unter den Weibchen innerhalb einer Gruppe Rangunterschiede bestehen, ist nicht eindeutig. Häufig führen aber ausgewachsene Weibchen die Gruppe auf ihren Wanderungen zu den Nahrungsplätzen an. Sie verhalten sich auch anfänglich aggressiv gegen fremde Weibchen.[25] Studien an Tieren aus Israel zeigen, dass sich Weibchen einer Gruppe offensichtlich im Testosteron-Spiegel unterscheiden, der unter Umständen den des Männchens erreichen kann. Es ist bisher unklar, ob dieser tatsächlich eine soziale Rangstufe anzeigt.[28] Im südlichen Afrika wurde beobachtet, dass die ausgewachsenen Weibchen und das territoriale Männchen eher die zentralen Bereiche eines Kopjes einnehmen, die Jungtiere sich dagegen mehr peripher verteilen.[27][6][1]
Neben den jungen Männchen verlassen auch vereinzelt Weibchen die ursprüngliche Familiengruppe und schließen sich einer neuen an. Sowohl die wandernden Männchen als auch die wandernden Weibchen bilden wohl die Basis der neuen Kolonien. Die dabei zurückgelegten Distanzen variieren je nach Landschaft und liegen in der Serengeti bei rund 2 km und mehr, im südwestlichen Afrika bei 250 bis 500 m.[17][27] Das Überwinden größere Entfernungen in den entsprechenden Gebieten ist mit dem Durchqueren offener Landschaften und daher mit der Gefahr verbunden, durch Fressfeinde erbeutet zu werden oder erhöhtem Stress durch Witterung beziehungsweise Nahrungsmangel ausgesetzt zu sein. Auch würden weiter entfernte Kopjes den Genfluss zwischen den einzelnen Kolonien erschweren. Allerdings zeigen genetische Untersuchungen, dass die Variabilität beim Klippschliefer sehr gering ist und in einzelnen Familiengruppen eine gewisse Inzucht vorliegt.[29][6][1]
Unterschlupf und Energiehaushalt

Der Klippschliefer ist tagaktiv. Er bewegt sich in dem felsigen Habitat behände fort. Seine Füße sind nicht an das Graben angepasst, dafür an das Klettern an Steilstufen, glatten Felsoberflächen und auf Bäumen. Dies bewirken unter anderem die stark zusammenziehbaren, ledrigen Fußsohlen. Die dort ausgebildeten Drüsen sondern ein Sekret ab, das die Grifffestigkeit erhöht. In den Felslandschaften und Kopjes nutzt der Klippschliefer Höhlen und Felsspalten als Unterschlupf. Die Eingangshöhen liegen bei rund 14 bis 15 cm, dies entspricht etwa der doppelten Schädelhöhe. Dadurch kann der Klippschliefer sicher in die Höhlen kriechen, mögliche größere Beutegreifer werden aber ferngehalten. Die Höhlen müssen außerdem eine Familiengruppe beherbergen können, was rund 1 m² Grundfläche bedingt. In der Regel siedelt sich der Klippschliefer in Felsformationen mit mehreren Höhlen in unmittelbarer Nähe zueinander an. Die einzelnen Eingänge sind oberirdisch mit Pfaden verbunden. Die Höhlen weisen ein ausgeglicheneres Klima auf, als es die unmittelbare Umgebung bietet. In den ostafrikanischen Tieflandgebieten schwankt die Temperatur innerhalb der Unterschlüpfe je nach Region zwischen 14 und 32 °C, während sie in der Umgebung auch auf bis über 40 °C ansteigen kann. In den Hochgebirgsregionen bewahren sie zusätzlich vor frostigen Bedingungen. Gleiches trifft auf die Luftfeuchtigkeit zu, die in den Höhlen und Felsspalten eine geringere Spanne aufweist als in der unmittelbaren Umgebung.[24][30] Die Körpertemperatur des Klippschliefers ist instabil und variiert, zumeist fällt sie nachts um mehrere Grad ab.[31][32][33] Die Maximalwerte reichen von 33,5 am frühen Morgen bis 40,5 °C am späten Nachmittag. In den wärmeren Jahreszeiten liegt die durchschnittliche Körpertemperatur höher als in der kühleren, sie schwankt im Sommer auch signifikanter als im Winter. Ähnlich verhält es sich mit Tag und Nacht. So sind die Schwankungsbereiche der Körpertemperatur im Sommer tagsüber doppelt so hoch wie nachts, im Winter nähern sie sich stärker an. Auffallend ist, dass die Änderungen der Körpertemperatur nicht unbedingt mit den täglichen Änderungen der Umgebungstemperatur einhergehen. Die thermoneutrale Zone liegt bei 20 bis 30 °C, der Wert wird in der warmen Jahreszeit meist von den Außentemperaturen überschritten, in der kühlen Jahreszeit nicht immer erreicht.[34][35] Verbunden mit der variierenden Körpertemperatur ist auch eine niedrige Stoffwechselrate, die 30 % niedriger liegt als bei einem gleich großen Tier zu erwarten wäre. Beides ist gewichtsbezogen und nimmt bei steigendem Körpergewicht zu. Der Klippschliefer spart durch die labile Körpertemperatur und den niedrigen Metabolismus Energie, ist aber von ausgleichenden Unterschlüpfen abhängig.[36][5][6][1]
Tagesaktivität
_(6437297097).jpg.webp)
Der niedrige Metabolismus und die labile Körpertemperatur wirken sich auch auf die Tagesaktivität des Klippschliefers aus. Die Schlafphase dauert durchschnittlich 6 Stunden und 50 Minuten, was mehr als ein Viertel des Tages entspricht.[37] Mit Ausnahme der täglichen Fressphasen oder die Paarungszeit verbringen ungestörte Tiere den Tag überwiegend ruhend. Dies findet innerhalb oder außerhalb der Unterschlüpfe statt und nimmt mehr als 90 % der täglich verfügbaren Zeit ein. Die Tiere formieren dabei häufig während kühlerer Tages- und Jahreszeiten Gruppen, in denen sie entweder dicht beieinander oder teilweise auch übereinander liegen, die Köpfe der einzelnen Individuen zeigen dabei immer nach außen. Bei letzterem erklimmen meist Jungtiere die oberen Positionen. Derartige Gruppenbildungen sind vorwiegend am frühen Morgen anzutreffen, wenn die Tiere ihre Verstecke verlassen, Teile der Kopjes sich aber noch im Schatten befinden. Bei höherem Stand der Sonne zerfallen die Gruppen und die Tiere ruhen dann einzeln. Sie liegen parallel gegenständig oder in einer gleichgerichteten, leicht radialen Position zueinander mit den Köpfen etwas weiter voneinander entfernt. In der Regel werden die Beine abgewinkelt und nach hinten gestreckt, die Sohlen sind nach oben gerichtet. Je nach Sonnenintensität wechseln sie häufig ihre Position, um andere Körperteile bescheinen zu lassen. Das frühmorgendliche Gruppenbilden beeinflusst die Körpertemperatur und dient dem Aufwärmen nach der kühlen Nächten, das einzelne Sonnenbaden unterstützt vor allem tagsüber die Energiespeicherung. In den heißen Tagesphasen zieht sich der Klippschliefer in den Schatten zurück, möglicherweise um einem stärkeren Wasserverlust durch Transpiration zu entgehen.[32][38] Einen Teil der Ruhephasen beansprucht die Körper- und Fellpflege. Für beides werden sowohl die Kralle des Hinterfußes als auch die unteren Schneidezähne eingesetzt. Neben den Sonnenbädern kommen auch Sand- oder Staubbäder vor, die wohl eher der Beseitigung von äußeren Parasiten dienlich sind.[5][6][1]
Soziale Interaktionen
Als sozial lebendes Tier besitzt der Klippschliefer verschiedene Kommunikationsformen. Das Zusammenhäufen bei kühleren Temperaturen hat nicht nur den Effekt der Stabilisierung der Körpertemperatur, es bewirkt auch eine bessere Erkennung von Fressfeinden. Außerdem unterstützt es eine stärkere soziale Verbundenheit und mindert das Aggressionspotential. Ähnliches gilt wahrscheinlich für die fächerförmige oder gegenständige Position verschiedener Tiere beim einzelnen Sonnenbaden. Generell sind Kopf-zu-Kopf-Begegnungen als antagonistisches Verhalten beim Klippschliefer aufzufassen.[32] Aggressives Verhalten findet hauptsächlich zwischen männlichen Tieren in der Paarungszeit statt. Bei Erregung richtet ein Tier die Haare des Rückenflecks auf. Der Winkel, in dem die Haare aufstehen, gibt Aufschluss über die Art der Erregung. So wird ein Winkel von 45° als Alarmzeichen interpretiert, ein senkrechtes Aufrichten aber als Bedrohung. Zusätzlich zieht das Tier dann die Oberlippe zurück und präsentieren die langen oberen Schneidezähne. Dem gegenüber zeigt ein Männchen in der Paarungszeit einem Weibchen mit voll aufgestellten Haaren seine Erregung an.[39][27] Neben diesen eindeutigen visuellen Zeichen hat auch der Geruchssinn eine hohe Bedeutung. Hier kommen unter anderem die Sekrete der Rückendrüse zum Einsatz, die etwa zur Etablierung von Mutter-Jungtier-Beziehungen dienen. Sie werden aber nicht zur Markierung des Territoriums eingesetzt.[39] Eine wichtige Rolle spielen die Latrinen, in die die Tiere einer Kolonie defäzieren. Während der Paarungszeit suchen Männchen Latrinen auf, um empfangsbereite Weibchen aufzuspüren. In den Latrinen verbinden sich der Kot und das mit Salz angereicherte Urin miteinander und bilden eine zähe Masse, die teilweise den Felsen hinabfließt. Die Masse verfestigt sich im Laufe der Zeit und bleicht aus. Sie wird als „Hyraceum“ bezeichnet.[24][40][6][1]
Lautgebung und Kommunikation
Vor allem die Lautkommunikation ist sehr variantenreich beim Klippschliefer. Es sind wenigstens 21 verschiedene Laute dokumentiert. Es überwiegen dabei verschiedene Grunz-, Brumm-, Quiek-, Knurr-, Schnaub- und Belllaute, die in unterschiedlichen Situationen ausgestoßen werden und zumeist Aggression, Befriedung oder Rückzug ausdrücken. So grunzt das dominante Männchen, wenn beim Fressen ein anderes Individuum zu nahe kommt, bei fortwährender Konfrontation knurrt es und geht in eine Beißattacke über. Einer zeitlich länger anhaltenden Bedrohung begegnet der Klippschliefer mit einem jammer- oder raspelartigen Laut oder mit einem kurzen Aufschrei. Markant ist ein bellender Warnruf, den ein Wächtertier bei einer eventuellen Bedrohung von sich gibt. Typisch für Weibchen sind weinende oder gurrende Töne nach der Geburt des Nachwuchses, die auch teilweise als Rufe nach den Jungen eingesetzt werden. Jungtiere, die Milch saugen wollen, lassen einen Zwitscherlaut ertönen. Ein Pfeifen und Zwitschern markiert eine friedliche Begegnung, erklingt aber auch bei Jungen bei Zufriedenheit, etwa nach dem Saugen. Allerdings bedeutet ein hartes Zwitschern zusätzlich Aggression. Die verschiedenen bekannten Lautäußerungen des Klippschliefers können auch mit steigender Intensität ineinander übergehen. Daneben sind einige nicht-vokale Laute bekannt, hierzu gehört das Zähneknirschen, Hecheln, Schnaufen und Niesen, deren Funktion teilweise unklar ist. Ersteres tritt häufig in Gefahren- oder Stresssituationen auf, bei denen ein Tier mit ihm unbekannten Faktoren konfrontiert ist. Die dabei mit dem Maul ausgeführten mahlenden Bewegungen erzeugen das Geräusch und erinnern optisch an wiederkäuende Huftiere, ohne dass dabei Nahrung verarbeitet wird.[41][42][6][1]

Herausragend ist der territoriale Ruf des Männchens, der eine hohe Lautstärke erreicht und über weite Strecken, bis hin zu 500 m, getragen wird. In der Regel werden die Rufe von den dominanten Männchen getätigt, seltener von „Randmännchen“. Dies zeigen auch Analysen zum Hormonhaushalt, bei denen dominante Rufer zumeist auch einen höheren Cortisol-Spiegel haben.[43] Der Ruf besteht aus einer Folge von Bell- oder Klacklauten, die zum Ende hin lauter und länger anhaltend werden und in eine Aneinanderreihung von Gurrlauten übergehen. Der Abschluss wirkt durch die beständige Steigerung Crescendo-artig. Die Serie wird nach kurzer Pause mehrfach wiederholt, so dass der Ruf insgesamt bis zu fünf Minuten anhalten kann.[10][44] Der territoriale Ruf ertönt das ganze Jahr über, die Intensität nimmt zur Paarungszeit hin zu. Häufig animiert ein Männchen damit benachbarte Männchen ebenfalls zu rufen.[25] Dominante Männchen starten dann in der Regel ein „Gegenrufen“ unabhängig vom Rang des Erstrufers, „Randmännchen“ dagegen antworten selten und akzeptieren das Territorium des dominanten Tiers. Allerdings lassen gelegentlich sehr niederrangige „Randmännchen“ ein „Gegenrufen“ vernehmen, was sich in der allgemeinen Toleranz der hochrangigen Individuen gegenüber jungen, nicht direkt konkurrierenden Männchen begründet. Außerdem antworten Männchen auf die Rufe bekannter Nachbarn häufiger als auf solche von unbekannten Individuen.[45] Die Komplexität der Rufe der Männchen kann mit fortschreitendem Lebensalter zu- oder abnehmen. In der Regel erhöht sich diese bei „Randmännchen“, die in ihrem Sozialstatus aufsteigen. Bei dominanten Männchen zeichnet sich dagegen teilweise ein Rückgang ab. Dies kann mit gesteigerter Konkurrenz sowie Einbindung in Territorialkämpfe zusammenhängen und allgemein eine Schwächung der Wettbewerbsfähigkeit ausdrücken. Daneben ist aber auch ein strategischer Wechsel im Konkurrenzverhalten denkbar.[46]
In ihrer individuellen Abfolge sind die Rufe recht unterschiedlich und lassen sich einzelnen Tieren zuordnen. Untersuchungen an Klippschliefern aus Israel zeigen, dass zudem zwischen einzelnen geographischen Regionen markante Variationen bestehen. Diese Unterschiede könnten als „syntaktische Dialekte“ aufgefasst werden, wobei ihre regionale Ausprägung auf die nur kurzen Ausbreitungsdistanzen der Tiere zurückzuführen sind; demnach werden die „syntaktische Dialekte“ von den lokalen Populationen erlernt.[47] Innerhalb des individuell variablen Rufes überträgt der Rufer offenbar wichtige Informationen, die das Körpergewicht, die Größe, den allgemeinen Zustand sowie den Sozial- und den Hormonstatus betreffen. Dies erfolgt durch unterschiedliche Lautstärken und Ruflängen, über die Anzahl der Wiederholungen beziehungsweise über die Hinzufügung oder Auslassung einzelner Rufelemente sowie über die Frequenz.[48][49] Für das Körpergewicht und den Sozialstatus dienen dabei Schnaublaute als Informationsträger. Diese werden zumeist von höherrangigen Tieren genutzt und sind, da eher selten, ein möglicherweise schwer zu erzeugendes Lautelement. Dadurch treten sie meist relativ spät im Ruf auf. Häufig haben Schnaublaute schwerer Tiere einen weichen Ton, die von sozial hochgestellten hingegen einen harten Klang, letzteres ist wahrscheinlich auf soziale Konkurrenz und damit verbundene Aggressivität zurückzuführen. Zudem kommt es teilweise während des Rufens zu einer Zunahme der Härte der Schnaublaute. Auch hier kann einerseits eine sich aufbauende Aggressivität oder Erregung des Rufers eine Rolle spielen, denkbar ist andererseits auch, dass die Steigerung auf die Befähigung hinweisen soll, schwierige Laute modulieren zu können. Dass die Schnaublaute mit ihrer komplexen Erzeugung zu den wichtigsten Rufelementen gehören, wird durch die verhältnismäßig häufige Stimulierung anderer Männchen zu Gegenrufen unterstrichen.[50][51][52]
Der typische Aufbau eines Rufs mit seinem Crescendo-artigen Ausklang dient möglicherweise dazu, die Aufmerksamkeit eines potentiellen Zuhörers zu erlangen. Dadurch kann angenommen werden, dass sich die wichtigsten Informationen am Ende eines Rufes befinden.[44] Die Intensität und Komplexität der Rufe nimmt außerdem bei bestimmten Ereignissen zu, etwa nach Alarmrufen, Rivalenkämpfen zwischen Männchen oder in Anwesenheit von Beutegreifern. Hierbei werden die Rufe länger, ihr Rhythmus steigert sich, ebenso wie sich die Anzahl der Klack- und Schnaublaute erhöht. Längere und schnellere Rufe mit einem hohen Wechsel an Lautelementen erfordern eine stärkere Muskelkontrolle des rufenden Tiers. Offensichtlich investiert ein Individuum in den Situationen mehr Energie in seine Rufe, in denen durch aufmerksamkeitsbindende Ereignisse eine größere Anzahl an Zuhörerschaft zur Verfügung steht.[53] Übereinstimmend hiermit ist der Effekt, dass dominante Initialrufer häufig härter modulieren als ihre Gegenrufer. Dadurch sind sozial hochstehende männliche Klippschliefer durchaus befähigt, in unterschiedlichen Varianten zu rufen, wählen einen melodischeren und weicheren Ruf aber nur bei erkennbarem Vorteil.[54]
Ernährung

Der Klippschliefer ist ein Pflanzenfresser. Er vertilgt unter anderem Gräser, Kräuter, Knospen, Sprossen, Früchte und Beeren. Nach Untersuchungen in der Serengeti ernähren sich die Tiere dort von insgesamt 79 verschiedenen Pflanzenarten. Abweichend von Buschschliefer zeigt der Klippschliefer eine starke jahreszeitliche Variabilität bezüglich der aufgenommenen Nahrung. In der Trockenzeit überwiegen weichere Pflanzenteile mit 57 %, spezielle Nahrungspflanzen stellen etwa Kordien, Hibiskus, Feigen, Nachtschatten und Sternbüsche sowie Vachellia, Iboza und Hoslundia dar. Dagegen steigt der Grasanteil in der Regenzeit auf 78 % an. Hier bevorzugt der Klippschliefer zwei Dutzend verschiedene Grasarten, so unter anderem Rispenhirsen, Lampenputzergräser und Themeda-Süßgräser. Die einzelnen Familiengruppen zeigen eine jeweilige Spezialisierung auf die Pflanzen in der direkten Umgebung der Kopjes, die Zusammensetzung der Nahrung unterscheidet sich daher zwischen den Kolonien.[24][55] Ein ähnliches Verhalten konnte auch in der Kapregion im südlichen Afrika beobachtet werden. Auch hier ist ein weites Spektrum an Nahrungspflanzen dokumentiert, jedoch überwiegen dabei etwa zehn Pflanzenarten, die rund 80 % der Nahrung ausmachen. Von hoher Bedeutung sind die Schwarzdorn-Akazie und die Gattung Ziziphus, aber auch Vertreter der Ölbäume, Kapastern, Waldreben und Bocksdorne. Im Übergang von der heißen Trockenzeit zur Regenzeit steigt dann der Grasanteil erheblich an und erreicht mehr als die Hälfte der aufgenommenen Pflanzen. Hier stellen Süßgräser wie Enneapogon oder Aristida, aber auch Hundszahngräser, Liebesgräser beziehungsweise Federgräser wichtige Nahrungsquellen dar. Vor allem die verschiedenen Arten von Enneapogon machen dann bis zu 40 % der Nahrungsmenge aus.[56][5] In Hochgebirgslagen wie am Mount Kenya wird das Angebot an Nahrungspflanzen durch die spärliche Vegetation stärker eingeschränkt. Hier bilden Lobelien und Tussock-Gräser einen wichtigen Nahrungsbestandteil, darüber hinaus auch Fetthennen und Baldriane.[57][58] Nach Analysen von Mageninhalten setzt sich die Nahrung teilweise zu über 90 % aus Gräsern zusammen.[15] Von einer Kolonie aus dem westlichen Kenia am Ostwall des Ostafrikanischen Grabens wurde der Verzehr der giftigen Kermesbeeren berichtet,[59] andere Pflanzen wie Ruchgräser meiden die Tiere aber häufig.[15] Der Klippschliefer nimmt seinen Flüssigkeitsbedarf über die Nahrung auf, er verfügt über effiziente Nieren und kann Urin hoch konzentrieren.[33] Bei Vorhandensein von Wasser trinkt er dieses aber regelmäßig.[4][6][1]
Überwiegend geht der Klippschliefer am frühen Morgen zwischen 08.00 und 11.00 Uhr und am späten Nachmittag zwischen 15.00 und 19.00 Uhr auf Nahrungssuche. Gelegentlich sieht man den Klippschliefer auch nachts fressen. In kalten Perioden beschränkt sich die Nahrungsaufnahme auch auf nur eine Aktivitätsperiode. Prinzipiell ist aber die Zeit der Nahrungsaufnahme nicht temperaturabhängig, sondern wird vom Tageslicht gesteuert.[57][58] Die Nahrungsaufnahme ist in einzelne Fressperioden unterteilt, die im Durchschnitt 20 Minuten andauern und selten länger als 35 Minuten währen. In dieser kurzen Zeit kann ein Tier große Mengen an Pflanzen aufnehmen. Dadurch beträgt die tägliche Fresszeit insgesamt nur eins bis zwei Stunden, was außerordentlich gering ist für einen Pflanzenfresser. Die gesamte tägliche aufgenommene Nahrung beläuft sich auf rund 111 g Trockenmasse für ein rund 3,3 kg schweres Tier, was gut 33,6 g je Kilogramm Körpergewicht entspricht. Bei der Nahrungsaufnahme hält der Klippschliefer den Kopf seitlich im 90°-Winkel zum Körper und beißt die Pflanze mit den Mahlzähnen ab, die Vorderfüße oder die Schneidezähne werden nicht eingesetzt. Auch transportiert der Klippschliefer seine Nahrung nicht in seinen Unterschlupf. Vielmehr wird die Nahrung vor Ort mit seitlichen Kaubewegungen zerkleinert. Wasser nimmt der Klippschliefer mit den Lippen auf, die er ausgestreckt an die Wasseroberfläche führt und dann die Flüssigkeit einschlürft.[58][42][55] In der Regel geht die Gruppe gemeinsam auf Nahrungssuche, die Tiere verteilen sich dabei fächerförmig mit dem Rücken zum Kopje. Teilweise beobachtet ein Individuum die Gruppe von einer erhöhten Position und gibt gegebenenfalls Warnrufe ab. Die Gruppe entfernt sich meist nur 15 bis 20 m vom Kopje. Im Karoo-Nationalpark wurden täglich zurückgelegte Entfernungen bei der Nahrungssuche von 169 bis 572 m festgestellt. Nur sporadisch gehen einzelne Tiere allein auf Nahrungssuche. In Gebieten mit dem gleichzeitigen Auftreten des Buschschliefers sieht man häufig beide Gruppen gemischt fressen. Dies beschränkt sich auf die Trockenzeit, wenn beide Arten sich von weichen Pflanzen ernähren. In der Regenzeit sind beide Arten getrennt, da der Klippschliefer größere Distanzen zu den Grasgebieten überwinden muss. Die abgegrasten Flächen sind zwischen 83 und 180 m² ausgedehnt, ihre Größe ist abhängig von der Niederschlagsmenge.[55][4][6][1]
Fortpflanzung


Die Paarung findet einmal im Jahr statt, während der sowohl Männchen als auch Weibchen kurzfristig sexuell aktiv werden.[60] Im Mountain-Zebra-Nationalpark im südlichen Afrika liegt die Hauptsaison im Zeitraum vom Februar bis zum Mai mit einem Höhepunkt im April.[61] Nach Norden hin in wärmere Klimazonen verschiebt sich die Paarungszeit etwas und dehnt sich zeitlich aus, sie kann dann auch erst im Juni/Juli stattfinden,[60] was auch für das eher äquatoriale Serengeti-Gebiet festgestellt wurde.[17] Der Östrus der Weibchen dauert etwa 13 Tage und wiederholt sich in einem Zeitraum von sieben Wochen mehrmals.[25] Bei Männchen schwellen die Hoden extrem an, teilweise um mehr als das Zehnfache an Gewicht (von durchschnittlich 6,2 auf 80,7 g).[61] Während der Paarungszeit sind Männchen sehr lautgeberisch, außerdem nutzen sie ihre Rückendrüse zur Abgabe von Duftmarken. Weibchen signalisieren ihre Bereitschaft, indem sie die Haare ihres Rückenfells aufstellen, den Geschlechtsbereich der Männchen beschnüffeln und ihr Hinterteil präsentieren. Eine bemerkenswerte Eigenschaft während der Paarung findet sich in einem gegensätzlichen Testosteronhaushalt zwischen Männchen und Weibchen. Während der Testosteronspiegel bei ersteren ansteigt, fällt er bei letzteren merklich ab. Außerdem begleiten männliche Tiere mit hohem Hormonspiegel häufiger weibliche mit niedrigem. Es kann sich hierbei um eine Antiaggressionsstrategie bei der Paarung handeln, auch nehmen Weibchen mit niedrigem Testosteronspiegel einen höheren Rang ein und sind dadurch erfolgreicher in der Fortpflanzung als solche mit hohem Testosteronanteil.[62] Zur Einleitung des Geschlechtsaktes gibt das Männchen einen Ruf von sich und das Weibchen presst sich an dessen Seite.[10][27] Die Begattung selbst erfolgt relativ schnell.[4][6][1]
Die Tragzeit beträgt 210 bis 240 Tage oder 7 bis 8 Monate, was ausgesprochen lang ist für ein Tier dieser Größe.[63][64][60] Entsprechend liegt die Geburt des Nachwuchses im Zeitraum vom September bis Mai. Die Weibchen einer Kolonie gebären dabei ihre Jungen synchronisiert in einem Zeitraum von drei Wochen. Etwa rund die Hälfte aller Weibchen ist daran beteiligt.[17][65] Die Wurfgröße variiert regional, liegt aber insgesamt zwischen einem und fünf Jungen. In der Serengeti beträgt sie durchschnittlich 2,4, im Mountain-Zebra-Nationalpark 2,7 und im Matobo-Nationalpark ebenfalls 2,4.[61][65] Bemerkenswert ist, dass die Größe eines Wurfes mit dem Lebensalter eines Weibchens zunimmt. So brachten nach Untersuchungen im Mountain-Zebra-Nationalpark junge Weibchen durchschnittlich 2,0 bis 2,1 Jungen zur Welt, bei drei bis achtjährigen Tieren waren es durchschnittlich 3,0 bis 3,4 Jungen. Im weiteren Alter nahm die Wurfgröße dann wieder ab.[60][61] Die Jungen wiegen zwischen 110 und 310 g mit einem Durchschnitt von 195 g. Das Gesamtgewicht eines Wurfes kann dadurch zwischen 560 und 875 g variieren, was einem signifikanten Teil des Normalgewichts des Muttertiers ausmacht (2500 bis 3600 g).[66][6][1]
.jpg.webp)
Die Neugeborenen werden im Unterschlupf zur Welt gebracht. Sie sind sehr weit entwickelt und kommen mit offenen Augen sowie vollständig behaart zur Welt. Ebenso können sie sofort umherlaufen. Bereits gut eine Stunde nach der Geburt saugt ein Junges erstmals, was etwa sieben Minuten in Anspruch nimmt und nach gut anderthalb Stunden wiederholt wird. Später reduziert sich die Saugzeit auf etwa drei Minuten. Häufig wird das Saugen von einem zwitschernden Geräusch begleitet. Nach zwei bis vier Tagen knabbert das Jungtier erstmals an pflanzlicher Nahrung. Zu diesem Zeitpunkt kann es auch schon rund 40 bis 50 cm hoch springen. In der zweiten Lebenswoche nimmt das Junge dann regelmäßig feste Nahrung zu sich. Die Entwöhnung findet nach einem bis vier Monaten statt. Die Jungtiere kommen in Gruppen zusammen und spielen intensiv miteinander, die gemeinsamen Aktivitäten bestehen aus Kneifen und Beißen, Klettern, Verfolgen, Kämpfen oder Drücken. Beim gemeinsamen Auftreten mit dem Buschschliefer sind auch gemischte Jungengruppen zu beobachten.[67] Nach rund 16 Monaten tritt bei Weibchen die sexuelle Reife ein, bei Männchen dauert dies bis 29 Monate.[66][61] Das Gewicht ausgewachsener Individuen wird aber erst nach rund drei Jahren erreicht.[68] Die Lebensdauer von Weibchen in freier Wildbahn kann bis zu elf Jahren betragen, die der Männchen in isolierten Kolonien bis zu 8,5.[18] In Gefangenschaft wurden einzelne Individuen bis zu 14 Jahre alt.[4][6][1]
Fressfeinde und Parasiten

Der bedeutendste Fressfeind des Klippschliefers ist der Klippenadler. Nach Untersuchungen von 73 Nistplätzen in drei unterschiedlichen Biotopen in der Kapregion des südlichen Afrikas bildet der Klippschliefer den Hauptbestandteil der Nahrung des Greifvogels. Von 5748 Beuteindividuen gehörten allein 4.429 zur Schlieferart. Darunter befanden sich, abhängig vom Biotop, zwischen 11 und 33 % Jungtiere.[69] Zu einem ähnlichen Ergebnis kam eine Studie im Matobo-Nationalpark an 40 Nestern. Hier konnten von rund 1550 Beuteresten des Kaffernadlers etwas über 600 dem Klippschliefer zugewiesen werden. Weitere Studien zeigten, dass etwa 68 % der erbeuteten Individuen ausgewachsene Tiere repräsentieren. Der Klipp- und der hier ebenfalls vorkommende Buschschliefer stellen insgesamt 98 % der Beute des Kaffernadlers.[70][20][71] Dadurch besteht ein hoher Jagddruck auf den Klippschliefer, es wird geschätzt, dass rund 60 bis 76 % der Jungtiere das erste Lebensjahr nicht erreichen.[19] Als weiterer wichtiger Jäger tritt der Kronenadler in Erscheinung. Nach Studien von rund 1600 erbeuteten Individuen im südöstlichen Afrika gehörten mehr als 780 zum Klippschliefer.[72] Ebenso sind der Kampfadler und der Raubadler zu nennen. Unter den Säugetieren können vor allem der Leopard, der Löwe, der Karakal, die Tüpfelhyäne und verschiedene Schakale als einflussreiche Prädatoren hervorgehoben werden, allein ersterer bezieht im Matobo-Nationalpark zwischen 32 und 50 % seiner Beute von Schliefern.[73][74] In der Regel versucht ein bedrohtes Tier in das nächste Versteck zu fliehen.[4][6][1]
Für den Klippschliefer ist eine hohe Bandbreite an inneren und äußeren Parasiten dokumentiert. Äußere finden sich in Form von Zecken, darunter unter anderem die Gattungen Amblysomma, Haemaphysalis, Ixodes und Rhipicephalus. Des Weiteren sind rund zwei Dutzend verschiedene Arten an Läusen bekannt, die am Klippschliefer parasitieren. Zu den nachgewiesenen Gattungen gehören Dasyonyx, Procavicola, Procaviphilus und Prolinognathus. Darüber hinaus kommen Milben und Flöhe vor, bei letzteren etwa Procaviopsylla. Einige der äußeren Parasiten sind auch auf Haustiere übertragbar. Auffällig ist, dass Weibchen durchschnittlich häufiger von Ektoparasiten befallen werden als Männchen, was besonders auf die warme Jahreszeit zutrifft. Dies wird mit dem stärkeren sozialen Zusammenhalt der Weibchen und der dadurch kürzeren Übertragungswege erklärt. Zudem tragen Weibchen dann auch ihren Nachwuchs aus und zeigen allgemein eine schlechtere Kondition. Innere Parasiten stellen unter anderem Fadenwürmer wie Crossophorus, Trichuris beziehungsweise Theileria und Bandwürmer wie Inermicapsifer dar.[75] In der Serengeti wurde das lokale Aussterben eine Kolonie durch Räude beobachtet,[17] infizierte Tiere traten auch am Mount Kenya auf.[15] Außerdem ist der Klippschliefer Träger der Leishmaniose.[76][4][6][1]
Systematik
Innere Systematik der rezenten Schliefer nach Maswanganye et al. 2017[77]
|
Der Klippschliefer ist eine Art aus der Gattung Procavia, er stellt den einzigen rezenten Vertreter der Gattung dar. Art und Gattung bilden wiederum einen Teil der Familie der Schliefer (Procaviidae) innerhalb der im Deutschen gleichnamigen Ordnung der Schliefer (Hyracoidea). Die Ordnung umfasst heute insgesamt drei Gattungen. In ihrer stammesgeschichtlichen Vergangenheit, vor allem im Paläogen und im frühen Neogen, waren die Schliefer noch äußerst formenreich und schlossen sowohl kleine als auch riesige Tiere ein. Diese besetzten die unterschiedlichsten ökologischen Nischen, die Verbreitung reichte über weite Teile Eurasiens und Afrikas. Heute sind die Schliefer auf meerschweinchenartige Formen beschränkt, die hauptsächlich in Afrika vorkommen. Lediglich der Klippschliefer ist als einzige Form zusätzlich noch in Vorderasien belegt. In seiner sozialen Lebensweise und seiner Tagesaktivität ähnelt der Klippschliefer dem Buschschliefer. Zwischen beiden Arten gibt es neben einzelnen anatomischen Unterschieden auch serologische Abweichungen wie etwa in der Mobilität der Amylasen.[78] Zu den Baumschliefern bestehen größere Unterschiede.[79][80]
Meistens werden heute alle Klippschliefer zu einer Art mit einem großen Verbreitungsgebiet zusammengefasst. Innerhalb der Art sind bis zu 17 Unterarten anerkannt:[4][81][6][1]
- P. c. bamendae Brauer, 1913; Kamerun und Zentralafrikanische Republik
- P. c. capensis (Pallas, 1766); Südafrika, Lesotho und Eswatini
- P. c. capillosa Brauer, 1917; südliches Äthiopien
- P. c. erlangeri Neumann, 1901; südliches Somalia
- P. c. habessinica (Hemprich & Ehrenberg, 1832); Ägypten, nördliches Sudan, Israel, Saudi-Arabien und Jemen
- P. c. jacksoni Thomas, 1900; südliches Kenia
- P. c. jayakari Thomas, 1892; Oman
- P. c. johnstoni Thomas, 1894; südwestliches Tansania, Malawi, Mosambik und Simbabwe
- P. c. kerstingi Matschie, 1899; Togo und Benin
- P. c. mackinderi Thomas, 1900; westliches Kenia
- P. c. matschiei Neumann, 1900; Demokratische Republik Kongo und Tansania
- P. c. pallida Thomas, 1891; nördliches Somalia
- P. c. ruficeps (Hemprich & Ehrenberg, 1832); nördliches und westliches Afrika
- P. c. scioana (Giglioli, 1888); nördliches Äthiopien
- P. c. sharica Thomas & Wroughton, 1907; Tschad
- P. c. syriaca (Schreber, 1784); Syrien, Libanon, Jordanien und Israel
- P. c. welwitschii (Gray, 1868); südwestliches Angola und Namibia
Insgesamt werden für den Klippschliefer 65 Synonyme aufgelistet. Im Jahr 1932 beschrieben Henri Heim de Balsac und Max Bégouen mit Procavia (Heterohyrax) antineae eine Form aus Algerien, die sie dem Buschschliefer zuwiesen.[82] Ihre Stellung innerhalb der Form war lange Zeit unsicher,[11][4] im Jahr 2008 wurde sie dann dem Klippschliefer zugeordnet und als synonym zu P. c. ruficeps betrachtet.[13]
Inwiefern alle aufgelisteten Unterarten tatsächlich bestehen, ist nicht geklärt. Der Klippschliefer zeigt starke morphologische Schwankungen über das Verbreitungsgebiet. Dadurch waren zu Beginn des 20. Jahrhunderts deutlich mehr eigenständige Arten anerkannt. So entwarf August Brauer in einem unveröffentlichten Entwurf eine Gliederung der Gattung Procavia in 38 Arten und 14 Unterarten. Herbert Hahn überarbeitete 1934 in seiner umfassenden Revision der Schliefer diese Systematik gründlich und reduzierte die Zahl der Arten auf vier.[11][83] Später wurde noch eine weitere Art hinzugefügt, so dass in den 1960er Jahren folgende Gliederung bestand:[2]
- Procavia capensis (Pallas, 1766); Kapscher Klippschliefer; südliches und südöstliches Afrika
- Procavia welwitschii (J. E. Gray, 1868); südwestliches Afrika
- Procavia johnstoni Thomas, 1894; Johnstons Klippschliefer; Zentralafrika
- Procavia ruficeps (Hemprich & Ehrenberg, 1832); Sudan- oder Sahara-Klippschliefer; westliches und nordwestliches Afrika
- Procavia habessinica (Hemprich & Ehrenberg, 1832); Abessinischer Klippschliefer; östliches und nördliches Afrika, westliches Asien
In den 1970er Jahren wurde erstmals vorgeschlagen, alle Arten des Klippschliefers in einer zu vereinigen.[84] Die Idee setzte sich Anfang der 1980er Jahre durch[4] und ist heute allgemein akzeptiert. Allen Klippschliefern gemein ist ein Chromosomensatz mit der Formel 2n=54. Er setzt sich aus 21 acrozentrischen, 2 submetazentrischen und 3 metazentrischen Chromosomenpaaren zusammen. Das X-Chromosom ist das größte Chromosom und besitzt ein submetzentrisches Zentromer, das Y-Chromosom stellt ein kleines acrozentrischs Chromosom dar.[85][86] Molekulargenetische Studien an südafrikanischen Tieren zeigen aber, dass sich dort wenigstens eine südliche und eine nördliche Klade unterscheiden lassen. Zwischen diesen besteht ein geringer Genfluss, die Trennung voneinander vollzog sich aber bereits im Miozän.[87][88][77] Die Wissenschaftler gehen davon aus, dass nach intensiveren DNA-Untersuchungen die Gattung Procavia wahrscheinlich wieder in mehrere Arten aufgespalten werden muss.[6][1]
Neben dem heutigen Klippschliefer sind noch mehrere ausgestorbene Arten bekannt:[12][89]
- Procavia pliocenica Pickford, 2005
- Procavia antiqua Broom, 1934
- Procavia transvaalensis Shaw, 1937
Zwei weitere Formen, Procavia obermeyerae und Procavia robertsi, wurden ebenfalls von Robert Broom in den Jahren 1937 beziehungsweise 1948 eingeführt.[90][91] Erstere gilt heute als synonym zu Procavia transvaalensis, letztere als zu Procavia antiqua.[92] Gelegentlich wird auch Procavia antiqua als identisch mit Procavia capensis aufgefasst.[93][12][89] Eine als Procavia tertiaria angesprochene Form[92] stammt aus dem Unteren Miozän von Namibia und gehört heute zu Prohyrax, einer älteren Entwicklungslinie der Schliefer.[12]
Forschungsgeschichte
Frühe Erwähnungen
In Vorderasien und Afrika war der Klippschliefer den Menschen schon seit mehreren tausend Jahren bekannt. Die Hebräer belegten ihn mit der Bezeichnung šāfān oder saphan (שפן), was soviel wie „der sich Verbergende“ bedeutet. Der saphan fand auch Einzug in das Alte Testament, wo er insgesamt viermal erwähnt wird. So beschreibt Psalm 104 im Buch der Psalmen ihn als Tier, das in den Felsen Zuflucht sucht. In den Zahlensprüchen schildert das Buch der Sprichwörter den saphan als machtloses, schwaches Tier, das aber aufgrund seiner Weisheit trotzdem seine Wohnungen im Felsen baut. Des Weiteren wird im Buch Levitikus ausgesagt, dass der saphan wiederkäue, aber keine gespaltenen Hufe habe, weshalb er als unrein anzusehen sei. Eine ähnliche Aussage gibt auch die Parallelstelle im Buch Deuteronomium wieder.[94] Frühe Bibelübersetzungen interpretierten den saphan unterschiedlich. So legten einige griechische Versionen das Tier als Kaninchen aus (χοιρογρύλλιον (choirogrýllion), abgeleitet von χοιρογρύλλος (choirogrýllos) für „Stachelschwein“), einige lateinische wiederum als Igel (erinacius). Notker Labeo vom Kloster St. Gallen sah um das Jahr 1000 die größte Ähnlichkeit mit dem Murmeltier.[95] In seiner Gesamtausgabe der Bibel von 1534 hatte Martin Luther den hebräischen saphan mit „Caninchen“ übersetzt. Es wird angenommen, dass die jeweiligen Bearbeiter einschließlich Luther für das unbekannte saphan ein allgemein vertrautes Tier aussuchten (entsprechend lautet die Übersetzung in der englischen Ausgabe der Bibel coney, was ebenfalls „Kaninchen“ bedeutet).[11][83]
Die häufige Gleichsetzung des saphan mit einem Kaninchen wurde in der Folgezeit kritisch beurteilt. So vermutete Samuel Bochart im Jahr 1663 in seinem Werk Hierozoicon, dass der saphan mit den dreizehigen Springmäusen oder Jerboas gleichzusetzen sei. Dem widersprach aber der englische Kleriker und Reisende Thomas Shaw 1738. Er berichtete ausführlich vom daman Israel aus der Levante, einem harmlosen, in Felsenklüften lebenden Tier von der Größe eines Kaninchens, aber dunkler gefärbt. Shaw bezog den daman auf den biblischen saphan.[96] Dabei berief er sich auf ein Werk zur ägyptischen Naturgeschichte von Prospero Alpini aus dem Ende des 16. Jahrhunderts, das erst 1735 veröffentlicht wurde und in dem von kleinen Tieren die Rede ist, die Alpinus mit agnus filiorum Israel bezeichnete („Lamm der Kinder Israels“).[97] Auch Peter Simon Pallas beschäftigte sich 1778 in einer Abhandlung über die Nager (Glires) mit dem Klippschliefer. Wie zuvor bei Shaw entsprach der saphan seiner Meinung nach dem Klippschliefer.[98] Die gleiche Ansicht wurde im Jahr 1790 von James Bruce geteilt, der auf seinen Reisen durch das damalige Abessinien auf Schliefer traf und den Buschschliefer so erstmals erwähnte. Bruce vermerkte in seinen Beschreibungen auch das Auftreten ähnlicher Tiere in Vorderasien, außerdem behauptete er, der Schliefer würde wiederkäuen, eine Meinung, die (neben der Bibelpassage) teilweise bis in das 20. Jahrhundert vertreten wurde (das Wiederkäuen lässt der einfacher gebaute Magen der Schliefer nicht zu[42]).[99] Nur wenig später pflichtete Johann Christian von Schreber in seinem Werk Die Säugthiere in Abbildungen nach der Natur mit Beschreibungen der Interpretation des Klippschliefers als saphan bei.[100] Heute wird dies kaum noch abgelehnt, in modernen deutschsprachigen Bibelübersetzungen ab 1912 wurde das „Kaninchen“ daher durch den „Klippdachs“ ausgetauscht (im Englischen entsprechend durch badger). „Klippdachs“ wird teilweise ebenso als unpassend erachtet, da der Name anderweitige Verwandtschaftsverhältnisse annehmen lässt.[11][83]
Ebenfalls im Verlauf des 17. und 18. Jahrhunderts erreichten erste Berichte von Klippschliefern aus der südafrikanischen Region Europa. Reisende wie Jodocus Hondius 1652 oder Augustin de Beaulieu 1664 hoben verschiedentlich die dassen oder marmots hervor. Auch Simon van der Stel, der ab 1790 der erste Gouverneur der niederländischen Kapkolonie wurde, notierte in seinem Tagebuch vom 14. September 1685 das häufige Auftreten von dassen am Heerenlogementsberg im südwestlichen Kapgebiet. Peter Kolb wiederum beschrieb auf seiner Afrikareise 1719 „Murmeltiere“, die die Einwohner seiner Meinung nach fälschlicherweise als „Dachse“ bezeichneten.[101] In der Regel werden diese Erwähnungen mit dem Klippschliefer assoziiert. Im heutigen Afrikaans bezeichnet dassie einen Schliefer allgemein. Der Name ist eine Ableitung vom niederländischen Wort das, welches „Dachs“ bedeutet.[4][79] Ähnlich wie bei den Beschreibungen der Tiere aus Vorderasien und den unterschiedlichen Bibelübersetzern neigten demnach auch die Autoren der Berichte aus dem südlichen Afrika dazu, die ihnen unbekannten Lebewesen mit solchen aus ihrer Heimat in Beziehung zu setzen. Zu diesem Zeitpunkt kam es auch noch nicht zu einem Vergleich der vorderasiatischen und der südafrikanischen Tiere.[102][103]
Wissenschaftliche Namensgebung


Die ersten Klippschliefer wurden Mitte des 18. Jahrhunderts nach Europa gebracht, häufig stammten sie ursprünglich aus den niederländischen Kolonien des südlichen Afrika. So sandte in den 1760er Jahren der damalige Gouverneur der Kapkolonie Ryk Tulbagh ein weibliches Tier in Alkohol eingelegt an Wilhelm V., Statthalter der Niederlande. Ein weiteres männliches Tier gelangte in die Menagerie Blauw-Jan in Amsterdam, später, in den 1770er Jahren, beherbergte diese auch lebende Individuen. Die beiden erstgenannten Exemplare wurden von Arnout Vosmaer aus Den Haag eingesehen und von ihm 1767 in einen kurzen Aufsatz als „Bastard-Murmeltier“ vorgestellt.[104] Eines der Tiere hatte Vosmaer zuvor an Peter Simon Pallas übergeben, der sich zu diesem Zeitpunkt auf seiner Reise durch die Niederlande befand. Pallas veröffentlichte dann 1766 in seinem Werk Miscellanea zoologica die ausführliche wissenschaftliche Erstbeschreibung des Klippschliefers. Darin wählte er den Namen Cavia capensis und gab die Kapregion als Typusgebiet aus. Mit der Gattungsbezeichnung Cavia verwies Pallas den Klippschliefer zu den südamerikanischen Meerschweinchen, er selbst verglich den Klippschliefer in seiner Miscellanea zoologica mit den Agutis und den Capybaras. Übergeordnet stellte er sie in die damalige Gruppe der Nager (die im Sinne von Linnaeus auch die Nashörner und Fledermäuse einschlossen).[105] Den Namen Cavia hatte Pallas von Jacob Theodor Klein übernommen, der die Gattungsbezeichnung bereits 1751 für die südamerikanischen Meerschweinchen gebrauchte.[106] Allerdings lehnte Georges-Louis Leclerc de Buffon im Jahr 1776 in dem von ihm herausgegebenen mehrbändigen Werk Histoire naturelle, générale et particulière den Verweis zu Cavia ab und argumentierte unter anderem mit Unterschieden in der geographischen Verbreitung und mit der abweichenden Lebensweise des Klippschliefers und der Meerschweinchen.[107] Vor allem die afrikanische Verbreitung bewog Gottlieb Conrad Christian Storr im Jahr 1780 den Namen Procavia für den Klippschliefer einzuführen. Die lateinische Vorsilbe pro- („vor“ oder „für“) stellte dabei einen unmittelbaren Bezug zu Cavia her, da auch Storr den Klippschliefer systematisch in der Nähe der Meerschweinchen sah. Somit behielt auch Storr die Einordnung in die Nager bei (die er allerdings unter der Bezeichnung Rosores führte).[108][102][103]
Procavia und Hyrax
Drei Jahre nach Storr vertrat Johann Hermann eine andere Meinung. In seiner Tabula affinitatum animalium kreierte er in Anbetracht einer abweichenden Zahnmorphologie die Gattungsbezeichnung Hyrax für den Klippschliefer. Der Name ist griechischen Ursprungs (ὕραξ hýrax) und bedeutet so viel wie „Spitzmaus“.[109] Bis zum Ende des 19. Jahrhunderts fand der Gattungsname Hyrax fast ausschließlich Verwendung, während Procavia meist ignoriert wurde. Hyrax wurde dabei auf alle Vertreter der Schliefer bezogen, erst 1868 führte John Edward Gray die Bezeichnungen Heterohyrax für den Buschschliefer und Dendrohyrax für die Baumschliefer ein und untergliederte so die Gruppe stärker. Dies betrifft auch die heute nicht mehr anerkannte Gattung Euhyrax, mit der Gray die Formen aus dem nordöstlichen Afrika belegte. Zur Unterscheidung von Hyrax hob er einige abweichende Schädelmerkmale hervor, etwa einen eher durchlaufenden Scheitelkamm und ein längeres Nasenbein.[110] Im Jahr 1886 wies Fernand Lataste auf die drei Jahre ältere Urheberschaft von Storrs Procavia gegenüber Hermanns Hyrax hin.[111] Dies führte Oldfield Thomas 1892 weiter aus und bestätigte so die Priorität des älteren Namens als Gattungsbezeichnung.[112] Teilweise wurde dies bedauert und Hyrax gegenüber Procavia als der geeigneterer Name empfunden, heute gelten beide aufgrund abweichender Verwandtschaftsverhältnisse als unpassend. Ungeachtet dessen hat sich „Hyrax“ vor allem im englischen Sprachraum als Trivialname für die Schliefer durchgesetzt.[5][79]
Unklare Verwandtschaftsverhältnisse

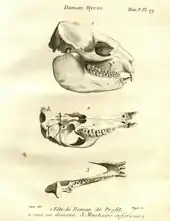
Pallas und Storr sahen den Klippschliefer als Vertreter der Nagetiere an. Die genaue Stellung war aber lange Zeit umstritten. Buffons ablehnende Haltung zu Cavia capensis wurde etwa im Jahr 1780 auch von August Wilhelm von Mellin in seiner Schrift Der Klipdas wiedergegeben. In dieser stellte Mellin den Klippschliefer ausführlich in deutscher Sprache vor.[113] Félix Vicq d’Azyr verschob den Klippschliefer 1792 zu den Spitzmäusen und begründete dies mit dem Bau des vorderen Gebisses, speziell der oberen Schneidezähne.[114] Auch Christian Rudolph Wilhelm Wiedemann widersprach bei einer ausführlichen Beschreibung eines Schädels der Stellung des Klippschliefers innerhalb der Nagetiere, gab aber keine genaue alternative Position an.[115] Von Bedeutung ist hier ein Schädel eines Klippschliefers aus dem Libanon, der sich im Cabinet du roi von Paris befand, dem späteren Muséum national d’histoire naturelle. Der Schädel wurde bereits 1767 von Louis Jean-Marie Daubenton in einem Band über lebendgebärende Tiere innerhalb von Buffons Histoire naturelle vorgestellt. Dabei erkannte Daubenton die wahre Natur des Schädels nicht, sein nur wenige Zeilen umfassender Aufsatz ist aber relativ exakt und gibt die anatomischen Merkmale ausdrücklich wieder. Pallas verwies 1776 Daubentons Schädel zum Klippschliefer.[116] Trotz dieser Erkenntnis zeichnete ihn eine Abbildungstafel im siebenten Zusatzband der Histoire naturelle aus dem Jahr 1789 als Bengalischen Plumplori aus (unabhängig von der Schädelbeschreibung enthält die Histoire naturelle mehrere weitere Vermerke auf den Klippschliefer: im dritten Zusatzband aus dem Jahr 1776 ist die bereits erwähnte kritische Auseinandersetzung Buffons mit Pallas' Cavia capensis abgedruckt, in Anlehnung an Vosmaers „Bastard-Murmeltier“ nennt Buffon hier den südafrikanischen Klippschliefer marmotte du Cap, im sechsten Zusatzband aus dem Jahr 1782 findet sich eine Gegenüberstellung des südafrikanischen Klippschliefers als daman du Cap und des vorderasiatischen Klippschliefers als daman Israel).[107] Fünfzehn Jahre später nutzte Georges Cuvier den gleichen Schädel, um den Klippschliefer in seine Gruppe der Pachydermata („Dickhäuter“) einzugliedern.[117] In dem heute nicht mehr gültigen Taxon gruppierte er die Gattung Hyrax zusammen mit anderen Huftieren wie den Nashörnern, Tapiren, Elefanten, Flusspferden, Echten Schweinen und den Pekaris. Den Klippschliefer sah Cuvier aufgrund des Zahnbaus in einer Vermittlerrolle zwischen Nashörnern und Tapiren.[118][103] Der Ausschluss aus den Nagetieren und der Verweis zu anderen Huftieren hatte weitreichende Folgen. Bis weit in das 20. Jahrhundert wurde dem Klippschliefer zusammen mit den anderen Schliefern aus anatomischen Erwägungen wahlweise eine Nahverwandtschaft mit den Unpaarhufern oder mit den Paenungulata („Fast-Huftiere“) zugesprochen.[119] Der Konflikt löste sich erst im Übergang vom 20. zum 21. Jahrhundert mit der Einführung von biochemischen und molekulargenetischen Untersuchungsmethoden zugunsten der Paenungulata auf.[120][121]
Stammesgeschichte
Fossil treten die Vorfahren der heutigen Schliefer erstmals im Miozän auf. Der erste Nachweis der Gattung Procavia datiert aber in das Untere Pliozän vor rund 5 Millionen Jahren. Es handelt sich um die Reste der Art Procavia pliocenica, sie wurden an der Fundstelle Langebaanweg im südwestlichen Südafrika gefunden. Die Funde umfassen zahlreiche Gebissteile und einzelne isolierte Zähne. Sie lassen auf ein Tier schließen, das den heutigen Klippschliefer um etwa 20 % an Körpergröße übertraf. Der Unterkiefer teilt die relative Robustizität mit dem der rezenten Vertreter des Klippschliefers, die Mahlzähne sind aber eher niederkronig gebaut. als Besonderheit kann die Ausbildung des ersten unteren Prämolaren genannt werden, der bei den heutigen südafrikanischen Populationen generell fehlt. Dadurch wirkt Procavia pliocenica deutlich ursprünglicher als der heutige Klippschliefer.[12]
Im Pliozän und im Übergang zum Pleistozän erschien dann Procavia antiqua, das etwa die Größe des heutigen Klippschliefers erreichte, allerdings einen leichter gebauten Schädel und weniger hochkronige Zähne besaß. Zuerst aus der bedeutenden Fundstelle von Taung im zentralen Südafrika anhand eines heute verschollenen Schädels beschrieben,[122] ist die Art darüber hinaus auch aus Sterkfontein im nordöstlichen Südafrika bekannt.[91][92] Aus zeitgleichen Schichten liegen Reste von Procavia transvaalensis vor. Die Art wurde etwa anderthalb mal größer als ein heutiger Klippschliefer und besaß eine Schädellänge von 125 mm. Sie stellt damit den größten Vertreter der Gattung dar. In ihren Körperausmaßen übertraf sie unter allen procaviiden Schliefern nur noch Gigantohyrax. Die Erstbeschreibung erfolgte anhand eines Unterkiefers und eines zerquetschten Schädels aus Sterkfontein.[123] Weitere Funde kamen unter anderem aus den nahe gelegenen Fundstellen von Swartkrans und Kromdraai sowie aus Makapansgat und Taung zu Tage. Sterkfontein barg auch einige Reste der Vorderbeine. Es wird angenommen, dass Procavia transvaalensis stärker an steppenartige Landschafte angepasst war.[92][124][12]
Vor allem im Pleistozän ist dann der heutige Klippschliefer belegbar, etwa aus der Sibudu-Höhle im Südosten Südafrikas.[125] Exzeptionell sind die Funde aus der Blombos-Höhle in der Kapregion Südafrika. Die mehrere Tausend Fossilfunde, die in den Beginn der letzten Kaltzeit datieren, setzen sich zu mehr als ein Viertel aus Resten des Klippschliefers zusammen, darunter zum größeren Teil Jungtiere. Taphonomische Untersuchungen lassen an eine Erbeutung durch Jäger-Sammler-Gruppen des frühen Menschen denken.[126] Ebenfalls in der gleichen geologischen Serie erscheint der Klippschliefer in Vorderasien. So sind Funde aus dem frühen Mittelpleistozän von Gesher Benot Ya’aqov und im Übergang zum Jungpleistozän aus der Höhle Rantis dokumentiert, beide liegen in Israel.[127][128]
Mensch und Klippschliefer
Bedrohung und Schutz
Größere Bedrohungen für den Bestand des Klippschliefers sind nicht bekannt. In einigen afrikanischen Ländern werden die Tiere wegen ihres Fleisches und Felles gejagt, in Saudi-Arabien auch zu Sportzwecken. Des Weiteren gibt es die Ansicht, das Blut und das Fleisch des Klippschliefers hätten eine potenzsteigernde Wirkung.[129] Im Jemen zähmen Familien aus ärmlichen Verhältnissen manchmal einzelne Tiere und verkaufen sie auf lokalen Märkten.[130] Das kann teilweise einen großen Einfluss auf lokale Populationen haben. In KwaZulu-Natal ist der Klippschliefer Anfang des 21. Jahrhunderts lokal ausgestorben, Wiedereinführungen sind bisher gescheitert.[131] Mitunter wurde der Klippschliefer als Schädling angesehen, so unter anderem in den Kapprovinzen Südafrikas. In Israel, wo die Art nur wenige natürliche Feinde hat, richten die Tiere teilweise beträchtlichen Schaden in kultivierten Flächen an. Die IUCN stuft den Gesamtbestand des Klippschliefers als „nicht gefährdet“ (least concern) ein und erwartet keinen signifikanten Populationsrückgang. Er kommt in zahlreichen Naturschutzgebieten vor. Vor allem sind aber Untersuchungen zu seiner tatsächlichen Verbreitung notwendig.[132][6]
Bedeutung für den Menschen
Die als „Hyraceum“ bezeichneten Ausscheidungen des Klippschliefers finden teils pulverisiert Anwendung in der traditionellen Afrikanischen Medizin, so unter anderem zur Behandlung von Infektionen der Atem- oder Harnwege, aber auch bei Masern und Diabetes. Als Tee verabreicht soll es Frauenkrankheiten lindern, kann in größeren Dosen angeblich aber auch zum Schwangerschaftsabbruch führen. Des Weiteren wird die Substanz teilweise Giften beigefügt und dient als Fixativ in der Parfümindustrie.[40][133]
Literatur
- Angela Gaylard: Procavia capensis (Pallas, 1766) – Rock hyrax. In: John D. Skinner und Christian T. Chimimba (Hrsg.): The Mammals of the Southern African Subregion. Cambridge University Press, 2005, S. 42–46.
- Hendrik Hoeck: Family Procaviidae (Hyraxes). In: Don E. Wilson und Russell A. Mittermeier (Hrsg.): Handbook of the Mammals of the World. Volume 2: Hooved Mammals. Lynx Edicions, Barcelona 2011, S. 28–47 (S. 43–45) ISBN 978-84-96553-77-4.
- Hendrik N. Hoeck und Paulette Bloomer: Procavia capensis Rock Hyrax (Klipdassie). In: Jonathan Kingdon, David Happold, Michael Hoffmann, Thomas Butynski, Meredith Happold und Jan Kalina (Hrsg.): Mammals of Africa Volume I. Introductory Chapters and Afrotheria. Bloomsbury, London, 2013, S. 166–171.
- Ronald M. Nowak: Walker’s Mammals of the World. Johns Hopkins University Press, 1999, ISBN 0-8018-5789-9.
- Nancy Olds und Jeheskel Shoshani: Procavia capensis. Mammalian Species 171, 1982, S. 1–7.
Videos
- Hendrik N. Hoeck: Heterohyrax brucei (Procaviidae) – Spiel der Jungen miteinander und mit Jungen von Procavia johnstoni (Freilandaufnahmen). Film E-2473 des Instituts für den Wissenschaftlichen Film, Publikation von H. N. Hoeck, Publikationen zu Wissenschaftlichen Filmen, Sektion Biologie, Serie 11, Nr. 29/E 2473, 1978, Begleitheft 8 Seiten.
- Hendrik N. Hoeck: Ethologie von Busch- und Klippschliefer. Film D-1338 des Instituts für den Wissenschaftlichen Film, Publikation von H. N. Hoeck, Publikationen zu Wissenschaftlichen Filmen, Sektion Biologie, Serie 15, Nr. 31/D 1338, 1982, Begleitheft 24 Seiten.
- Hendrik N. Hoeck: Nahrungsökologie bei Busch- und Klippschliefer – Sympatrische Lebensweise. Film D-1371 des Instituts für den Wissenschaftlichen Film, Publikation von H. N. Hoeck, Publikationen zu Wissenschaftlichen Filmen, Sektion Biologie, Serie 15, Nr. 32/D 1371, 1982.
Einzelnachweise
- Hendrik N. Hoeck und Paulette Bloomer: Procavia capensis Rock Hyrax (Klipdassie). In: Jonathan Kingdon, David Happold, Michael Hoffmann, Thomas Butynski, Meredith Happold und Jan Kalina (Hrsg.): Mammals of Africa Volume I. Introductory Chapters and Afrotheria. Bloomsbury, London 2013, S. 166–171.
- J. du P. Bothma: Recent Hyracoidea (Mammalia) of Southern Africa. Annals of the Transvaal Museum 25, 1967, S. 117–152.
- Yoram Yom-Tov: Does the rock hyrax, Procavia capensis, conform with Bergmann's rule? Zoological Journal of the Linnean Society 108, 1993, S. 171–177.
- Nancy Olds und Jeheskel Shoshani: Procavia capensis. Mammalian Species 171, 1982, S. 1–7.
- Angela Gaylard: Procavia capensis (Pallas, 1766) – Rock hyrax. In: John D. Skinner und Christian T. Chimimba (Hrsg.): The Mammals of the Southern African Subregion. Cambridge University Press, 2005, S. 42–46.
- Hendrik Hoeck: Family Procaviidae (Hyraxes). In: Don E. Wilson und Russell A. Mittermeier (Hrsg.): Handbook of the Mammals of the World. Volume 2: Hooved Mammals. Lynx Edicions, Barcelona 2011, ISBN 978-84-96553-77-4, S. 28–47 (S. 43–45).
- Ngoni Chiweshe: Dassie census in the Matobo Hills, Zimbabwe. Afrotherian Conservation 1, 2002, S. 6–7.
- R. P. Millar: An unusual light shielding structure in the eyes of the dassie (Procavia capensis Pallas) (Mammalia: Hyracoidea). Annals of the Transvaal Museum 28 (11), 1973, S. 203–205.
- George Lindsay Johnson: Contributions to the comparative anatomy of the mammalian eye, chiefly based on opthalmoscopic examination. Philosophical Transaction of the Royal Society (B) 194, 1901, S. 1–82 (archive.org).
- Hendrik Hoeck: Systematics of the Hyracoidea: toward a clarification. In: Duane A. Schlitter (Hrsg.): Ecology and taxonomy of African small mammals. Bulletin of the Carnegie Museum of Natural History 6, 1978, S. 146–151.
- Herbert Hahn: Die Familie der Procaviidae. Zeitschrift für Säugetierkunde 9, 1934, S. 207–358 (biodiversitylibrary.org).
- Martin Pickford: Fossil hyraxes (Hyracoidea: Mammalia) from the Late Miocene and Plio-Pleistocene of Africa, and the phylogeny of the Procaviidae. Palaeontologia africana 41, 2005, S. 141–161.
- Michael Hoffmann, Hendrik N. Hoeck und Koenraad De Smet: Does the bush hyrax Heterohyrax brucei occur in North Africa? Afrotherian Conservation 6, 2008, S. 6–8.
- Noam Ben-Moshe und Takuya Iwamura: Shelter availability and human attitudes as drivers of rock hyrax (Procavia capensis) expansion along a rural–urban gradient. Ecology and Evolution 10, 2020, S. 4044–4065, doi:10.1002/ece3.6174.
- Truman P. Young und Matthew R. Evans: Alpine vertebrates of Mount Kenya, with particular notes on the Rock hyrax. Journal of the East African Natural History Society and National Museum 82 (202), 1993, S. 55–79.
- Gebremeskel Teklehaimanot und Mundanthra Balakrishnan: Distribution and Population Status of the Endemic Rock Hyrax Sub-species (Procavia capensis capillosa) of the Bale Mountains, Ethiopia. International Journal of Ecology and Environmental Sciences 44 (1), 2018, S. 155–163.
- H. N. Hoeck: Population dynamics, dispersal and genetic isolation in two species of hyrax (Heterohyrax brucei and Procavia johnstoni) on habitat islands in the Serengeti. Zeitschrift für Tierpsychologie 59, 1982, S. 177–210.
- H. N. Hoeck: Demography and competition in hyrax: a 17 years study. Oecologia 79, 1989, S. 353–360.
- Ronald E. Barry und Peter J. Mundy: Population dynamics of two species of hyraxes in the Matobo National Park, Zimbabwe. African Journal of Ecology 36, 1998, S. 221–236.
- Ronald E. Barry und Peter J. Mundy: Seasonal variation in the degree of heterospecific association of two syntopic hyraxes (Heterohyrax brucei and Procavia capensis) exhibiting synchronous parturition. Behavioral Ecology and Sociobiology 52, 2002, S. 177–181.
- R. E. Barry, N. Chiweshe und P. J. Mundy: Ten years of population data on two species of hyrax in the Matobo National Park, Zimbabwe. Afrotherian Conservation 2, 2003, S. 8–9.
- Ngoni Chiweshe: An update on the annual dassie census in Matobo Hills, Zimbabwe. Afrotherian Conservation 3, 2005, S. 7–8.
- Ronald E. Barry, Ngoni Chiweshe und Peter J. Mundy: Fluctuations in bush and rock Hyrax (Hyracoidea: Procaviidae) Abundances Over a 13-Year Period in the Matopos, Zimbabwe. African Journal of Wildlife Research 45 (1), 2015, S. 17–27.
- M. I. M. Turner und I. M. Watson: An introductory study on the ecology of hyrax (Dendrohyrax brucei and Procavia johnstoni). African Journal of Ecology 3 (1), 1965, S. 49–60.
- H. N. Hoeck, H. Klein und P. Hoeck: Flexible social organization in hyrax. Zeitschrift für Tierpsychologie 59, 1982, S. 265–298.
- Adi Barocas, Amiyaal Ilany, Lee Koren, Michael Kam und Eli Geffen: Variance in Centrality within Rock Hyrax Social Networks Predicts Adult Longevity. PLoS ONE 6 (7), 2011, S. e22375, doi:10.1371/journal.pone.0022375.
- L. J. Fourie und M. R. Perrin: Social behaviour and spatial relationship of the rock hyrax. South African Journal of Wildlife Research 17 (3), 1987, S. 91–98.
- Lee Koren, Ofer Mokady und Eli Geffen: Elevated testosterone levels and social ranks in female rock hyrax. Hormones and Behavior 49, 2006, S. 470–477.
- G. Gerlach und H. N. Hoeck: Islands on the plains: metapopulation dynamics and female biased dispersal in hyraxes (Hyracoidea) in the Serengeti National Park. Molecular Ecology 10, 2001, S. 2307–2317.
- J. B. Sale: The habitat of the rock hyrax. Journal of the East African Natural History Society 25 (3), 1966, S. 205–214.
- C. R. Taylor und J. B. Sale: Temperature regulation in the hyrax. Comparative Biochemistry and Physiology 31 (6), 1969, S. 903–907.
- J. B. Sale: The Behaviour of the Resting Rock Hyrax in Relation to its Environment. Zoologica Africana 5 (1), 1970, S. 87–99.
- Elza Louw, G. N. Louw und C. P. Retief: Thermolability, Heat Tolerance and Renal Function In the Dassie or Hyrax, Procavia Capensis. Zoologica Africana 7 (2), 1972, S. 451–469.
- lan S. McNairn und Neil Fairall: Metabolic rate and body temperature of adult and juvenile hyrax (Procavia capensis). Comparative Biochemistry and Physiology Part A: Physiology 79 (4), 1984, S. 539–545.
- Kelly J. Brown und Colleen T. Downs: Seasonal patterns in body temperature of free-living rock hyrax (Procavia capensis). Comparative Biochemistry and Physiology 143, 2006, S. 42–49.
- lan S. McNairn und Neil Fairall: Relationship between heart rate and metabolism in the hyrax (Procavia capensis) and guinea pig (Cavia porcellus). South African Journal of Zoology 14 (4), 1979, S. 230–232.
- Nadine Gravett, Adhil Bhagwandin, Oleg I. Lyamin, Jerome M. Siegel und Paul R. Manger: Sleep in the Rock Hyrax, Procavia capensis. Brain Behavior and Evolution 79, 2012, S. 155–169.
- Kelly J. Brown und Colleen T. Downs: Basking behaviour in the rock hyrax (Procavia capensis) during winter. African Zoology 42 (1), 2007, S. 70–79.
- J. B. Sale: Unusual External Adaptations in the Rock Hyrax. Zoologica Africana 5 (1), 1970, S. 101–113.
- Andreas Olsen, Linda C. Prinsloo, Louis Scott und Anna K. Jäger: Hyraceum, the fossilized metabolic product of rock hyraxes (Procavia capensis), shows GABA-benzodiazepine receptor affinity. South African Journal of Science 103, 2008, S. 437–438.
- Petrus Bernardus Fourie: Acoustic communication in the rock hyrax, Procavia capensis. Zeitschrift für Tierpsychologie 44, 1977, S. 194–219.
- J. B. Sale: Daily food consumption and mode of ingestion in the hyrax. Journal of the East African Natural History Society 25 (3), 1966, S. 215–224.
- Lee Koren, Ofer Mokady und Eli Geffen: Social status and cortisol levels in singing rock hyraxes. Hormones and Behavior 54, 2008, S. 212–216.
- Vlad Demartsev, Amiyaal Ilany, Arik Kershenbaum, Yair Geva, Ori Margalit, Inbar Schnitzer, Adi Barocas, Einat Bar-Ziv, Lee Koren und Eli Geffen: The progression pattern of male hyrax songs and the role of climactic ending. Scientific Reports 7, 2017, S. 2794, doi:10.1038/s41598-017-03035-x.
- Vlad Demartsev: Male rock hyraxes (Procavia capensis): Singing tactics and the dynamics of counter-singing events. Afrotherian Conservation 14, 2018, S. 10–14.
- Vlad Demartsev, Arik Kershenbaum, Amiyaal Ilany, Yishai Weissman, Lee Koren und Eli Geffen: Lifetime changes in vocal syntactic complexity of rock hyrax males are determined by social class. Animal Behaviour 153, 2019, S. 151–158, doi:10.1016/j.anbehav.2019.05.011.
- Arik Kershenbaum, Amiyaal Ilany, Leon Blaustein und Eli Geffen: Syntactic structure and geographical dialects in the songs of male rock hyraxes. Proceedings of the Royal Society B 279, 2012, S. 2974–2981.
- Lee Koren und Eli Geffen: Complex call in male rock hyrax (Procavia capensis): a multi-information distributing channel. Behavioral Ecology and Sociobiology 63, 2009, S. 581–590.
- Lee Koren und Eli Geffen: Individual identity is communicated through multiple pathways in male rock hyrax (Procavia capensis) songs. Behavioral Ecology and Sociobiology 65, 2011, S. 675–684.
- Vlad Demartsev, Einat Bar Ziv, Uria Shani, Yael Goll, Lee Koren und Eli Geffen: Harsh vocal elements afect counter-singing dynamics in male rock hyrax. Behavioral Ecology 27 (5), 2016, S. 1397–1404, doi:10.1093/beheco/arw063.
- Yishai A. Weissman, Vlad Demartsev, Amiyaal Ilany, Adi Barocas, Einat Bar-Ziv, Inbar Shnitzer, Eli Geffen und Lee Koren: Acoustic stability in hyrax snorts: vocal tightrope-walkers or wrathful verbal assailants? Behavioral Ecology 30 (1), 2019, S. 223–230, doi:10.1093/beheco/ary141.
- Yishai A. Weissman, Vlad Demartsev, Amiyaal Ilany, Adi Barocas, Einat Bar-Ziv, Lee Koren und Eli Geffen: A crescendo in the inner structure of snorts: a reflection of increasing arousal in rock hyrax songs? Animal Behaviour 166, 2020, S. 163–170, doi:10.1016/j.anbehav.2020.06.010.
- Vlad Demartsev, Arik Kershenbaum, Amiyaal Ilany, Adi Barocas und Einat Bar Ziv: Male hyraxes increase song complexity and duration in the presence of alert individuals. Behavioral Ecology 25 (6), 2014, S. 1451–1458.
- Yishai A. Weissman, Vlad Demartsev, Amiyaal Ilany, Adi Barocas, Einat Bar-Ziv, Eli Geffen und Lee Koren: Social context mediates testosterone's effect on snort acoustics in male hyrax songs. Hormones and Behavior 114, 2019, S. 104535, doi:10.1016/j.yhbeh.2019.05.004.
- H. N. Hoeck: Differential Feeding Behaviour of the Sympatric Hyrax Procavia johnstoni and Heterohyrax brucei. Oecologia 22, 1975, S. 15–47.
- J .E. Lensing: Feeding strategy of the rock hyrax and its relation to the rock hyrax problem in southern South West Africa. Madoqua 13 (3), 1983, S. 177–196.
- Malcolm J. Coe: Notes on the habits of the Mount Kenya hyrax (Procavia johnstoni mackinderi Thomas). Journal of Zoology 138 (4), 1962, S. 639–644.
- J. B. Sale: The feeding behaviour of rock hyraxes (genera Procavia and Heterohyrax) in Kenya. African Journal of Ecology 3 (1), 1965, S. 1–18.
- J. B. Sale: Hyrax feeding on a poisonous plant. African Journal of Ecology 3 (1), 1965, S. 127.
- R. P. Millar: Reproduction in the rock hyrax (Procavia capensis). Zoologica Africana 6 (2), 1971, S. 243–261.
- L. J. Fourie und M. R. Perrin: Some new data on the reproductive biology of the rock hyrax. South African Journal of Wildlife Research 17 (4), 1987, S. 118–122.
- Lee Koren, Yishai Weissman, Inbar Schnitzer, Rosanne Beukeboom, Einat Bar Ziv, Vlad Demartsev, Adi Barocas, Amiyaal Ilany und Eli Geffen: Sexually opposite effects of testosterone on mating success in wild rock hyrax. Behavioral Ecology 30 (6), 2019, S. 1611–1617, doi:10.1093/beheco/arz125.
- G. N. Murray: The gestiation period of Procavia capensis (dassie). Journal of the South African Veterinary Association 13,1942, S. 27–28.
- J. B. Sale: Gestation period and neonatal weight of the hyrax. Nature 205, 1965, S. 1240–1241.
- Ronald E. Barry: Synchronous parturition of Procavia capensis and Heterohyrax brucei during drought in Zimbabwe. South African Journal of Wildlife Research 24 (1/2), 1994, S. 1–5.
- J. B. Sale: Observations on Parturition and Related Phenomena in the Hyrax (Procaviidae). Acta Tropica 22, 1965, S. 37–54.
- T. M. Caro und R. M. Alawi: Comparative aspects of behavioural development in two species of free-living hyrax. Behaviour 95, 1984, S. 87–109.
- N. Fairall: Growth and age determination in the hyrax Procavia capensis: South African Journal of Zoology 15, 1980, S. 16–21.
- A. F. Boshoff, N. G. Palmer, G. Avery, R. A. G. Davies und M. J. F. Jarvis: Biogeographical and topographical variation in the prey of the black eagle in the Cape Province, South Africa. Ostrich 62, 1991, S. 59–72.
- Ronald E. Barry und Lisa M. Barry: Species Composition and Age Structure of Remains of Hyraxes (Hyracoidea: Procaviidae) at Nests of Black Eagles. Journal of Mammalogy 77 (3), 1996, S. 702–707.
- N. Chiweshe: Black Eagles and hyraxes – the two flagship species in the conservation of wildlife in the Matobo Hills, Zimbabwe. Ostrich 78 (2), 2007, S. 381–386.
- A. F. Boshoff, N. G. Palmer, C. J. Vernon und G. Avery: Comparison of the diet of crowned eagles in the Savanna and Forest Biomes of south-eastern South Africa. South African Journal of Wildlife Research 24 (1/2), 1994, S. 26–72.
- J. H. Grobler und Vivian J. Wilson: Food of the leopard Panthera pardus (Linn.) in the Rhodes Matopo National Park, Rhodesia, as determined by faecal analysis. Arnoldia 35 (5), 1972, S. 1–9.
- Richard Mark Smith: Movement pattern and feeding behaviour of leopard in the Rhodes Matopo National Park, Rhodesia. Arnoldia 13 (8), 1977, S. 1–16.
- L. J. Fourie, I. G. Horak und Evelyn Visser: Quantitative and qualitative aspects of the parasite burdens of rock dassies (Procavia capensis Pallas, 1766) in the Mountain Zebra National Park. South African Journal of Zoology 22 (2), 1987, S. 101–106.
- Dalit Talmi-Frank, Charles L. Jaffe, Abedelmajeed Nasereddin, Alon Warburg, Roni King, Milena Svobodova, Ofer Peleg und Gad Baneth: Leishmania tropica in Rock Hyraxes (Procavia capensis) in a Focus of Human Cutaneous Leishmaniasis. American Journal of Tropical Medicine and Hygiene 82 (5), 2010, S. 814–818.
- K. Amanda Maswanganye, Michael J. Cunningham, Nigel C. Bennett, Christian T. Chimimba und Paulette Bloomer: Life on the rocks: Multilocus phylogeography of rock hyrax (Procavia capensis) from southern Africa. Molecular Phylogenetics and Evolution 114, 2017, S. 49–62.
- Hans-Geog Scheil und Hendrik N. Hoeck: Elektrophoretische Untersuchungen der Serum-Amylasen (E. C. 3.2.1.1) des Klippschliefers Procavia johnstoni matschie Neumann 1900 und des Buschschliefers Heterohyrax brucei dieseneri (Vic. Niansae) Brauer 1917 – Hyracoidea: Mammalia. Zoologischer Anzeiger 215, 1985, S. 129–132.
- Jeheskel Shoshani, Paulette Bloomer und Erik R. Seiffert: Family Procaviidae Hyraxes. In: Jonathan Kingdon, David Happold, Michael Hoffmann, Thomas Butynski, Meredith Happold und Jan Kalina (Hrsg.): Mammals of Africa Volume I. Introductory Chapters and Afrotheria. Bloomsbury, London, 2013, S. 150–151.
- Paulette Bloomer und Hendrik N. Hoeck: Genus Procavia Rock Hyrax. In: Jonathan Kingdon, David Happold, Michael Hoffmann, Thomas Butynski, Meredith Happold und Jan Kalina (Hrsg.): Mammals of Africa Volume I. Introductory Chapters and Afrotheria. Bloomsbury, London, 2013, S. 165.
- Don E. Wilson und DeeAnn M. Reeder: Mammal Species of the World. A taxonomic and geographic Reference. Johns Hopkins University Press, 2005 (departments.bucknell.edu).
- Henri Heim de Balsac und Max Bégouen: Faits noveaux concernant les Damans del l' Ahaggar. Bulletin du Museum National d'Histoire Naturelle 2, 1932, S. 478–483 (gallica.bnf.fr).
- Herbert Hahn: Von Baum-, Busch- und Klippschliefern. Wittenberg, 1959, S. 1–88.
- J. Roche: Systematique du genera Procavia et desmans en general. Mammalia 36, 1972, S. 22–49.
- D. A. Hungerford und R. L. Snyder: Chromosomes of the rock hyrax, Procavia capensis (Pallas), 1767. Experientia 25 (8), 1969, S. 870–870.
- Saud A. Al-Dakan und Abdulaziz A. Al-Saleh: Karyotype Determination of Rock Hyrax Procavia capensis in Saudi Arabia. Cytologia 80 (3), 2015, S. 287–293.
- Paulette Prinsloo und T. J. Robinson: Geographic Mitochondrial DNA Variation in the Rock Hyrax, Procavia capensis. Molecular Biolöogy and Evolution 9 (3), 1992, S. 447–456.
- Paulette Bloomer: Extant hyrax diversity is vastly underestimated. Afrotherian Conservation 7, 2009, S. 11–16.
- D. Tab Rasmussen und Mercedes Gutiérrez: Hyracoidea. In: Lars Werdelin und William Joseph Sanders (Hrsg.): Cenozoic Mammals of Africa. University of California Press, Berkeley, London, New York, 2010, S. 123–145.
- Robert Broom: On some new Pleistocene mammals from limestone caves of the Transvaal. South African Journal of Science 33, 1937, S. 750–768.
- Robert Broom: Some South African Pliocene and Pleistocene mammals. Annals of the Transvaal Museum 21 (1), 1948, S. 1–38.
- C. S. Churcher: The fossil Hyracoidea of the Transvaal and Taungs deposits. Annals of the Transvaal Museum. 22 (4), 1956, S. 477–501.
- C. R. McMahon und J. F. Thackeray: Plio-Pleistocene Hyracoidea from Swartkrans Cave, South Africa. South African Journal of Science 29 (1), 1994, S. 40–45.
- Lev 11,5, Dtn 14,7, Spr 30,26, Ps 104,18.
- Thomas Staubli: Tiergeographie des antiken Palästina/Israel. In: Thomas Staubli und Othmar Keel (Hrsg.): Im Schatten deiner Flügel. Tiere in der Bibel und im Alten Orient. Freiburg (Schweiz) un d Göttingen, 2001, S. 13–20.
- Thomas Shaw: Travels, or, observations relating to several parts of Barbary and the Levant. Oxford, 1738, S. 1–442 (S. 376) (biodiversitylibrary.org).
- Prospero Alpini: Historiæ Ægypti naturalis pars prima. Qua continentur Rerum Ægyptiarum libri quatuor. Opus posthumum, nunc primum. Leiden, 1735, S. 1 (S. 80 und 232) (gdz.sub.uni-goettingen.de).
- Peter Simon Pallas: Novae species quadrupedum e Glirium ordine. Erlangen, 1778, S. 1–388 (S. 278–281) (books.google.de)
- James Bruce: Travels to discover the source of the Nile : in the years 1768, 1769, 1770, 1771, 1772, and 1773. Vol. VI Dublin, 1790, S. 1–286 (S. 171–180) (biodiversitylibrary.org); deutsch: Reisen zur Entdeckung der Quellen des Nils in den Jahren 1768. 1769. 1770. 1771 und 1772. Band V. Leipzig, 1791, S. 1–384 (S. 145–152) (digitale.bibliothek.uni-halle.de).
- Johann Christian Daniel Schreber: Die Säugthiere in Abbildungen nach der Natur mit Beschreibungen. Vierter Teil. Erlangen, 1792, S. 923–926 (biodiversitylibrary.org) und Tafelband 1 Tafel 240 (biodiversitylibrary.org).
- Peter Kolb: Caput Bonæ Hodiernum Das ist : Vollständige Beschreibung des africanischen Vorgebürges der Guten Hofnung. Nürnberg, 1719, S. 1–846 (S. 159) (archive.org).
- L. C. Rookmaker: The Zoological Exploration of Southern Africa. Rotterdam, 1989, S. 1–368.
- Rodolphe Tabuce und Stéphane Schmitt: De l’ombre aux Lumières et réciproquement: redécouverte du crâne de Procavia capensis (Pallas, 1766) (Hyracoidea, Mammalia) décrit en 1767 par Daubenton dans l’Histoire naturelle. Zoosystema 39 (4), 2017, S. 487–499.
- Arnout Vosmaer: Beschrijving van eene zeer vreemde en geheel nieuwe soort van africaansch basterd-mormeldier, zich onthoudende op de steen- of klipbergen van de Kaap de Goede Hoop. Amsterdam, 1767, S. 1–8 (docplayer.nl).
- Peter Simon Pallas: Miscellanea zoologica. Den Haag, 1766, S. 1–224 (S. 30–47) (biodiversitylibrary.org).
- Jacob Theodor Klein: Quadrupedum dispositio brevisque historia naturalis. Leipzig, 1751, S. 1–128 (S. 49) (biodiversitylibrary.org).
- Georges-Louis Leclerc de Buffon: Histoire naturelle, générale et particulière. Tome Quinzième. Paris, 1767, S. 205–207 (gallica.bnf.fr), Supplément, Tome Troisième. Paris, 1776, S. 177–181 sowie Tafel 29 (gallica.bnf.fr), Supplément, Tome Sixième. Paris, 1782, S. 276–282 sowie Tafel 42 und 43 (gallica.bnf.fr) und Supplément, Tome Septième. Paris, 1789, Tafel 37 (gallica.bnf.fr).
- Gottlieb Conrad Christian Storr: Prodromus methodi mammalium. Tubingen, 1780, S. 1–43 (S. 40) (reader.digitale-sammlungen.de).
- Johann Hermann: Tabula affinitatum animalium. Straßburg, 1783, S. 1–370 (S. 115) (biodiversitylibrary.org).
- John Edward Gray: Revision of the species of Hyrax, founded on the specimens in the British Museum. Annals and Magazine of Natural History 4 (1), 1868, S. 35–52 (biodiversitylibrary.org).
- Fernand Lataste: Sur le système dentaire du genre daman. Annali del Museo civico di storia naturale di Genova 24, 1886, S. 5–40 (biodiversitylibrary.org).
- Oldfield Thomas: On the species of Hyracoidea. Proceedings of the Zoological Society of London 1892, S. 50–76 (biodiversitylibrary.org).
- August Wilhelm von Mellin: Der Klipdas. ohne Ortsangabe, etwa 1780, S. 1–14 (reader.digitale-sammlungen.de).
- Félix Vicq d’Azyr: Encyclopédie méthodique. Systême anatomique. Quadrupèdes. Tome second. Paris, 1792, S. 1–632 (S. CIII) (books.google.de)
- Christian Rudolph Wilhelm Wiedemann: Beschreibung des Schädels vom Daman (Hyrax capensis). Archiv für Zoologie und Zootomie 3, 1802, S. 42–51 (reader.digitale-sammlungen.de).
- Peter Simon Pallas: Spicilegia zoologica quibus novæ imprimis et obscuræ animalium species iconibus, descriptionibus atque commentariis illustrantur. Fasciculus undecimus. Berlin, 1776, S. 1–86 (S. 85–86) (biodiversitylibrary.org).
- Georges Cuvier: Description ostéologique et comparative du Daman Hyrax Capensis. Annales du Muséum national d’Histoire naturelle 3, 1804, S. 171–182 (biodiversitylibrary.org).
- Georges Cuvier: Le regne animal distribue d'apres son organisation pour servir de base a l'histoire naturelle des animaux et d'introduction a l'anatomie comparee. (Band 1) Paris, 1817, S. 1–540 (S. 227–242) (gallica.bnf.fr).
- Martin S. Fischer: Hyracoids, the sister-group of perissodactyls. In: Donald R. Prothero und Robert M. Schoch (Hrsg.): The evolution of perissodactyls. New York und London 1989, S. 37–56.
- Wilfried W. de Jong, Anneke Zweers und Morris Goodman: Relationship of aardvark to elephants, hyraxes and sea cows from α-crystallin sequences. Nature 292, 1981, S. 538–540.
- Michael J. Stanhope, Victor G. Waddell, Ole Madsen, Wilfried Jong, S. Blair Hedges, Gregory C. Cleven, Diana Kao und Mark S. Springer: Molecular evidence for multiple origins of Insectivora and for a new order of endemic African insectivore mammals. PNAS 95, 1998, S. 9967–9972.
- Robert Broom: On the Fossil Remains Associated with Australopithecus africanus. South African Journal of Science 31, 1934, S. 471–480.
- J. C. Middleton Shaw: Evidence concerning a large fossil hyrax. Journal of Dental Research 16 (1), 1937, S. 37–40.
- Gary T. Schwartz: Re-evaluation of the Plio-Pleistocene hyraxes (Mammalia: Procaviidae) from South Africa. Jahrbuch für Geologie und Paläontologie Abhandlungen 206, 1997, S. 365–383.
- B. R. Collins: The Taphonomy of the Final Middle Stone Age Fauna from Sibudu Cave, South Africa. International Journal of Osteoarchaeology 25 (6), 2015, S. 805–815.
- Shaw Badenhorst, Karen L. van Niekerk und Christopher S. Henshilwood: Rock Hyraxes (Procavia capensis) from Middle Stone Age Levels at Blombos Cave, South Africa. African Archaeological Review 31, 2014, S. 25–43.
- Rivka Rabinovich und Rebecca Biton: The EarlyeMiddle Pleistocene faunal assemblages of Gesher Benot Ya‘aqov: Inter-site variability. Journal of Human Evolution 60, 2011, S. 357–374.
- Ofer Marder, Reuven Yeshurun, Ronit Lupu, Guy Bar-Oz, Miriam Belmaker, Naomi Porat, Hagai Ron und Amos Frumkin: Mammal remains at Rantis Cave, Israel, and Middle–Late Pleistocene human subsistence and ecology in the Southern Levant. Journal of Quaternary Science 26 (8), 2011, S. 769–780.
- Peter Coals und Francis Gilbert: Notes on hyrax in South Sinai’s high mountains. Afrotherian Conservation 11, 2015, S. 5–8.
- Thomas B. Stevenson und Brian Hesse: "Domestication" of Hyrax (Procavia capensis) in Yemen. Journal of EthnobioIology 10 (1), 1990, S. 23–32.
- Kirsten Wimberger, Colleen T. Downs und Mike R. Perrin: Two unsuccessful reintroduction attempts of rock hyraxes (Procavia capensis) into a reserve in the KwaZulu-Natal Province, South Africa. South African Journal of Wildlife Research 39 (2), 2009, S. 192–201.
- T. Butynski, H. Hoeck, L. Koren und Y. A. de Jong: Procavia capensis. The IUCN Red List of Threatened Species 2015. e.T41766A21285876 (); zuletzt abgerufen am 24. Januar 2018.
- Asita Okorie Asita, Thabang Rants’o, Sibusisiwe Magama und Matsepo Taole: Evaluation of Procavia capensis hyraceum used in traditional medicine for modulation of mutagen-induced genotoxicity. Journal of Medicinal Plants Research 12 (17), 2018, S. 209–216, doi:10.5897/JMPR2018.6589
Weblinks
- Procavia capensis in der Roten Liste gefährdeter Arten der IUCN 2015. Eingestellt von: T. Butynski, H. Hoeck, L. Koren & Y. A. de Jong, 2014. Abgerufen am 24. Januar 2018.
- Informationen über das Klippschliefergenom bei Ensembl (englisch)
- Hyrax vocalizations Rufe der Schliefer, aufgenommen im Rahmen des Eastern Africa Primate Diversity and Conservation Program, zuletzt abgerufen am 15. Dezember 2017