Raoultsches Gesetz
Das Raoultsche Gesetz (benannt nach dem französischen Chemiker François Marie Raoult) ist ein idealisiertes Gesetz zur Beschreibung des Dampfdrucks flüssiger Gemische.
Steht ein Gemisch mehrerer Stoffe mit seinem eigenen Dampf im Gleichgewicht, dann hat jede Komponente des Gemisches in der Dampfphase einen Partialdruck, der kleiner ist als der Gleichgewichtsdampfdruck, den sie als reine Substanz besitzt („Dampfdruckerniedrigung“). Das Raoultsche Gesetz macht eine Aussage über die Stärke der Dampfdruckerniedrigung: Wenn die Mischung das Raoultsche Gesetz befolgt, ist der Partialdruck jeder enthaltenen Komponente gegeben durch das Produkt aus dem Stoffmengenanteil der Komponente und dem Dampfdruck, den sie als reine Substanz hat. Der Partialdruck jeder Komponente ist also proportional zu ihrem Stoffmengenanteil.
Das Raoultsche Gesetz ist eine Idealisierung; die meisten realen Mischungen weichen mehr oder weniger stark von diesem idealisierten Verhalten ab. Das Gesetz ist dennoch nützlich als Näherungsgesetz. Es eignet sich in der Regel gut zur Beschreibung des Dampfdrucks des Lösemittels in stark verdünnten Lösungen. (In realen stark verdünnten Lösungen gilt in der Regel auch das Henry-Gesetz, das den Zusammenhang zwischen dem Stoffmengenanteil der gelösten Substanz und ihrem Dampfdruck beschreibt. Beide Gesetze hängen eng zusammen.)
Raoultsches Gesetz
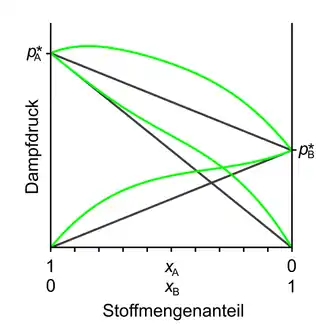
Betrachtet man eine flüssige Mischung aus den Komponenten und , die mit ihrem eigenen Dampf im Gleichgewicht steht, dann sind und nach dem Raoultschen Gesetz in der Gasphase mit folgenden Partialdrücken vorhanden:
Dabei sind und die Stoffmengenanteile von beziehungsweise in der Mischung. Für die Stoffmengenanteile gilt gemäß ihrer Definition stets .
und sind die Gleichgewichtsdampfdrücke von beziehungsweise bei der gegebenen Temperatur, wenn sie als Reinstoffe vorliegen. Da Stoffmengenanteile stets kleiner oder gleich Eins sind, haben die gemischten Stoffe in der Mischung kleinere Partialdrücke als wenn sie in reiner Form vorliegen.
Der Gesamtdruck der Gasphase ist nach dem Daltonschen Gesetz die Summe der Partialdrücke, beträgt also
Der Gesamtdruck variiert demnach in Abhängigkeit von der Zusammensetzung der Mischung linear zwischen (wenn nur vorhanden ist) und (wenn nur vorhanden ist). Im nebenstehenden Diagramm sind die aus dem Raoultschen Gesetz folgenden Partialdrücke und der Gesamtdruck als schwarze Linien eingetragen.
Dieselben Zusammenhänge gelten sinngemäß auch für Mischungen, die aus mehr als zwei Komponenten bestehen.
Ideale und reale Mischungen
Ideale Mischungen
Das Raoultsche Gesetz beschreibt allerdings nur einen Idealfall. Von Mischungen, die aus chemisch ähnlichen Komponenten bestehen (beispielsweise Benzol und Toluol),[1] wird es verhältnismäßig gut über den ganzen möglichen Zusammensetzungsbereich hinweg befolgt. Eine Mischung, die das Raoultsche Gesetz für alle Zusammensetzungen strikt befolgt, nennt man eine ideale Mischung.[1]
Die meisten realen Mischungen weichen jedoch mehr oder weniger stark vom Raoultschen Gesetz ab. Das Diagramm zeigt als grüne Linien die Partialdrücke und den Gesamtdruck einer beispielhaften realen Mischung. In vielen Fällen sind die Abweichungen vom Raoultschen Gesetz noch deutlich stärker als hier dargestellt.
Die Moleküle in den Flüssigkeiten unterliegen Wechselwirkungen mit den umgebenden Molekülen. In den reinen Flüssigkeiten wechselwirken die Moleküle nur mit Molekülen derselben Art: und . In der Mischung sind die Moleküle nicht nur von Molekülen derselben Art, sondern auch von Molekülen der jeweils anderen Art umgeben. In einer idealen Mischung wären die Wechselwirkungen in der Mischung im Mittel gleich den mittleren Wechselwirkungen und in den Reinstoffen,[2] so dass sich für ein gegebenes Molekül energetisch nichts ändern würde, wenn es vom Reinstoff in die Mischung kommt, einige seiner Wechselwirkungspartner also durch solche der anderen Art ersetzt werden. In chemisch ähnlichen Stoffen kann dies näherungsweise erfüllt sein, je größer die Unterschiede jedoch sind, desto stärker weicht die Mischung vom idealen Verhalten ab.
Reale Mischungen
Abweichungen vom idealen Verhalten können positiv oder negativ sein. Positive Abweichungen sind zu erwarten, wenn die Wechselwirkungsenergie kleiner ist als das Mittel aus den Wechselwirkungsenergien und . Wenn beispielsweise eine verdünnte Lösung von in vorliegt und die Anziehung stärker ist als die Anziehung , dann ist eine geringere Anzahl von -Molekülen in der Lösung energetisch günstiger, die -Moleküle haben eine stärkere Neigung, die Lösung zu verlassen und der Partialdruck von über der Lösung wird größer sein als es dem Raoultschen Gesetz entspricht.[3]
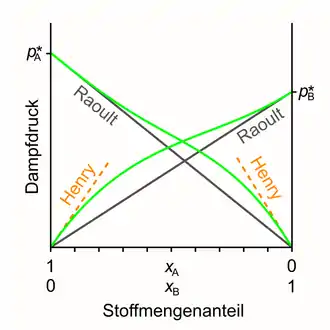
Auf beiden Seiten des Diagramms enden die idealen und die realen Kurven in denselben Punkten. Wie die Beobachtung zeigt, schmiegt sich die Kurve einer realen Substanz tangential an die ideale Raoultsche Gerade an, wenn der Stoffmengenanteil dieser Substanz sich dem Wert nähert.[4] Auch wenn also eine Substanz dem Raoultschen Gesetz im Allgemeinen nicht gehorcht, hat ihre Dampfdruckkurve doch zumindest bei einem Stoffmengenanteil nahe näherungsweise dieselbe Steigung wie die Raoultsche Gerade. Die Substanz gehorcht in diesem Bereich daher näherungsweise dem Raoultschen Gesetz:
- .
Geht der Stoffmengenanteil einer Substanz gegen Null, nähert sich die reale Kurve ebenso wie die ideale Kurve dem Partialdruck Null. Statt an die ideale Raoultsche Kurve schmiegt sie sich jedoch tangential an eine Gerade mit einer im Allgemeinen anderen Steigung an.[5] Diese Gerade beschreibt das Henry-Gesetz, gemäß welchem der Partialdruck ebenfalls proportional zum Stoffmengenanteil ist, aber mit einer anderen Proportionalitätskonstanten. Eine mit kleinem Stoffmengenanteil vorhandene Substanz gehorcht also näherungsweise dem Henry-Gesetz:
- .
Nur wenn eine Substanz sich im gesamten Zusammensetzungsbereich ideal verhält, fallen Raoultsche und Henrysche Gerade zusammen.
Mischungen, in denen der Anteil einer Komponente dominiert, werden typischerweise auch als Lösung bezeichnet – die hauptsächlich vorhandene Komponente als Lösungsmittel und die in geringer Menge vorhandenen Komponenten als gelöste Substanzen. Je geringer der Anteil der gelösten Substanzen ist, desto verdünnter ist die Lösung. Das Raoultsche Gesetz beschreibt also näherungsweise den Zusammenhang zwischen dem Partialdruck und dem Stoffmengenanteil des Lösungsmittels in verdünnten Lösungen. Das Henry-Gesetz beschreibt näherungsweise den Zusammenhang zwischen Partialdruck und Stoffmengenanteil der gelösten Substanzen in verdünnten Lösungen.
Herleitung
Anschauliche Herleitung
Befindet sich die reine flüssige Substanz im Gleichgewicht mit ihrem Dampf, so ist die Kondensationsrate von Dampfmolekülen auf einem Flächenelement der Flüssigkeitsoberfläche proportional zum Dampfdruck , kann mit der Proportionalitätskonstanten also geschrieben werden als . Die Rate der vom Flächenelement ausgehenden Verdunstung hat im Gleichgewicht denselben Betrag, es gilt also[6]
- .
Nun sei Substanz in einer anderen Flüssigkeit gelöst. Ihr Dampfdruck über der Mischung hat jetzt den Wert , der im Folgenden bestimmt werden soll. Es kann angenommen werden, dass ein aus dem Dampfraum kommendes -Molekül nach wie vor kondensieren kann, wenn es auf einen beliebigen Teil des Flächenelements trifft. Seine Kondensationsrate ist daher jetzt , mit derselben Proportionalitätskonstanten , aber dem neuen Dampfdruck . Die Verdunstung von -Molekülen kann jetzt jedoch nur von jenem Bruchteil der Oberfläche erfolgen, der mit -Molekülen besetzt ist. Dieser Bruchteil ist ungefähr gleich dem Stoffmengenanteil in der Mischung, sofern die beiden Molekülarten etwa gleiche Größe besitzen und die Zusammensetzung der Oberfläche gleich der Zusammensetzung im Mischungs-Volumen ist. Die Verdunstungsrate ist jetzt , wobei die veränderte molekulare Umgebung berücksichtigt und die geometrische Verringerung der Verdunstungsfläche beschreibt. Im Gleichgewicht gilt also
- .
Aus den beiden Ratengleichungen folgt unter Eliminierung von :
- .
Die Verdunstungsraten und hängen von den molekularen Kräften ab, die ein Molekül überwinden muss, um aus der Mischung beziehungsweise der reinen Substanz zu verdunsten. Falls diese Kräfte in beiden Fällen für alle Zusammensetzungen untereinander gleich sind (), reduziert sich diese Gleichung auf das Raoultsche Gesetz:[6]
- .
In realen Mischungen ist die Gleichheit meist nicht für alle Zusammensetzungen gegeben, so dass das Raoultsche Gesetz nicht für den gesamten Zusammensetzungsbereich gilt. In diesem Fall gelten aber für eine stark konzentrierte Komponente (das Lösungsmittel) und für stark verdünnte Komponenten (stark verdünnte gelöste Substanzen) näherungsweise die folgenden Überlegungen:
Wenn die Mischung hauptsächlich aus Substanz besteht, ist ein -Molekül fast nur von anderen -Molekülen umgeben, die Anwesenheit der wenigen -Moleküle ändert die Kräfteverhältnisse nur wenig und es gilt . In realen Mischungen ist das Raoultsche Gesetz daher in der Regel für die dominierende Komponente näherungsweise anwendbar.
Wenn andererseits Substanz stark verdünnt vorliegt, kann erwartet werden, dass – selbst wenn es im Allgemeinen mit der Zusammensetzung variiert – doch einen konstanten, von der Zusammensetzung unabhängigen Wert annimmt, weil dann ein -Molekül praktisch ausschließlich von -Molekülen umgeben ist und das Kraftfeld, das zur Verdunstung überwunden werden muss, stets dasselbe ist. In der verdünnten Lösung ist also konstant und kann mit dem ohnehin konstanten zu einer neuen Konstanten zusammengefasst werden:
- .
Dies ist das Henry-Gesetz.[6] Es ist in realen Mischungen in der Regel für stark verdünnt vorliegende Komponenten näherungsweise anwendbar.
Die Konstante im Raoultschen Gesetz ist der Dampfdruck der betrachteten Substanz im reinen Zustand. Bei strikter Gültigkeit des Raoultschen Gesetzes hängt der verringerte Partialdruck dieser Substanz also nur von den Eigenschaften der Substanz selbst und den Stoffmengenanteilen der anderen Substanzen ab, nicht jedoch von deren Eigenschaften – er ist eine kolligative Eigenschaft. In realen Mischungen können die Eigenschaften je nach Ausmaß der Nichtidealität auch eine Rolle spielen.
Die Konstante im Henry-Gesetz wird hauptsächlich durch die Wechselwirkungen mit den umgebenden Molekülen bestimmt,[7] hängt also stets auch von den Eigenschaften aller anderen enthaltenen Substanzen ab.
Thermodynamische Herleitung
Für die thermodynamische Herleitung sei angenommen, dass die Substanzen und sich in Dampfform in hinreichender Näherung wie ideale Gase verhalten. Wie im Artikel → Gibbs-Energie gezeigt wird, sind die chemischen Potentiale der Dämpfe unter dieser Bedingung von der Form[8]
- ,
wobei die Standardpotentiale nur von der Temperatur und insbesondere nicht von der Zusammensetzung der Dampfmischung abhängen. ist die Gaskonstante und die absolute Temperatur. Der Partialdruck ist durch die Druckeinheit als Referenzdruck dividiert zu denken, damit das Argument des Logarithmus dimensionslos ist.
Die flüssige Mischung wird als ideale Mischung vorausgesetzt, alle ihre Komponenten haben daher ein chemisches Potential der Form[8]
- ,
wobei die Standardpotentiale nur von der Temperatur und dem Druck, nicht aber von der Zusammensetzung der Mischung abhängen.
Da im thermodynamischen Gleichgewicht das chemische Potential jeder Komponente in beiden Phasen denselben Zahlenwert hat (sonst würde so lange Substanz von der Phase mit dem höheren Potential in die Phase mit dem geringeren Potential übergehen, bis die Potentiale ausgeglichen sind), gilt für alle Komponenten :
oder
mit
- .
Da sowohl die als auch die unabhängig von der Zusammensetzung sind, ist ebenfalls davon unabhängig. Gleichung gilt insbesondere auch für , also die reine Substanz mit dem Dampfdruck , so dass für den Zahlenwert von folgt
- ,
und da für alle Zusammensetzungen denselben Zahlenwert hat, folgt aus Einsetzen dieses Werts in Gleichung das Raoultsche Gesetz:
- .
Es ist auch möglich, dass eine Mischung sich nur in einem begrenzten Zusammensetzungsbereich ideal verhält. Schließt dieser Bereich die Zusammensetzung ein, gilt gemäß der soeben gezeigten Argumentation für diesen Bereich das Raoultsche Gesetz.
Andernfalls stellt Gleichung für ideale Bereiche nur Proportionalität zwischen und fest, ohne den Zahlenwert der Proportionalitätkonstanten festzulegen. Es handelt sich dann um das Henry-Gesetz. Da sich alle Mischungen der Idealität annähern, je verdünnter sie bezüglich aller Komponenten außer einer (dem Lösungsmittel) sind,[9] gilt in der Regel das Henry-Gesetz in verdünnten Lösungen näherungsweise für die gelösten Substanzen.
Beispiele
Raoultsches Gesetz
Würde die Lösung eines gegebenen Stoffes in Wasser sich ideal verhalten, dann ergäben sich bei einer Temperatur von 25 °C gemäß dem Raoultschen Gesetz unabhängig von der Natur des gelösten Stoffes die folgenden Wasserdampf-Partialdrücke über der Lösung:
| Molalität des gelösten Stoffes | Stoffmengenanteil des | Wasserdampfpartialdruck über | ||
|---|---|---|---|---|
| gelösten Stoffes | Wassers | idealer Lösung | Rohrzuckerlösung | |
| (mol/kg) | - | - | (Pa) | (Pa) |
| 0 | 0 | 1 | 3167 | 3167 |
| 0,2 | 0,0036 | 0,9964 | 3156 | 3155 |
| 0,5 | 0,0089 | 0,9911 | 3139 | 3136 |
| 1 | 0,0177 | 0,9823 | 3111 | 3104 |
| 2 | 0,0348 | 0,9652 | 3056 | 3033 |
Die Stoffmengenanteile des gelösten Stoffes und des Wassers sind aus den angegebenen Molalitäten des gelösten Stoffes berechnet: Wasser hat die molare Masse 18,02 g/mol, ein Kilogramm des Lösungsmittels Wasser entspricht also 55,49 Mol Wasser. Werden dem Kilogramm Wasser Mol des gelösten Stoffes hinzugefügt, beträgt dessen Stoffmengenanteil
- .
Der Gleichgewichtsdampfdruck reinen Wassers beträgt bei der angegebenen Temperatur 3167 Pa. Der Wasserdampfpartialdruck über der idealen Lösung ist nach dem Raoultschen Gesetz als berechnet. Zum Vergleich sind Messdaten für eine Rohrzuckerlösung[10] beigefügt. Wie der Vergleich zeigt, kann für diesen Fall das Raoultsche Gesetz als näherungsweise gültig angesehen werden.
Ausschlaggebend für den Stoffmengenanteil eines gelösten Stoffes ist die Anzahl der gelösten Teilchen, die sich in der Lösung unabhängig voneinander bewegen können.[11] Im obigen Beispiel ist die Molzahl der hinzugefügten Zuckermoleküle gleich der Molzahl der anschließend in der Lösung befindlichen Zuckermoleküle. Elektrolyte, die beim Lösungsvorgang in Ionen dissoziieren, ergeben pro Formeleinheit eine größere Anzahl von gelösten Teilchen. Eine Verbindung , die in der Lösung vollständig in Ionen und dissoziiert, liefert für jedes Mol eingebrachte Formeleinheiten zwei Mol Teilchen in der Lösung (ein Beispiel ist Kochsalz ). Dissoziiert die Verbindung nur teilweise, ist die Anzahl der resultierenden Teilchen entsprechend geringer. Liegt ein Stoff in der Lösung vollständig als Dimer vor, ist die Anzahl der in der Lösung vorliegenden Teilchen nur halb so groß wie die Anzahl der eingebrachten Teilchen. Das Raoultsche Gesetz erlaubt durch Messung des Dampfdrucks, diese Fälle experimentell zu unterscheiden und gegebenenfalls Rückschlüsse auf den vorliegenden Dissoziationsgrad zu ziehen.
Henry-Gesetz
Wie erwähnt hängt die Proportionalitätskonstante im Henry-Gesetz sowohl vom Lösungsmittel als auch vom gelösten Stoff ab. Die Henry-Konstanten von Sauerstoff und Stickstoff in Wasser sind beispielsweise bei 25 °C[12]
und .
Den Anteilen 0,21 beziehungsweise 0,78 der Gase Sauerstoff und Stickstoff am gesamten Atmosphärendruck entsprechend betragen ihre Partialdrücke bei einem Gesamtdruck von 1013 hPa
- und
- .
Die bei 25 °C in Wasser gelösten Stoffmengenanteile von und , die mit den Atmosphärengasen im Gleichgewicht stehen, sind also
- und
- .
Bei diesen kleinen Stoffmengenanteilen kann das Henry-Gesetz als näherungsweise gültig angesehen werden.
Siehe auch
- Duhem-Margules-Gleichung (erlaubt eine Krümmung der Kurve für eine bessere Approximation im Übergangsbereich)
Weblinks
- Video: Phasengleichgewichte von idealen Mischungen: Raoultsches Gesetz und die kolligativen Folgen. Jakob Günter Lauth (SciFox) 2013, zur Verfügung gestellt von der Technischen Informationsbibliothek (TIB), doi:10.5446/15230.
Literatur
- Erich Meister: Grundpraktikum Physikalische Chemie. Theorie und Experimente (= UTB. 8329). 2., überarbeitete und erweiterte Auflage. vdf – Hochschul-Verlag an der ETH, Zürich 2012, ISBN 978-3-8252-8489-3 (eingeschränkte Vorschau in der Google-Buchsuche).
- Karl Stephan, Franz Mayinger: Thermodynamik. Band 2: Mehrstoffsysteme und chemische Reaktionen. Grundlagen und technische Anwendungen. Springer, Berlin u. a. 1999, ISBN 3-540-64481-4, (eingeschränkte Vorschau in der Google-Buchsuche).
Einzelnachweise
- P. W. Atkins: Physikalische Chemie. 2. Nachdr. d. 1. Auflage. VCH, Weinheim 1990, ISBN 3-527-25913-9, S. 174.
- P. W. Atkins: Physikalische Chemie. 2. Nachdr. d. 1. Auflage. VCH, Weinheim 1990, ISBN 3-527-25913-9, S. 176.
- K. Denbigh: The Principles of Chemical Equilibrium. 4th ed., Cambridge University Press, Cambridge 1981, ISBN 0-521-28150-4, S. 229.
- K. Denbigh: The Principles of Chemical Equilibrium. 4th ed., Cambridge University Press, Cambridge 1981, ISBN 0-521-28150-4, S. 224.
- K. Denbigh: The Principles of Chemical Equilibrium. 4th ed., Cambridge University Press, Cambridge 1981, ISBN 0-521-28150-4, S. 225.
- K. Denbigh: The Principles of Chemical Equilibrium. 4th ed., Cambridge University Press, Cambridge 1981, ISBN 0-521-28150-4, S. 245f.
- K. Denbigh: The Principles of Chemical Equilibrium. 4th ed., Cambridge University Press, Cambridge 1981, ISBN 0-521-28150-4, S. 251.
- K. Denbigh: The Principles of Chemical Equilibrium. 4th ed., Cambridge University Press, Cambridge 1981, ISBN 0-521-28150-4, S. 249f.
- K. Denbigh: The Principles of Chemical Equilibrium. 4th ed., Cambridge University Press, Cambridge 1981, ISBN 0-521-28150-4, S. 249.
- P. W. Atkins: Physikalische Chemie. 2. Nachdr. d. 1. Auflage. VCH, Weinheim 1990, ISBN 3-527-25913-9, S. 190.
- K. Denbigh: The Principles of Chemical Equilibrium. 4th ed., Cambridge University Press, Cambridge 1981, ISBN 0-521-28150-4, S. 248.
- P. W. Atkins: Physikalische Chemie. 2. Nachdr. d. 1. Auflage. VCH, Weinheim 1990, ISBN 3-527-25913-9, S. 175.