Varroamilbe
Die Varroamilbe (Varroa destructor) ist eine (als adultes Weibchen) ca. 1,1 Millimeter lange und 1,6 Millimeter breite Milbe aus der Familie Varroidae, die als Parasit an Honigbienen (Apis mellifera und Apis cerana) lebt. Die Milbe entwickelt und vermehrt sich in der verdeckelten Brut im Bienenstock. Der Befall von Bienenvölkern durch die Milbenart wird als Varroose (alter Name: Varroatose) bezeichnet. Varroa destructor gilt als der bedeutsamste Bienenschädling weltweit.[1]
| Varroamilbe | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Varroa-Weibchen | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Varroa destructor | ||||||||||||
| Anderson & Trueman, 2000 |
In Österreich ist die Tierseuche Varroose anzeigepflichtig, in der Schweiz unter Gr. 4 Zu überwachende Seuchen (Meldepflicht) eingestuft. In Deutschland ist sie in § 15 der Bienenseuchen-Verordnung zwar geregelt, aufgrund ihrer Ubiquität wird aber von einer Anzeige- oder Meldepflicht abgesehen.
Namensherkunft
Die Gattung ist nach dem römischen Gelehrten Marcus Terentius Varro (116–27 v. Chr.) benannt, der Schriften über die Landwirtschaft verfasste.[2]
Körperbau

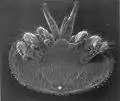 Bauchseite einer Varroamilbe. Links und rechts am Körper je vier Beine, wobei das erste Beinpaar zu Sinnesorganen umgebildet ist. Dazwischen der Stech- und Saugapparat.
Bauchseite einer Varroamilbe. Links und rechts am Körper je vier Beine, wobei das erste Beinpaar zu Sinnesorganen umgebildet ist. Dazwischen der Stech- und Saugapparat.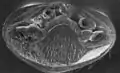
Die Art ist durch einen markanten Sexualdimorphismus ausgezeichnet. Die Männchen sind erheblich kleiner und schmaler, von eher dreieckig-tropfenförmiger Gestalt, ihre Beine sind im Verhältnis zur Körpergröße deutlich länger. Sie sind schwächer sklerotisiert und hellgelb. 80 % aller Varroamilben sind weiblich, nur sie verlassen die Brutwabe und treten damit in Erscheinung, während die Männchen nach der Begattung dort verbleiben und sterben.
Wie bei den meisten Milben ist der Körper der Varroamilbe in zwei Abschnitte geteilt, die Idiosoma und Gnathosoma genannt werden.[4][5] Das Gnathosoma, an dem die Mundwerkzeuge sitzen, ist relativ klein und auf die Bauchseite zwischen die Hüften (Coxen) des ersten Beinpaars verlagert, es ist bei Betrachtung von oben nicht sichtbar. Das Idiosoma ist auf der Rückenseite von einem ungeteilten, stark sklerotisierten Schild bedeckt, der rotbraun ist. Auf der Bauchseite sitzen mehrere ebenfalls rotbraune Ventralschilde, die durch Nähte miteinander verbunden sind. Der Rückenschild des Weibchens ist queroval und deutlich breiter als lang, er ist dicht mit Borsten (Setae) bedeckt. Die Mundwerkzeuge bestehen aus zwei als Sinnesorgane dienenden Pedipalpen und zwei dreigliedrigen Cheliceren, die der Nahrungsaufnahme dienen. Das letzte Chelicerenglied ist als beweglicher, gezähnter Chelicerenfinger ausgebildet, mit ihm kann die Milbe die Körperwand ihrer Wirtsbiene aufschneiden. Der zweite, unbewegliche Chelicerenfinger fehlt (Familienmerkmal). Die Milbe besitzt vier Beinpaare, deren erstes sechsgliedrig ist, die übrigen sind siebengliedrig. Die kurzen, kräftigen Beine tragen keine Klauen, stattdessen sitzen auf der Oberfläche als Apotelen bezeichnete Strukturen, die zum Festhalten dienen. Das nach vorn gestreckte erste Beinpaar dient als Sinnesorgan. Es trägt neben verschiedenen Sinneshaaren, die als Mechano- und Chemorezeptoren dienen, ein grubenartiges Sinnesorgan, ähnlich dem Haller-Organ der Zecken.
Auf der Bauchseite des Idiosomas sitzt eine langgestreckte Einsenkung, das Peritrema. Diese ist mit den Stigmen des Tracheensystems verbunden, die auf der Bauchseite außen sitzen, und dient als Atemorgan.
Lebenszyklus und Entwicklung
Die Art ist in allen Lebensstadien parasitisch und kommt niemals frei lebend, sondern ausschließlich im Inneren von Bienenstöcken, oder auf Bienen, vor. Alle Nymphenstadien und die Männchen leben im Inneren von verdeckelten Brutzellen.[4] Nur die Weibchen kommen auch außerhalb der Zellen vor. Sie sitzen dann normalerweise an der Bauchseite des Hinterleibs von erwachsenen Bienen, meist in die Intersegmentalhaut zwischen den Bauchschilden eingebohrt, können aber auch andernorts am Körper sitzen. Gegen das Putzverhalten der Bienen sind sie durch den festen Rückenschild gut geschützt. Die Übertragung der Varroamilbe auf weitere Bienenvölker ist natürlicherweise nur bei direktem Körperkontakt durch fehlorientierte oder nahrungsraubende Arbeiterinnen in fremden Stöcken möglich. Die adulten Varroa-Weibchen saugen zur Nahrungsaufnahme an den Arbeiterinnen, für ihre Vermehrung sind sie aber an die Brutwaben des Bienenstockes gebunden.
Die Varroa-Weibchen verlassen die adulte Biene, während diese eine Brutzelle mit einer verpuppungsbereiten Altlarve (fünftes Larvenstadium) verdeckelt. Obwohl verschiedene Chemorezeptoren und aus Verhaltensexperimenten eine anlockende Wirkung von Bienenlarven, Kokonmaterial und Nahrungsvorräten auf die Milbe bekannt sind, wird der auslösende Reiz noch nicht im Detail verstanden. Brut von Drohnen wird bis zu achtmal stärker befallen als die von Arbeiterinnen, Königinnenbrut jedoch so gut wie nie. Die Milbe wandert durch den Zwischenraum zwischen der Bienenlarve und der Zellenwand zum Zellenboden, der den restlichen Nahrungsvorrat enthält, möglicherweise, um Abwehrverhalten der Bienen zu entgehen. Die Milbe beginnt an der Bienenlarve zu saugen, wenn der Nahrungsvorrat aufgebraucht ist. Sie legt etwa 50 Stunden nach der Verdeckelung ihr erstes Ei ab. Dieses bleibt unbefruchtet und entwickelt sich aufgrund der Geschlechtsbestimmung über Haplodiploidie zu einem Varroa-Männchen. Die folgenden Eier, die mit etwa 30 Stunden Abstand gelegt werden, werden befruchtet und entwickeln sich daher zu Weibchen. Eine Muttermilbe legt bei Arbeiterinnenlarven fünf, bei Drohnenlarven sechs weibliche Eier ab.
Das erste Entwicklungsstadium der Varroa ist eine sechsbeinige Larve, die sich vollständig innerhalb der Eischale entwickelt. Daraus entsteht im zweiten Entwicklungsstadium eine achtbeinige Protonymphe, die aus dem Ei schlüpft. Sie häutet sich zum dritten Entwicklungsstadium, der Deutonymphe, aus der die neue Generation adulter Milben hervorgeht. Beide Nymphenstadien werden gegen Ende ihrer Wachstumsperiode unbeweglich, dieses immobile Übergangsstadium wird als Chrysalis bezeichnet. Während die Nymphen weiß sind, besitzt das letzte Ruhestadium (Deutochrysalis) bereits die braune Farbe der adulten Milbenweibchen.
Weder Nymphen noch Männchen der Varroamilbe sind zur unabhängigen Nahrungsaufnahme fähig, denn ihre Mundwerkzeuge können das Integument der Bienenlarve nicht durchdringen; beim Männchen sind diese zu spezialisierten Begattungsorganen umgebildet und für die Nahrungsgewinnung nicht verwendbar. Sie sind darauf angewiesen, dass die Muttermilbe der Bienenlarve oder -puppe Wunden beibringt, an denen sie saugen können. Diese liegen normalerweise am fünften Segment der Wirtsbiene.
Die Milbenweibchen werden unmittelbar nach der Häutung zum Adulttier geschlechtsreif. Die Geschwister paaren sich in den Tagen, bevor die Biene schlüpft, mehrere Male untereinander. Das Männchen begattet die Weibchen im Inneren der noch verdeckelten Brutzelle, indem es eine Spermatophore direkt in die Gonophore des Weibchens überträgt, welche sie in einer Spermatheca speichert, um die weiteren Eier damit befruchten zu können. Das Männchen stirbt anschließend, ohne die Zelle je zu verlassen. Die Milbenweibchen verlassen die Zelle zusammen mit der schlüpfenden Biene nach etwa 12 Tagen, während das Männchen zurückbleibt.[6] Das Muttertier kann die Zelle ebenfalls für einen zweiten, seltener sogar einen dritten solchen Fortpflanzungszyklus, wieder verlassen. Trotz der relativ moderaten Fortpflanzungsrate und einem nicht unerheblichen Anteil von Milben, die sich aus unbekannten Gründen gar nicht fortpflanzen, kollabieren Bienenvölker unter gemäßigten Klimabedingungen etwa drei bis vier Jahre nach der Infektion mit Varroa destructor. In wärmerem, subtropischem oder tropischem Klima wächst die Milbenpopulation dagegen langsamer.
Verbreitung und Wirtsarten
Varroa destructor (lat., dt. zerstörerische Milbe) wurde im Jahr 2000 durch Anderson und Trueman beschrieben.[7] Zuvor wurden die Milben der bereits länger bekannten Art Varroa jacobsoni Oudemans, 1904 zugerechnet, die nur in Südostasien vorkommt. In älterer Literatur ist die Art deshalb unter diesem Namen aufgeführt.
Der ursprüngliche Wirt von Varroa destructor ist die Östliche Honigbiene (Apis cerana). Bei dieser Art werden ausschließlich die Larven von Drohnen befallen, eine Entwicklung an Arbeiterinnen erfolgt nicht.[4] Die Milbenart war auf das tropische Ostasien beschränkt, wo drei weitere Arten der Gattung, westlich bis Nepal, leben.[4][8] Auf die westliche Honigbiene, Apis mellifera, ging die Art durch in Kultur gehaltene Bienen über, die in die Heimat von Apis cerana eingeführt worden waren. Zusätzliche Wirte von Varroa destructor sind nicht bekannt.
Durch molekulargenetische Untersuchungen von Varroamilben wurden unterschiedliche Stammlinien der Art und ihrer nahe verwandten Schwesterart Varroa jacobsoni identifiziert, die verschiedene Teile ihres natürlichen Verbreitungsgebiets besiedeln. Nur zwei dieser Typen sind auf Apis mellifera übergegangen, von denen nur einer (der sog. koreanische Haplotyp) weltweit verschleppt worden ist. Die weltweit verbreiteten Milben sind, im Gegensatz zu denjenigen ihrer Ursprungsheimat, genetisch so uniform, dass sie als Klone betrachtet werden können.[9]
Heute ist Varroa destructor mit Ausnahme von Australien und der Antarktis[10] weltweit verbreitet. Die Art ist vor allem durch den Versand von Bienenvölkern und Königinnen verschleppt worden. Der erste Nachweis von der russischen Pazifikküste stammt von 1952, aus Japan von 1958. In Europa wurde sie zuerst 1967 in Bulgarien gefunden. Der erste deutsche Nachweis stammt aus dem Jahr 1977.[11]
In vielen Teilen Europas sind die Imker wegen der großflächigen Monokulturen der industrialisierten Landwirtschaft zum Wandern mit ihren Völkern gezwungen, was die schnelle Verbreitung des Parasiten begünstigt.

Erkrankung und Bienensterben
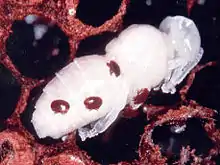
Milbenbefall schwächt die Bienen auf verschiedenen Wegen. Durch das Aussaugen der Hämolymphe verlieren befallene Larven direkt an Gewicht, die ausgeschlüpften Bienen bleiben um etwa ein Zehntel kleiner als gesunde Tiere. Nach einer neueren Studie ist der Hauptanteil der Nahrung das Fettgewebe, wenn sie auf erwachsenen Bienen parasitieren.[12] Die befallenen Tiere besitzen eine deutlich verkürzte Lebensspanne, haben schlechtere Lernleistungen und kehren häufiger in den Stock nicht zurück.
Zusätzlich werden durch den Milbenbefall schädigende Viren (z. B. Flügeldeformationsvirus) übertragen.[4][10] Von den achtzehn von Honigbienen bekannten pathogenen Viren werden fünf nachweislich durch Varroamilben als Vektor übertragen. Außerdem kann durch die Schädigung des Immunsystems der Biene vorher unterdrückter Pathogenbefall nun virulent werden. Meist wird angenommen, dass für den schließlich eintretenden Zusammenbruch des Bienenstaats weniger die Schädigung durch die Milbe selbst, sondern eher die Ausbreitung und Förderung der Pathogene verantwortlich ist. Auch der Befall mit dem Einzeller Nosema apis oder anderen Nosema-Arten trägt möglicherweise dazu bei.
Die Varroamilbe gilt als eine Hauptursache des in Deutschland seit einigen Jahren immer wieder im Herbst oder dem Winterhalbjahr auftretenden seuchenartigen Bienensterbens,[13][14][15] vor allem bei einer gleichzeitigen Belastung durch Neonicotinoide.[16]
Resistenzen
Varroa destructor schädigt ihren Ursprungswirt, die Östliche Honigbiene (Apis cerana), nur milde und unwesentlich (Varroatoleranz). Bei dieser Art werden ausschließlich Drohnenlarven befallen. Die Bienen sind bei der Entfernung des Parasiten erfolgreicher, außerdem verbleiben stark befallene Drohnen in der Zelle, ohne auszuschlüpfen, wodurch die Vermehrung der Milbe begrenzt bleibt. Bei der Westlichen Honigbiene (Apis mellifera) fehlen diese wohl durch Koevolution entstandenen Abwehrmechanismen weitgehend.
Jedoch wurden auch unter den Völkern der Westlichen Honigbiene solche gefunden, die natürlicherweise mit dem Parasitenbefall besser zurechtkommen als andere. Gut dokumentiert ist, dass Afrikanisierte Honigbienen resistenter sind als die Stammform.[17] Ähnlichens gilt für die Sizilianische Honigbiene (Apis mellifera siciliana)[18][19][20] In Europa existieren Populationen in Gotland (Schweden) und Avignon (Frankreich), die Milbenbefall, anders als üblich, viele Jahre tolerieren können.[21] Es gibt Zuchtprogramme für so genannte VSH-Bienen (englisch Varroa Sensitive Hygiene bees)[22] In den USA wurden zwei Stämme entwickelt, die beschädigte Puppen unter Deckeln erkennen und entfernen können, bevor sich der Befall weiter ausbreitet.[23][24] Der Stamm „IN“/Indiana wird an der Purdue University entwickelt, um Linien zu entwickeln, die anhaftende Varroamilben ausputzen und durch Bisse abtöten.[25] Unterdrückte Milbenvermehrung ist beispielsweise durch „Recapping“ der Brutzellen möglich.[26][27] Stärkere Resistenzen als die meisten westeuropäischen Zuchtlinien besitzen auch russische Stämme (Primorski-Bienen).
Die Züchtung resistenter bzw. toleranter Linien gilt als einzige langfristig erfolgversprechende Bekämpfungsmethode der Milbe und wird deshalb an verschiedenen Stellen durch Einkreuzen resistenterer Linien in die üblicherweise verwendeten Stämme versucht.
Bekämpfung
In jedem Fall ist es wichtig, durch laufende Kontrolle die Befallsstärke abzuschätzen. Dies geschieht durch Gemülldiagnose, indem die pro Tag auf den Boden der Bienenbeute abgefallenen toten Milben gezählt werden. Fallen im Juli 5 bis 10 Milben pro Tag, kann der Befall bereits kritisch sein. Genauer kann der Befall eines Bienenvolks mit dem Edlinger Varroaindikator[28] errechnet werden. Der Indikator errechnet aus dem Datum und der Anzahl toter Milben mehrerer Tage eine ungefähre Befallstärke und wie viele Milben bei einer Behandlung bekämpft werden können. Unterschieden wird darüber hinaus zwischen einem Bienenvolk mit und ohne Brut. Entwickelt wurde der Indikator über mehrere Jahre vom Imker Kurt Edlinger. Eine weitere Diagnosemöglichkeit zur Befallskontrolle ist die Puderzuckermethode. Mithilfe dieser Methode kann die Befallstärke schnell und sehr genau bestimmt werden. Würde Puderzucker zur Therapie benutzt werden, wäre das nach dem Arzneimittelgesetz zu beurteilen.[29]
Chemische Bekämpfungsmethoden

Die Bekämpfung der Milben mit Akariziden, vor allem Phosphorsäureester und Pyrethroiden, gehörte zu den ersten Bekämpfungsstrategien. Inzwischen sind zahlreiche Populationen von Varroa destructor gegen eine Vielzahl dieser Präparate resistent.[4] Weitere Nachteile der Akarizidbehandlung sind Rückstände in Wachs und Honig und Bienenschädigungen durch gemeinsame Exposition gegenüber anderen in der Umwelt verbreiteten Chemikalien.
Teilweise gute Erfolge wurden für den Einsatz organischer Säuren wie Ameisensäure (flüssig; mischbar mit Wasser), Milchsäure (als Racemat flüssig; mischbar mit Wasser) und Oxalsäure (fest; bis 10 % löslich in Wasser) berichtet. Milchsäure verwendet man vorwiegend im Sommer zur Erstbehandlung von Jungvölkern (Ablegern), solange diese noch brutfrei sind; die Winterbehandlung mit Milchsäure ist möglich und sehr erfolgreich.[30] Ameisensäure wird auf verschiedene Weisen in die Völker eingebracht.
Neue Arzneimittel mit Ameisensäure ermöglichen auch erstmals eine Behandlung während der Tracht, bei der anschließend der Honig noch geerntet werden darf.
Die Bieneninstitute warnen allerdings derzeit vor diesem Einsatz, weil noch nicht ausreichende Erfahrungen mit der verbliebenen Menge von Säureresten im Honig vorliegen. MAQS (MiteAwayQuickStrips, Gel+Ameisensäure) wirkt gerade am ersten Tag exponentiell, was im Jahr 2014 zu Verlusten auch von Königinnen geführt hat[31]. Oxalsäure bringt man in der Regel im November oder Dezember in flüssiger Form in die Wabengassen der unteren Brutzarge ein. Diese drei Säuren oder ihre Salze kommen natürlicherweise im Stoffwechsel von Pflanzen und Tieren vor und sogar in manchen Honigsorten. Eine andere Methode beruht auf dem Einsatz von ätherischen Ölen mit Thymol.
Diese Mittel können allerdings nur in Zeiträumen ohne Brut eingesetzt werden, der Erfolg ist auch vom Dampfdruck der Substanz im Stock abhängig. Dafür kommt es weder zu Resistenzbildungen noch zu Rückständen im Honig.
Ein ganz neu erforschter Ansatz ist die Fütterung der Bienen mit Lithiumchlorid; dies verspricht eine Abtötung der aufsitzenden Milben ohne Schädigung der Bienen. Die Behandlung muss jedoch erst weiter erprobt werden, um Auswirkungen auf die Brut und Rückstände im Honig auszuschließen und die Dosierung zu bestimmen.[32]
Gegen die Varroose zugelassene Mittel in Österreich
In Österreich sind seit dem 11. Juli 2014 fünf Tierarzneimittel zugelassen:[33]
- AMO Varroxal – (85 % Ameisensäure-Lösung) zum Verdunsten im Bienenstock für Honigbienen
- Apiguard – (Thymol) Gel für Bienen (rezept- und apothekenpflichtig)
- APILIFE VAR – (Thymol u. a.) imprägnierte Streifen für den Bienenstock für Honigbienen
- Dany’s BienenWohl – (3,5 % (m/m) Oxalsäuredihydrat-Lösung) zum Träufeln für Honigbienen
- THYMOVAR – (Thymol) 15 g Streifen für den Bienenstock, für Honigbienen
- VarroaMed – (Ameisensäure 5 mg/ml, Oxalsäure-Dihydrat 44 mg/ml) zum Träufeln für Honigbienen
Gegen die Varroose zugelassene Mittel in Deutschland
In Deutschland sind elf Mittel zugelassen:[34]
- Perizin (Wirkstoff: Coumaphos)
- Bayvarol (Pyretroid), (Wirkstoff: Flumethrin)
- Apiguard (Thymol)
- Thymovar (Thymol)
- ApiLiveVar (Thymol u. a.)
- Milchsäure 15% ad us.vet.
- Ameisensäure 60% ad us.vet.
- MAQS = MiteAwayQuickStrips (Gel+Ameisensäure)
- Oxalsäurehydratlösung ad us.vet.
- Oxuvar ad us.vet. (Oxalsäure)
- Apitraz und Apivar (Amitraz) (verschreibungspflichtig)
Die Präparate auf Basis von Ameisensäure, Milchsäure und Thymol sind frei verkäuflich und benötigen keinen Eintrag ins Bestandsbuch. Alle anderen sind rezept- und apothekenpflichtig.
In einem Land der Europäischen Union (EU) muss bei Therapienotstand (Definition im AMG) vorrangig ein Mittel eingesetzt werden, das in einem EU-Land zugelassen ist. 85%ige Ameisensäure darf deshalb seit 11. Juli 2014 in Deutschland nur noch als "AMO Varroxal 85% Ameisensäurelösung" eingesetzt werden und nur noch, wenn sie bei Therapienotstand vom Tierarzt verschrieben wird und weil sie seit diesem Stichtag im EU-Land Österreich (dort frei verkäuflich) als "Varroxal" zugelassen ist.
Gegen die Varroose zugelassene Mittel in Frankreich
In Frankreich sind 2016 sieben Mittel zugelassen (disposants d'une A.M.M.):
Biologische Bekämpfungsmethoden

Auf beiden Seiten befinden sich insgesamt etwa 1300 verdeckelte Drohnenzellen. Dazwischen befinden sich noch einige wenige unverdeckelte Zellen.
Die Drohnenbrut wird etwa 5- bis 10-mal häufiger als die Arbeiterbienenbrut von der Varroa-Milbe befallen, die Milben können sich durch die längere Brutzeit außerdem zahlreicher vermehren. Dies nutzen die Imker bei der Varroabekämpfung durch den Einsatz von sogenannten Drohnenrahmen. Während der Wachstumsphase des Bienenvolkes (Frühjahr bis Frühsommer) werden in die unterste Brutzarge einer Magazinbeute leere Rähmchen eingehängt, die von den Bienen vorzugsweise mit größeren Zellen ausgebaut werden, in denen sich nach der Eiablage durch die Königin Drohnenlarven entwickeln. Die bereits verdeckelte Drohnenbrut wird dann kurz vor dem Schlüpfen mitsamt den darin befindlichen Milben entfernt oder hypothermisch behandelt (eingefroren). Durch die Entnahme bzw. die gezielte hypothermische Behandlung von Drohnenbrut kann der Befall deutlich reduziert, aber nicht verhindert werden.[35] Ein negativer Nebeneffekt der systematischen Drohnenbrutentnahme besteht in einer Begünstigung, also einer Auslese, jener Milben, welche die Arbeiterinnenbrut aufsuchen.[36]
Die hyperthermische Behandlung nach Engels und Rosenkranz[37] ist eine gift- und säurefreie Methode zur Bekämpfung der Varroamilbe. Hier wird die Erkenntnis genutzt, dass Varroamilben, im Gegensatz zu Bienenpuppen, nicht so resistent gegen erhöhte Temperaturen sind. Bei der Behandlung wird die verdeckelte Bienenbrut gezielt überwärmt. Die exakte Einhaltung der Temperatur, eine langsame Erwärmung und Gewährleistung der relativen Luftfeuchtigkeit sind für den Erfolg der Behandlung entscheidend.[38]
Eine weitere gift- und säurefreie Methode ist das recht neue Fangwabenverfahren nach Woköck/Bojaschewsky.[39] Diese Methode ist arbeitsaufwändiger, jedoch ist eine Resistenzbildung der Milben ausgeschlossen, während durch natürliche Selektion die Fortpflanzungsfähigkeit der Milben eingeschränkt wird.
Zurzeit werden Möglichkeiten erforscht, den Bücherskorpion (Chelifer cancroides) und andere Pseudoskorpion-Arten zur Bekämpfung der Varroamilbe in Bienenbeuten einzusetzen.[40] Dabei wurde durch Beobachtungen bestätigt, dass Pseudoskorpione die Milben als Beute angreifen. Eine neuseeländische Arbeitsgruppe hat eine Methode entwickelt, mittels PCR einen Verzehr der Milbe durch den Skorpion auch dann nachzuweisen, wenn der Vorgang nicht direkt beobachtet wurde.[41] Die bisherigen umstrittenen[42][43][44] Experimente zur Ansiedlung von Chelifer und anderen Pseudoskorpionen in kommerziellen, behandelten Beuten zur Kontrolle von Varroa erbrachten allerdings bisher (Stand: 2016) negative Resultate.[45]
Beim Mullerbrett wird die Beute zweigeteilt. Auf die bestehende Beute wird erneut eine weitere Beute aufgesetzt. Dazwischen das Mullerbrett. Dieses besteht aus einem Rahmen, auf dem oben ein bienendichtes, und unten ein milbendichtes Gitter angebracht ist. Dann werden die bebrüteten Rämchen von der unteren Beute, ohne der Königin, auf die obere Beute gebracht. Flugbienen kehren jetzt nach unten zurück und pflegen ein neues Brutnest, die Ammenbienen bleiben oben bei der Brut. Varroamilben befinden sich nun großteils oben. Wenn die Bienen nun schlüpfen, suchen die Milben nach Brut kurz vor Verdeckelung (5 Tage), versuchen also in die untere Beute zu gelangen, bleiben jedoch beim Mullerbrett hängen und verhungern.[46]
Siehe auch
Literatur
- Arbeitsgemeinschaft der Institute für Bienenforschung e.V.: Varroa unter Kontrolle. Wie wird's gemacht? 2., überarbeitete Auflage. Deutscher Landwirtschaftsverlag GmbH, Berlin 2007.
- Gerhard Liebig: Einfach imkern. Leitfaden zum Bienen halten. 3. überarbeitete Auflage, Eigenverlag, Bochum 2011, ISBN 978-3-980356-86-2
- Jens Radtke: Einfluss der Brutentnahme bei der Honigbiene auf ihre Leistung und Varroa-Parasitierung. Verlag Dr. Köster, Berlin 2012, ISBN 978-3-89574-788-5.
- Alois Wallner: Varroa-resistent. Meine Methode der Auslese und Züchtung varroa-resistenter Bienenvölker. Eigenverlag, Randegg/NÖ 1994.
- Johannes Weiß: Mit Milchsäure gegen die Varroamilbe. In: Allgemeine Deutsche Imkerzeitung. Bd. 21, Nr. 8, 1987, S. 258–262.
- Johannes Weiß: Menge und Konzentration der Milchsäure bei der Behandlung von Bienenvölkern. In: Allgemeine Deutsche Imkerzeitung. Bd. 26, Nr. 6, 1992, S. 14–15.
Einzelnachweise
- Diana Sammataro, Uri Gerson, Glen Needham: Parasitic mites of honey bees: Life history, implications, and impact. In: Annual Review of Entomology. Bd. 45, 2000, S. 519–548, doi:10.1146/annurev.ento.45.1.519.
- A. C. Oudemans: Acarologische Aanteekeningen XIII. In: Entomologische Berichten., Bd. 1, 1904, S. 169–174.
- Friedrich Ruttner, Heinz Hänel: Active defense against Varroa mites in a Carniolan strain of honeybee (Apis mellifera carnica Pollmann). In: Apidologie. Bd. 23, Nr. 2, 1992, S. 173–187, Digitalisat (PDF; 2,37 MB).
- Peter Rosenkranz, Pia Aumeier, Bettina Ziegelmann: Biology and control of Varroa destructor. In: Journal of Invertebrate Pathology. Bd. 103, Supplement, 2010, S. S96–S119, doi:10.1016/j.jip.2009.07.016.
- M. D. Definado, E. W. Baker: Varroidae, a new family of mites on honey bees (Mesostigmata; Acarina). In: Journal of the Washington Academy of Sciences. Bd. 64, Nr. 1, 1974, ISSN 0043-0439, S. 4–10, Digitalisat.
- G. Donzè, M. Herrmann, B. Bachofen, P.R.M. Guerin (1996): Effect of mating frequency and brood cell infestation rate on the reproductive success of the honeybee parasite Varroa jacobsoni. In: Ecological Entomology 21: 17–26. doi:10.1111/j.1365-2311.1996.tb00261.x
- Denis L. Anderson, John W. H. Trueman: Varroa jacobsoni (Acari: Varroidae) is more than one species. In: Experimental & Applied Acarology. Bd. 24, Nr. 3, 2000, S. 165–189, doi:10.1023/A:1006456720416.
- Lilia I. de Guzman, Thomas E. Rinderer: Identification and comparison of Varroa species infesting honey bees. In: Apidologie. Bd. 30, Nr. 2/3, 1999, S. 85–95, doi:10.1051/apido:19990201.
- Michel Solignac, Jean-Marie Cornuet, Dominique Vautrin, Yves Le Conte, Denis Anderson, Jay Evans, Sandrine Cros-Arteil, Maria Navajas: The invasive Korea and Japan types of Varroa destructor, ectoparasitic mites of the Western honeybee (Apis mellifera), are two partly isolated clones. In: Proceedings of the Royal Society of London. Series B: Biological Sciences. Bd. 272, Nr. 1561, 2005, S. 411–419, doi:10.1098/rspb.2004.2853.
- Elke Genersch: Honey bee pathology: current threats to honey bees and beekeeping. In: Applied Microbiology and Biotechnology. Bd. 87, Nr. 1, 2010, S. 87–97, doi:10.1007/s00253-010-2573-8.
- Friedrich Ruttner, Wolfgang Ritter: Das Eindringen von Varroa jacobsoni nach Europa im Rückblick. In: Allgemeine Deutsche Imkerzeitung. Bd. 14, Nr. 5, 1980, S. 130–134.
- Ramsey SD, Ochoa R, Bauchan G, Gulbronson C, Mowery JD, Cohen A, Lim D, Joklik J, Cicero JM, Ellis JD, Hawthorne D, vanEngelsdorp D: Varroa destructor feeds primarily on honey bee fat body tissue and not hemolymph. In: Proceedings of the National Academy of Sciences USA Bd. 116, Nr. 5, 2019, S. 1792–1801, doi: 10.1073/pnas.1818371116.
- Elke Genersch, Werner von der Ohe, Hannes Kaatz, Annette Schroeder, Christoph Otten, Ralph Büchler, Stefan Berg, Wolfgang Ritter, Werner Mühlen, Sebastian Gisder, Marina Meixner, Gerhard Liebig, Peter Rosenkranz: The German bee monitoring project: a long term study to understand periodically high winter losses of honey bee colonies. In: Apidologie. Bd. 41, Nr. 3, 2010, S. 332–352, doi:10.1051/apido/2010014.
- Hauptursache für das große Bienensterben gefunden. In: Welt Online, vom 24. März 2011.
- Richard Friebe: Volk der Bienen, quo vadis? In: faz.net, vom 6. April 2011.
- Lars Straub, Geoffrey R. Williams, Beatriz Vidondo, Kitiphong Khongphinitbunjong, Gina Retschnig, Annette Schneeberger, Panuwan Chantawannakul, Vincent Dietemann, Peter Neumann: Neonicotinoids and ectoparasitic mites synergistically impact honeybees. In: Scientific Reports. 9, 2019, doi:10.1038/s41598-019-44207-1.
- Peter Rosenkranz: Honey bee (Apis mellifera L.) tolerance to Varroa jacobsoni Oud. in South America. In: Apidologie. Bd. 30, Nr. 2/3, 1999, S. 159–172, doi:10.1051/apido:19990206.
- Die Dunkle Biene - Die Sizilianische Biene, auf: nordbiene.de
- Wo varroatolerante Völker entstehen, auf: mellifera.de
- Apis mellifera sicula, auf: imkerpedia.nl (niederländisch)
- Barbara Locke: Host-parasite adaptations and interactions between honey bees, varroa mites and viruses (= Acta Universitatis Agriculturae Sueciae. 57). Swedish University of Agricultural Sciences – Department of Ecology, Uppsala 2012, ISBN 978-91-576-7704-4 (Doctoral Thesis; online).
- Varroa resistance – Natural behavior to withstand varroa, auf: Arista Bee Research (aristabeeresearch.org)
- A Sustainable Approach to Controlling Honey Bee Diseases and Varroa Mites. SARE. Abgerufen am 13. Juli 2020.
- Victoria Gill: Genetic weapon developed against honeybee-killer. In: BBC News, 22. Dezember 2010. Abgerufen am 13. Juli 2020.
- author=Greg Hunt, J. Krispn Given, Jennifer M. Tsuruda, Gladys K. Andino: Breeding Mite-Biting Bees to Control Varroa. 23. März 2016. Abgerufen am 23. Februar 2018.
Greg Hunt, J. Krispn Given, Jennifer M. Tsuruda, Gladys K. Andino: Breeding Mite-Biting Bees to Control Varroa. Bee Culture. April 2016. (PDF) - Nadja Podbregar: Honigbienen: Mit gezielter Zucht gegen die Varroamilbe, auf: natur.de vom 10. Juli 2020, Quelle: Julius-Maximilians-Universität Würzburg
- Toleranzzucht in der Bienenstation, Julius-Maximilians-Universität Würzburg, Lehrstuhl für Verhaltensphysiologie und Soziobiologie vom 7. Juli 2020
- Edlinger Varroaindikator
- ADIZ 08/2011 S. 7–9.
- ADIZ 1987 und Imkerfreund 1991 S. 19–22.
- Wirkungsweisen der Ameisensäure
- Pressemitteilung der Universität Hohenheim vom 12. Januar 2018
- Österreichische Agentur für Gesundheit und Ernährungssicherheit GmbH: Varroabekämpfung (Memento des Originals vom 25. März 2016 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis., 2. Aufl. 2015, abgerufen am 24. März 2016
- Bayerische Landesanstalt für Weinbau und Gartenbau: Zugelassene Varroa-Bekämpfungsmittel, (Stand 30. Juni 2014)
- Varroa unter Kontrolle. (PDF) Arbeitsgemeinschaft der Institute für Bienenforschung e.V., 2007, S. 8, abgerufen am 28. März 2015 (Deutscher Landwirtschaftsverlag GmbH, Berlin; Biotechnische Bekämpfungsverfahren).
- J. Weiß, Vortrag im Pamina-Gymnasium Herxheim am 7. Oktober 2014
- Wolfgang Wimmer: Praxishandbuch der thermischen Varroa-Bekämpfung. 2. Auflage. Ecodesign Company, Wien 2015, ISBN 978-3-200-03995-7.
- Olga Cadosch: Wie wirkt die Hyperthermie? In: Schweizerische Bienen-Zeitung. Bd. 137, Nr. 5, 2014, S. 16–17, Digitalisat (PDF; 1,23 MB) (Memento des Originals vom 6. April 2015 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis..
- Hans-Diethelm Woköck, Manfred Bojaschewsky: Das Fangwabenverfahren zur Behandlung der Varoatose. online (Memento vom 22. Februar 2013 im Webarchiv archive.today).
- Das Beenature-Project. Torben Schiffer, Otto-Hahn-Schule, Hamburg
- Ron F. van Toor, Shirley E. Thompson, Donna M. Gibson, Grant R. Smith (2015): Ingestion of Varroa destructor by pseudoscorpions in honey bee hives confirmed by PCR analysis. Journal of Apicultural Research 54 (5), online before print. doi:10.1080/00218839.2016.1184845
- Torben Schiffer: Beekeeping-rEvolution. Ein Projekt zur Wiederanerkennung der Honigbiene als Wildtier. In: beekeeping-revolution.com. BeeNature-Save the Bees, Verein zur Rettung der Honigbienen e. V., abgerufen am 14. Juli 2021.
- Torben Schiffer: Evolution der Bienenhaltung: Artenschutz für Honigbienen. Bienen besser verstehen. Verlag Eugen Ulmer, Stuttgart 2020, ISBN 978-3-8186-0924-5.
- Torben Schiffer: Der wahre Preis des Honigs – Artenschutz für Honigbienen! In: Imkern heute. Das Fachmagazin für Bienenzucht-Wirtschaft und Forschung. Ausgabe 9, Herbst/Winter 2020. WV Buch-Kunst-Musik Verlag, 4. Dezember 2020, ZDB-ID 2964915-8, S. 36–54 (beenature-project.com [PDF; 992 kB; abgerufen am 14. Juli 2021]).
- Ron van Toor, James Pinfold: Can chelifers be made to control varroa mites in beehives? Poster Presentation, 2016 New Zealand Apiculture Conference, Rotorua. PDF
- Christian Schmid, Meine Erfahrung mit dem Muller – Brett