Industrielle Biotechnologie
Die industrielle Biotechnologie, auch weiße Biotechnologie genannt, ist der Bereich der Biotechnologie, der biotechnologische Methoden für industrielle Produktionsverfahren einsetzt. Die Bezeichnung „weiße Biotechnologie“ grenzt die industrielle Biotechnologie von der „grünen“ und der „roten“ Biotechnologie ab, die sich mit Pflanzen und Medizinprodukten befassen, jedoch gibt es mit beiden Bereichen Überschneidungen.

Die industrielle Biotechnologie überträgt biologische und biochemische Kenntnisse und Prozesse durch die Bioverfahrenstechnik in technische Anwendungen. Dabei kommen zum Beispiel Bakterien wie Escherichia coli und Corynebacterium glutamicum, Hefen und Enzyme zum Einsatz.
Definition
Als Biotechnologie wird die Anwendung von Kenntnissen und Prozessen der Biologie und Biochemie in technischen Verfahren bezeichnet, während die Rote Biotechnologie bzw. die Grüne Biotechnologie sich mit Anwendungen im medizinischen und pharmazeutischen bzw. im landwirtschaftlichen und pflanzlichen Bereich befassen. Darüber hinaus wird auch gelegentlich von Blauer Biotechnologie und Grauer Biotechnologie in Bezug auf Lebewesen aus dem Meer bzw. auf biotechnologische Verfahren zur Aufbereitung von Trinkwasser, Reinigung von Abwasser, Sanierung kontaminierter Böden und zur Müllverarbeitung gesprochen.
Die Bezeichnung „industrielle Biotechnologie“ wird unterschiedlich definiert:
- Die europäische Industrievereinigung EuropaBio zählt zum Beispiel die biotechnologische Herstellung von Spezialchemikalien und Feinchemikalien, Lebensmitteln und Lebensmittelzusatzstoffen, Agrar- und Pharmavorprodukten und zahlreichen Hilfsstoffen für die verarbeitende Industrie zur industriellen Biotechnologie.[1]
- Die Fraunhofer-Gesellschaft definiert industrielle Biotechnologie als „die industrielle Produktion von organischen Grund- und Feinchemikalien sowie Wirkstoffen mithilfe optimierter Enzyme, Zellen oder Mikroorganismen“.
- Die OECD unterscheidet zwei Schwerpunkte:
- Ersatz endlicher fossiler Brennstoffe durch nachwachsende Ausgangsstoffe, also Biomasse
- Ersatz konventioneller industrieller Prozesse durch biologische Prozesse, die den Energiebedarf und den Rohstoffeinsatz senken sowie die Anzahl der Prozessstufen reduzieren und damit Kosten senken sowie gleichzeitig ökologische Vorteile schaffen.
Geschichte
Die Bezeichnung industrielle Biotechnologie ist relativ jung, aber einige Methoden, die dieser Biotechnologie zugeordnet werden, werden seit Jahrtausenden von der Menschheit genutzt. Dies geschah lange vor der Entdeckung der Mikroorganismen oder gar dem Verständnis der zugrunde liegenden Prozesse. In zahlreichen Kulturen wurde zum Beispiel
- die Vergärung zuckerhaltiger Nahrungsmittel zu Alkohol (Ethanolgärung) mit Hilfe von Hefen,
- die Milchsäuregärung unter Verwendung von Lactobacillus-Stämme oder
- die Essigsäureherstellung mit Hilfe von Acetobacter-Spezies
angewendet.
Louis Pasteur entdeckte 1856 in verunreinigten Weinfässern Mikroorganismen, die er nach ihrer Form mit dem griechischen Wort für Stäbchen Bacterion benannte. Die entdeckten Milchsäurebakterien produzierten aus Zucker durch Gärung Milchsäure, während in den Weinfässern Hefepilze den Zucker zu Alkohol vergären sollten. Pasteur legte mit diesen Entdeckungen die Grundlage für das Verständnis von Fermentation bzw. Gärung und begründete die moderne Mikrobiologie.
2012 arbeiteten von den 565 Biotech-Unternehmen in Deutschland 61 (rund 11 %) hauptsächlich auf dem Gebiet der industriellen Biotechnologie. Viele Unternehmen der chemischen Industrie setzen ihre Methoden ein, wurden bei dieser Umfrage aber nicht erfasst, so dass die Bedeutung deutlich größer sein dürfte.[2]
Durch Fortschritte in der Entwicklung biotechnologischer Methoden und Anwendungen hat die industrielle Biotechnologie in den vergangenen Jahren an Bedeutung gewonnen. Potential wird vor allem in diesen Bereichen erwartet:[2]
- Optimierung von Produktionsverfahren, zum Beispiel für Grundchemikalien und Feinchemikalien
- Reduzierung der Rohstoffabhängigkeit, zum Beispiel durch Nutzung nachwachsender Rohstoffe
- Reduzierung der Energie- und Entsorgungskosten, zum Beispiel durch Ersetzen chemischer Verfahren
- Entwicklung neuer Produkte und Systemlösungen mit hohem Wertschöpfungspotenzial, zum Beispiel durch Nutzbarmachung von biologischen Stoffwechselwegen mit gentechnischen Methoden
Methoden
In der industriellen Biotechnologie werden, wie in den anderen Biotechnologien, verschiedene Möglichkeiten der Biokonversion eingesetzt, wie zum Beispiel das Gewinnen von bestimmten Produkten des Stoffwechsels, sei es aus Katabolismus oder Anabolismus.
Die Auswahl eines in der biotechnologischen Anwendung eingesetzten Organismus kann zum Beispiel erfolgen, weil er bereits die Fähigkeit zur entsprechenden Biokonversion besitzt. Durch Zucht, Mutation und Selektion mit konventionellen, nicht-gentechnischen Methoden kann die Ausbeute gesteigert werden. In biotechnologischen Anwendungen eingesetzte Enzyme für die Biokonversion wurden, bevor gentechnische Methoden verfügbar waren, meist aus bestimmten Organismen oder Organen gewonnen, wie zum Beispiel Lab aus Kälbermägen.
.svg.png.webp)
Durch die Entwicklung gentechnischer Methoden stehen der industriellen Biotechnologie deutlich erweiterte Möglichkeiten zur Verfügung. So können bereits eingesetzte Organismen, zum Beispiel durch gerichtete Evolution oder Metabolic Engineering, so optimiert werden, dass sie höhere Ausbeuten liefern.[3] Eine weitere Option ist, bisher nicht mögliche Biokonversionen für den industriellen Einsatz verfügbar zu machen. Ein Hindernis war zum Beispiel, dass viele Organismen sich für den Einsatz in der industriellen Biotechnologie nicht eigneten, zum Beispiel weil sie nicht oder zu schlecht in Bioreaktoren kultiviert werden konnten. Mit gentechnischen Methoden kann es möglich sein, ein benötigtes Gen oder mehrere in eine gut kultivierbare Art zu übertragen. Das letztlich interessierende Produkt kann zum Beispiel die chemische Verbindung sein, die von dem Enzym gebildet wird, das durch dieses Gen codiert wird. Aber auch das Enzym selbst kann das gewünschte Produkt sein. Ein bekanntes Beispiel ist die Herstellung des Peptidhormons Insulin mit Bakterien, was die Gewinnung des Insulins aus Schweinebauchspeicheldrüsen ablöste.[3] Werden gentechnische Methoden eingesetzt, müssen bei der Entwicklung und Produktion Sicherheitsmaßnahmen beachtet werden, die in Deutschland durch das Gentechnikgesetz festgelegt und durch die Gentechnik-Sicherheitsverordnung näher ausgeführt sind. So erfolgt das Arbeiten im Labor- oder Produktionsbereich unter einer bestimmten Sicherheitsstufe (S1 bis S4).
Ein neuer Ansatz ist die Analyse von Metagenomen, der Gesamtheit der Gene aller Arten zum Beispiel in einem Biotop. Üblicherweise können bislang nur Gene bzw. Enzyme für die Biotechnologie nutzbar gemacht werden, die aus Organismen stammen, die unter Laborbedingungen kultivierbar sind. Mit neueren molekularbiologischen Methoden hofft man nun, gezielt bestimmte Gene bzw. Enzyme identifizieren zu können, die für biotechnologische Anwendungen interessant sein könnten.[3]
Anwendungsgebiete
Die Anwendungsmöglichkeiten für industrielle biotechnologische Methoden sind sehr vielfältig. Im Folgenden wird eine Auswahl von Beispielen aufgeführt.
Substitution fossiler Energieträger

Bioethanol, Biogas und Biowasserstoff können aus Biomasse gewonnen werden.
- Bioethanol: Aus zucker- und stärkehaltigen Rohstoffen wie Zuckerrüben, Maiskorn, Getreidekorn oder bestimmten organische Abfälle kann durch Gärung Ethanol erzeugt werden. Auch der bislang schwer zu erschließende Vielfachzucker Cellulose kann enzymatisch erschlossen werden und zur Herstellung von sogenanntem Cellulose-Ethanol dienen.
- Biogas: Durch anaeroben Abbau von Biomasse einschließlich einer Methanfermentation wird in Biogasanlagen Biogas erzeugt.
- Biowasserstoff: Wasserstoff kann durch mikrobiologische Fermentationsprozesse aus organischem Material oder durch abgewandelte photosynthetische Prozesse mit Algen in Photobioreaktoren gewonnen werden.
Antibiotika
Antibiotika dienen der Behandlung von Infektionskrankheiten und zählen zu den am häufigsten verschriebenen Medikamenten. Ein bekanntes Beispiel für ein Breitbandantibiotikum ist das Cephalosporin. Es gehört, wie das Penicillin, zu den β-Lactam-Antibiotika und wird aus dem Hauptausgangsstoff 7-Amino-Cephalosporansäure abgeleitet. Bei der Produktion mit einem biotechnologischen Verfahren sind Zimmertemperatur, Wasser als Lösungsmittel und keine großen Mengen toxischer Stoffe oder Schwermetalle notwendig. Das Abwasser kann danach im Wesentlichen biologisch gereinigt werden.
Nahrungsmittelzusätze
Zunehmend wird versucht, den Nährwert von bestimmten Nahrungsmitteln, genannt Functional Food, zu erhöhen, indem bestimmte Verbindungen zugesetzt werden, die ansonsten nicht oder in nur geringer Menge vorhanden sind.
Vitamine
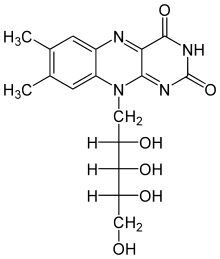
Vitamine werden vom Körper für lebenswichtige Funktionen benötigt und müssen mit der Nahrung oder bei Mangelernährung über Nahrungsergänzungsmittel aufgenommen werden. Noch in den 1990er Jahren wurde beispielsweise Vitamin B2 durch ein chemisches Verfahren in einem achtstufigen Syntheseprozess hergestellt. Heute wird mit einer einstufigen Fermentation ein biotechnologisches Verfahren angewendet. Dadurch konnten bis 2008 40 % der Kosten, 60 % der Rohstoffe, 30 % der CO2-Emissionen und 95 % der Abfälle eingespart bzw. vermieden werden.[4]
Aminosäuren
Mehrere Aminosäuren werden heute in großtechnischem Maßstab in biotechnologischen Verfahren hergestellt. Eine große Bedeutung hat L-Lysin. Für viele Nutztiere ist es eine essenzielle Aminosäure und in verbreiteten Futtermitteln wie Sojamehl in geringer Konzentration vorhanden. Jährlich werden rund 1,5 Mio. t als Futtermittelzusatz in der Geflügelproduktion und der Schweinemast eingesetzt. Bei der fermentativen Herstellung mit Bakterien wird als Rohstoff vor allem Zucker eingesetzt.
Ende der 1980er Jahre stellte die Firma Shōwa Denkō mithilfe transgener Bakterien die Aminosäure Tryptophan her, wodurch gleichzeitig versehentlich ein unerwünschtes Toxin produziert wurde, an dem 37 Menschen starben (sogenanntes Eosinophilie-Myalgie-Syndrom).[5]
Enzyme
Die Verwendung biotechnologisch hergestellter Enzyme in der Medizin ist vielfältig: Enzyme werden in Therapie und Diagnose eingesetzt. Erst mit den Fortschritten der biotechnologischen Forschung der vergangenen Jahrzehnte hat sich das ökonomische Potenzial therapeutischer Enzyme entwickeln können. Durch die Verfahren der industriellen Biotechnologie können Enzyme preisgünstig sowie mit hoher Leistungsfähigkeit und Selektivität hergestellt werden. Die so genannten therapeutischen Enzyme werden direkt als Medikamente verwendet (z. B. Lipasen, Lysozym, Thrombin und andere).
In der Lebensmittelindustrie werden mehr als 40 Enzyme in zahlreichen Produktionsprozessen eingesetzt. Enzyme modifizieren Stärke (Modifizierte Stärke), optimieren Fette und Eiweiße, sie stabilisieren aufgeschlagene Schäume und Cremes und verbinden zusammengefügte Fleischteile zu Formfleisch. Enzyme sorgen für die Bissfestigkeit von Cornflakes, die Gefrier-Tau-Stabilität eines Fertigteiges, die gleichmäßige Qualität von Eiswaffeln und verhindern das Kleben von Nudeln nach dem Kochen. Enzyme konservieren Mayonnaise und Eiprodukte, steuern die Reifung von fermentierten Lebensmitteln und Getränken, sie ermöglichen intensivere Aromen, spalten aus Butter-, Käse- oder Rahmaromen Fettsäuren ab oder bilden aus Eiweißen Würze oder Bratengeschmack.
Enzyme in Wasch- und Reinigungsmitteln
Waschmittel enthalten bestimmte Enzyme, zum Beispiel Lipasen, Proteasen, Amylasen, die helfen, Verschmutzungen mit Fetten, Proteinen (zum Beispiel Blut, Eigelb) und Stärke durch Zerlegung in wasserlösliche Bestandteile zu entfernen. Die dadurch verbesserte Waschwirkung erlaubt das Herabsetzen der Waschtemperaturen und Waschdauer und eine Verringerung des Wasser-, Waschmittel- und Energieverbrauchs gegenüber enzymfreien Waschmitteln.
Zunächst erfolgte die biotechnologische Herstellung der Enzyme mit nicht gentechnisch veränderten Mikroorganismen, die durch Selektion optimiert worden waren. Seit den 1980er Jahren wird Gentechnik eingesetzt, um höhere Ausbeuten zu erzielen und weitere Enzyme nutzbar zu machen.[6]
Hormone
Die Zuführung von Hormonen ist in der Medizin bei verschiedenen Krankheiten erforderlich, zum Beispiel bei Wachstums- oder Wechseljahresbeschwerden und in der Krebstherapie.
Die schmerz- und entzündungslindernde Wirkung des Steroidhormons machte beispielsweise Cortison als Medikament interessant. Die aufwändige chemische Synthese in 37 Schritten wurde durch die ökonomischere biotechnologische Herstellung in 11 Schritten ersetzt. Unter anderem wurde die Stoffwechselleistung des Pilzes Rhizopus arrhizus verwendet. Mit Hilfe weiterer biotechnologischer Prozesse konnte darüber hinaus der Ausgangsstoff für die Cortison-Synthese, Diosgenin, der aus der mexikanischen Yams-Wurzel gewonnen wurde, ersetzt werden.
Textilindustrie
Zum Bleichen von Textilien wird in der Textilindustrie Wasserstoffperoxid (H2O2) genutzt. Wasserstoffperoxid ist ein starkes Oxidationsmittel, das nach dem Bleichprozess wieder vollständig aus dem Textilmaterial entfernt werden muss. Im konventionellen Verfahren wird Wasserstoffperoxid durch zweistündiges Spülen mit heißem Wasser (80–95 °C) beseitigt. Trotz hohem Verbrauch an Wasser und Energie gelingt jedoch eine vollständige Entfernung des Bleichmittels erst durch Nachbehandlung mit verschiedenen Chemikalien. In dem biotechnologischen Verfahren wurde zur Entfernung des Bleichmittels ein enzymatischer Prozess entwickelt. Hierbei wird zur Nachbehandlung der Textilien das Enzym Katalase eingesetzt. Dieses Enzym baut das Wasserstoffperoxid innerhalb von wenigen Minuten bei 30–40 °C zu Wasser und Sauerstoff um. Statt zweier Spülzyklen muss zur Entfernung des Bleichmittels nur noch ein Spülschritt mit warmem Wasser durchgeführt werden.
Biopestizide
Der weltweite Markt für Bio-Pestizide, wie zum Beispiel für Mittel zur Unkrautbekämpfung mit Mikroorganismen oder deren Produkten, wächst stark.
Ein Beispiel für Biopestizide ist die Produktion des Toxins des Bodenbakteriums Bacillus thuringiensis. Das so genannte Bt-Toxin, ein Protein, ist auch für einige Insekten giftig. Dieses Eiweiß wird wie Bier gebraut und kann – auch im Bio-Landbau – versprüht werden. In einigen gentechnisch veränderten Organismen, zum Beispiel im Bt-Mais, wird das Toxin in den Pflanzenzellen gebildet, nachdem das protein-codierende Gen integriert wurde.
Biokunststoffe

Die biotechnologische Herstellung von Monomeren für die Kunststoff- und Polymer-Herstellung ist ein weiteres Feld biotechnologischer Verfahren. An der Entwicklung zum Beispiel von biologisch abbaubaren Polymeren wird seit vielen Jahren intensiv geforscht. Erste Anwendungen sind auf dem Markt. Aber auch nicht biologisch abbaubare bio-basierte Kunststoffe werden entwickelt. Durch diese biotechnologische Verfahren werden petrochemische Verfahren zur Herstellung bestimmter Polymere ersetzt oder neue Polymere mit neuen Eigenschaften entwickelt. Bekannte Beispiele sind Polymilchsäure (Polylactid, PLA), Polyamide[7] und Polyhydroxyalkanoate wie zum Beispiel Polyhydroxybutyrat (PHB).
Ausblick
Die industrielle Biotechnologie gehört zu den sogenannten Schlüsseltechnologien. Es ist davon auszugehen, dass durch gezielte Nutzung von Mikroorganismen und deren biotechnologische Verbesserung sehr viele industrielle Prozesse kostengünstiger (weniger Prozessstufen, weniger Material- und Energieeinsatz) und ökologischer (weniger sowie umweltverträglichere Reststoffe und Emissionen) gestaltet werden können, und es werden nachwachsende Rohstoffe für die industrielle Nutzung erschlossen.
Literatur
- Bundesministerium für Bildung und Forschung: Weiße Biotechnologie – Chancen für neue Produkte und umweltschonende Prozesse. (Volltext, PDF; 2,24 MB). 2007.
- Garabed Antranikian: Angewandte Mikrobiologie. 1. Auflage. Springer-Verlag, Berlin/ Heidelberg 2006, ISBN 3-540-24083-7.
- K. Köchy, A. Hümpel (Hrsg.): Synthetische Biologie. Entwicklung einer neuen Ingenieurbiologie? Dornburg, 2012, ISBN 978-3-940647-07-8. (Download Kurzfassung als PDF)
Siehe auch
Weblinks
- Portal Biotechnologie des Bundesministeriums für Bildung und Forschung inklusive einer Definition von Biotechnologie und Weißer Biotechnologie
- BioIndustrie 2021 Clusterwettbewerb des Bundesministeriums für Bildung und Forschung
- European Association for Bioindustries
- Institut für Bioverfahrenstechnik, TU Braunschweig
Einzelnachweise
- Industrielle Biotechnologie. Hinweise auf der Informationsseite zum Studiengang Industrielle Biotechnologie der Hochschule Ansbach
- Umfrage der Informationsplattform biotechnologie.de (Memento vom 30. August 2013 im Internet Archive) im Auftrag des Bundesministeriums für Bildung und Forschung (BMBF)
- Garabed Antranikian: Angewandte Mikrobiologie. 1. Auflage. Springer-Verlag, Berlin/ Heidelberg 2006, ISBN 3-540-24083-7.
- Presseinformation des Verbandes der Chemischen Industrie (VCI) Biotechnologie - Eine Zukunftstechnologie eröffnet neue Wege. Rede vom 18. September 2008, Blatt 15
- Jeffrey M. Smith: Trojanische Saaten. Riemann 2004, ISBN 3-570-50060-8. Kapitel 4: Über das von Showa Denko auf gentechnischem Weg hergestellte L-Tryptophan, das das Eosinophilie-Myalgie-Syndrom auslöste, an dem 37 Menschen starben und über 1500 erkrankten.
- Informationen der Henkel AG Energie sparen durch biotechnisch hergestellte Enzyme. Abgerufen am 1. Januar 2010.
- Biopolymere/Biowerkstoffe: Biobasierte Polyamide durch Fermentation. auf der Seite des Instituts für Bioverfahrenstechnik der Technischen Universität Braunschweig