Micrococcus antarcticus
Micrococcus antarcticus ist ein grampositives Bakterium, das 2000 in der Antarktis entdeckt wurde. Es handelt sich um einen psychrophilen Organismus, der sich bei niedrigen Temperaturen vermehren kann. Er wächst aerob, also nur, wenn Sauerstoff zur Verfügung steht. Seine Anpassung an die Kälte ist Gegenstand der Forschung, beispielsweise welche Fettsäuren in den Lipiden der Zellmembran vorhanden sind.
| Micrococcus antarcticus | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Micrococcus antarcticus | ||||||||||||
| Liu et al. 2000 |
Merkmale
Erscheinungsbild
Die Zellen von Micrococcus antarcticus sind rund, es handelt sich um Kokken. Im lichtmikroskopischen Bild lassen sich Diplokokken und die unter anderem auch für Micrococcus luteus typischen Tetraden[1] erkennen. Eine einzelne Zelle hat einen Durchmesser von etwa 0,5–0,8 µm.[2] In der Gramfärbung verhält sich M. antarcticus grampositiv, er wird also durch die verwendeten Farbstoffe blau angefärbt. Verursacht wird dies durch eine dickere Mureinschicht in der Zellwand. Er besitzt keine Flagellen zur aktiven Bewegung und kann keine Überdauerungsformen wie Endosporen bilden. Auf festen Nährböden wachsen die Zellen zu gelben Kolonien heran. Diese sehen schleimig aus, haben aber eine klare Begrenzung.[2]
Wachstum und Stoffwechsel
Micrococcus antarcticus ist strikt aerob, er benötigt Sauerstoff zum Wachsen. Er verhält sich positiv im Katalase- und Oxidase-Test. Die zur Kultivierung optimalen Temperaturen liegen im Bereich von 15 bis 17 °C, Wachstum findet auch noch bei 0 °C statt, er gehört zu den psychrophilen („kälteliebenden“) Organismen. Oberhalb von 25 °C findet keine Vermehrung statt. M. antarcticus lässt sich gut auf einem Nährmedium kultivieren, das Pepton, Hefeextrakt und Glucose enthält. Der optimale pH-Wert für das Wachstum liegt bei dem neutralen Wert pH 7,0.[2]
Wie bei Micrococcus-Arten üblich, ist der Stoffwechsel von M. antarcticus als aerob zu charakterisieren: Er gewinnt seine Energie durch Atmung und nutzt dabei Sauerstoff als Oxidationsmittel. Weiterhin ist sein Stoffwechsel als chemoorganotroph und heterotroph zu kennzeichnen, er ist auf organische Verbindungen als Energiequelle und ebenso zum Aufbau zelleigener Stoffe angewiesen. Als Substrat kann er auf diesem Weg z. B. Kohlenhydrate verstoffwechseln, dies sind unter anderem Fructose, Fucose, Rhamnose und Turanose.[2] Dabei wird keine Säure gebildet, wie es für eine Gärung typisch wäre.[3] Auch kann er einige Zuckeralkohole verwerten, beispielsweise Glycerin (Glycerol), Mannitol, Xylitol und Arabitol (dieser leitet sich von dem Zucker Arabinose ab). Weitere organische Verbindungen, die er als Kohlenstoffquelle nutzen kann, sind Gluconsäure, L-Milchsäure, L- und D-Äpfelsäure, Bernsteinsäure und verschiedene Aminosäuren.[2]
Weitere biochemische Merkmale, wie beispielsweise die vorhandenen Enzyme können in einer „Bunten Reihe“ zur Identifizierung von M. antarcticus verwendet werden. Neben dem Katalase- und Oxidase-Test, die bei allen Micrococcus-Arten positiv ausfallen,[4] können folgende Merkmale zur Unterscheidung zu den anderen Arten herangezogen werden: M. antarcticus ist in der Lage, Stärke durch Hydrolyse abzubauen. Die Voges-Proskauer-Reaktion und der Indol-Test verlaufen bei ihm positiv, ebenso die Nitratreduktion. Er verfügt nicht über das Enzym Urease, um Harnstoff abzubauen, ebenso wenig besitzt er das Enzym Arginindihydrolase (ADH).[2]
Ähnlich wie M. luteus reagiert das Bakterium sehr empfindlich auf Lysozym, ein antibakteriell wirkendes Enzym. Weiterhin wird es durch mehrere Antibiotika im Wachstum gehemmt. Dazu gehören Wirkstoffe aus der Gruppe der Penicilline (Benzylpenicillin, Methicillin), der Tetracycline, der Makrolide (Erythromycin), der Aminoglykoside (Streptomycin, Neomycin), der Gyrasehemmer (Novobiocin), der Polymyxine sowie Chloramphenicol.[2]
Chemotaxonomische Merkmale
Die grampositiven Bakterien werden den beiden Abteilungen Firmicutes und Actinobacteria zugerechnet, während erstere sich durch einen niedrigen GC-Gehalt (den Anteil der Nukleinbasen Guanin und Cytosin) in der Bakterien-DNA auszeichnen, ist dieser bei den Actinobacteria hoch.[3] Micrococcus antarcticus gehört zu diesem Phylum und weist einen GC-Gehalt von 66,4 Mol-Prozent auf.[2] Dies ist etwas geringer als bei den verwandten Arten M. luteus (etwa 73 Mol-Prozent)[5] und M. lylae (etwa 69 Mol-Prozent).[4] Das Genom wurde bisher (Stand 2014) noch nicht vollständig sequenziert. Allerdings wurden für phylogenetische Untersuchungen die Nukleotide der 16S rRNA bestimmt, ein für Prokaryoten typischer Vertreter der ribosomalen RNA.[6]
Die Zellwand von M. antarcticus besteht aus dem für grampositive Bakterien typischen Peptidoglycan. In den darin enthaltenen Peptiden ist L-Lysin die diagnostisch wichtige Aminosäure. Der Polysaccharid-Anteil enthält Mannosamin als Aminozucker.[2] Die für Micrococcus-Arten typischen verzweigten Fettsäuren[7] als Bestandteil der Lipide der Zellmembran lassen sich auch bei M. antarcticus finden: Vor allem sind anteiso-C15:0 (anteiso-Pentadecansäure) und iso-C15:0 (iso-Pentadecansäure) zu 50 % bzw. 20 % enthalten. Diese Fettsäuren weisen neben der Verzweigung in der Kohlenstoffkette durch eine Methylgruppe (–CH3) noch die Besonderheit auf, dass sie mit insgesamt 15 C-Atomen zu den ungeradzahligen Fettsäuren gehören. Die hauptsächlich vorkommenden Menachinone sind vom Typ MK-8 und MK-8(H2).[2]
Pathogenität
Micrococcus antarcticus ist nicht krankheitserregend, er wird durch die Biostoffverordnung in Verbindung mit der TRBA (Technische Regeln für Biologische Arbeitsstoffe) 466 der Risikogruppe 1 zugeordnet.[8]
Vorkommen und Bedeutung

Der Bakterienstamm T2T wurde 2000 bei der chinesischen Große-Mauer-Station (Great-Wall station) ![]() isoliert. Dabei handelt es sich um die erste Forschungsstation der Volksrepublik China in der Antarktis.[9] Nähere Untersuchungen führten zu dem Ergebnis, dass der Stamm eine neu entdeckte Spezies – Micrococcus antarcticus – darstellt. Die Erstbeschreibung erfolgte durch den chinesischen Wissenschaftler Hongcan Liu u. a.
isoliert. Dabei handelt es sich um die erste Forschungsstation der Volksrepublik China in der Antarktis.[9] Nähere Untersuchungen führten zu dem Ergebnis, dass der Stamm eine neu entdeckte Spezies – Micrococcus antarcticus – darstellt. Die Erstbeschreibung erfolgte durch den chinesischen Wissenschaftler Hongcan Liu u. a.
Dass auch sehr kalte Standorte von Bakterien besiedelt sind, ist seit 1887 bekannt, wobei die seitdem gefundenen Vertreter ganz verschiedenen Abteilungen angehören. Sie zeichnet aus, dass sie bei Temperaturen um 0 °C wachsen können. Man geht davon aus, dass Mikroorganismen, die in ganz anderen Habitaten angesiedelt waren, sich im Laufe der Evolution an die kalten Bedingungen angepasst haben, sie werden als kälteadaptiert bezeichnet. Die Anpassung an die Kälte hat Auswirkungen auf die in diesen Organismen vorhandenen Enzyme, und ebenso auf die Bestandteile, aus denen die Zellen aufgebaut sind, damit bei Temperaturen um den Gefrierpunkt des Wassers noch Stoffwechsel und Zellteilung stattfinden können.[10]
Bei M. antarcticus betrifft dies beispielsweise die Fettsäuren in den Membranlipiden. Wie bereits bei anderen psychrophilen oder psychrotoleranten Bakterien festgestellt wurde, enthalten diese ungesättigte und bzw. oder überwiegend verzweigtkettige Fettsäuren. Bei einer Pseudomonas-Art, die im antarktischen Boden gefunden wurde, beträgt der Gehalt an anteiso-C15:0 (anteiso-Pentadecansäure) mehr als 90 %.[7] Auch bei M. antarcticus ist diese Fettsäure, neben der iso-Pentadecansäure, vorherrschend. Damit die Zellmembran ihre Funktionen erfüllen kann, ist ihre Fluidität von Bedeutung. Ob eine Biomembran bei einer bestimmten Temperatur noch fluide ist, hängt wesentlich von den in den Lipiden enthaltenen Fettsäuren ab. Vereinfacht betrachtet sind Fettsäuren mit einem niedrigeren Schmelzpunkt von Vorteil, da sie bei niedrigen Temperaturen noch flüssig sind, während Fettsäuren mit einem höheren Schmelzpunkt bereits fest sind. Vergleicht man die Schmelzpunkte der verzweigten Pentadecansäuren mit dem der geradkettigen Pentadecansäure, so ist dieser Effekt vor allem bei dem anteiso-Isomer von Bedeutung. Genauer ist die Betrachtung der in der Membran vorliegenden Lipide, dabei handelt es sich z. B. um Phosphatidylcholine (Diacylphosphatidylcholin). Die Temperatur des Phasenübergangs ist bei den Phosphatidylcholinen mit verzweigten Fettsäuren deutlich niedriger (siehe Tabelle), die Zellmembran ist folglich auch bei 0 °C noch fluide.[7]
| Fettsäurekürzel | Schmelzpunkt der Fettsäure in °C | Temperatur des Phasenübergangs des Diacylphosphatidylcholins in °C | Strukturformel |
|---|---|---|---|
| C15:0 | 52,5 | 34,2 | 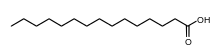 |
| iso-C15:0 | 51,7 | 6,5 | |
| anteiso-C15:0 | 23,0 | −16,7 | 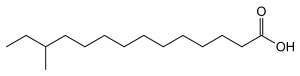 |
Auch ein Enzym von M. antarcticus wird unter dem Aspekt der Kälteadapation untersucht. Es handelt sich hierbei um die β-Glucosidase (Beta-Glucosidase, EC 3.2.1.21), eine Cellulase, die am Abbau der Cellulose beteiligt ist. Zweck der Untersuchung ist es, zu verstehen, warum dieses Enzym bei niedrigen Temperaturen noch eine Aktivität des Substratabbaus zeigt. Derartige Enzyme sind von Interesse für die Biotechnologie, da mit ihnen Umsetzungen bei niedrigen Temperaturen erfolgen können. Zunächst wurde im Genom von M. antarcticus das Gen sequenziert, das dieses Protein codiert. Das Gen bglU beinhaltet einen offenen Leserahmen (orf) mit einer Größe von 1419 Basenpaaren (bp) und wurde durch Klonierung vervielfältigt. Das zugehörige rekombinante Protein BglU – also die kälteadaptierte β-Glucosidase – besteht aus 472 Aminosäuren, mit einer Molekülmasse von 48 kDa. Im Vergleich zu der „mesophilen“ (im mittleren Temperaturbereich aktiven) GH1 β-Glucosidase ist hier ein geringerer Arginin-Gehalt charakteristisch. Auch das Verhältnis von Arginin zu der Summe aus Arginin und Lysin fällt kleiner aus. BglU zeigt bei 25 °C maximale Aktivität, ist jedoch thermolabil. Bereits bei 30 °C ist nach 30 Minuten die Hälfte der Proteinmoleküle nicht mehr aktiv.[11]
Systematik
→ Siehe auch: Taxonomie der Familie Micrococcaceae
Micrococcus antarcticus ist eine von neun Arten (Stand 2014) der Gattung Micrococcus,[12] deren Systematik sich durch die Forschungsergebnisse von Stackebrandt et al. aus dem Jahr 1995 stark verändert hat.[4] Bei der Zuordnung eines neu entdeckten Bakterienstamms zu einem Taxon werden neben den chemotaxonomischen Merkmalen auch die biochemischen bzw. stoffwechselphysiologischen Eigenschaften des Organismus untersucht und mit bekannten Organismen verglichen. Seit Ende des 20. Jahrhunderts werden zur Aufklärung der Stammesgeschichte – und der verwandtschaftlichen Beziehungen der Organismen untereinander – zunehmend molekularbiologische Methoden verwendet. So vergleicht man DNA-Sequenzen mittels DNA-DNA-Hybridisierung und untersucht bei Prokaryoten zusätzlich die 16S rRNA.
Der Vergleich der Nukleotid-Sequenz der 16S rRNA zeigt eine große Übereinstimmung mit den zum Zeitpunkt der Untersuchung bekannten Micrococcus-Arten M. luteus und M. lylae, wobei M. luteus mit einer Übereinstimmung von 94,4 % näher verwandt ist. Die DNA-DNA-Hybridisierung zeigt im Vergleich zu M. luteus eine Übereinstimmung von 34,4 %, bei M. lylae sind es 28,8 %. Dies ist deutlich weniger als 70,0 %, was als Kriterium für eine neue Art gilt. Nach dem Fundort in der Antarktis wurde von den Entdeckern der Name Micrococcus antarcticus vorgeschlagen, der nach den Regeln für die Systematik der Bakterien anerkannt ist.[12] Daneben wird auch die Bezeichnung Micrococcus psychrophilum verwendet.[13] Bisher wurden fünf Bakterienstämme in verschiedenen Sammlungen von Mikroorganismen hinterlegt.[14]
Einzelnachweise
- Hans G. Schlegel, Christiane Zaborosch: Allgemeine Mikrobiologie. 7. Auflage. Thieme Verlag, Stuttgart/New York 1992, ISBN 3-13-444607-3, S. 25, 99.
- H. Liu, Y. Xu, Y. Ma, P. Zhou: Characterization of Micrococcus antarcticus sp. nov., a psychrophilic bacterium from Antarctica. In: International journal of systematic and evolutionary microbiology. Band 50, Nummer 2, März 2000, S. 715–719, ISSN 1466-5026. PMID 10758880.
- Michael T. Madigan, John M. Martinko, Jack Parker: Brock Mikrobiologie. Deutsche Übersetzung herausgegeben von Werner Goebel, 1. Auflage. Spektrum Akademischer Verlag GmbH, Heidelberg/Berlin 2000, ISBN 978-3-8274-0566-1, S. 558.
- E. Stackebrandt, C. Koch, O. Gvozdiak, P. Schumann: Taxonomic dissection of the genus Micrococcus: Kocuria gen. nov., Nesterenkonia gen. nov., Kytococcus gen. nov., Dermacoccus gen. nov., and Micrococcus Cohn 1872 gen. emend. In: International journal of systematic bacteriology. Band 45, Nummer 4, Oktober 1995, S. 682–692, ISSN 0020-7713. PMID 7547287.
- Micrococcus luteus. In: Webseite Genome des National Center for Biotechnology Information (NCBI). Abgerufen am 5. Januar 2014.
- Micrococcus antarcticus strain T2 16S ribosomal RNA, partial sequence. In: Webseite Nucleotide von Micrococcus antarcticus des National Center for Biotechnology Information (NCBI). Abgerufen am 5. Januar 2014.
- Toshi Kaneda: Iso- and anteiso-fatty acids in bacteria: biosynthesis, function, and taxonomic significance. In: Microbiological reviews. Band 55, Nummer 2, Juni 1991, S. 288–302, ISSN 0146-0749. PMID 1886522. PMC 372815 (freier Volltext). (Review).
- TRBA (Technische Regeln für Biologische Arbeitsstoffe) 466: Einstufung von Prokaryonten (Bacteria und Archaea) in Risikogruppen. In: Webseite der Bundesanstalt für Arbeitsschutz und Arbeitsmedizin (BAuA). 25. April 2012, S. 137, abgerufen am 17. November 2013.
- Chinese Antarctic Great Wall Station. In: Offizielle Seite der Chinese Arctic and Antarctic Administration. Abgerufen am 5. Januar 2014.
- Anne-Monique Gounot: Bacterial life at low temperature: physiological aspects and biotechnological implications. In: The Journal of applied bacteriology. Band 71, Nummer 5, November 1991, S. 386–397, ISSN 0021-8847. doi:10.1111/j.1365-2672.1991.tb03806.x. PMID 1761432. (Review).
- H. X. Fan, L. L. Miao u. a.: Gene cloning and characterization of a cold-adapted β-glucosidase belonging to glycosyl hydrolase family 1 from a psychrotolerant bacterium Micrococcus antarcticus. In: Enzyme and microbial technology. Band 49, Nummer 1, Juni 2011, S. 94–99, ISSN 1879-0909. doi:10.1016/j.enzmictec.2011.03.001. PMID 22112277.
- Jean Euzéby, Aidan C. Parte: Genus Micrococcus. In: List of Prokaryotic names with Standing in Nomenclature (LPSN). Abgerufen am 5. Januar 2014.
- Taxonomy Browser Micrococcus antarcticus. In: Webseite des National Center for Biotechnology Information (NCBI). Abgerufen am 6. Januar 2014.
- Strain Passport Micrococcus antarcticus. In: Website StrainInfo (gesammelte Informationen über Bakterienstämme in über 60 Biologischen Forschungseinrichtungen (biological resource centers, BRCs)). Abgerufen am 6. Januar 2014.