Systematik der Bakterien
Die taxonomische Aufteilung der Bakterien und Archaeen ist umstritten. Anfangs nur durch Aussehen und Physiologie klassifiziert, wird heute aufgrund neuer Möglichkeiten allgemein die Einteilung mittels phylogenetischer Analyse akzeptiert, wie es Carl Woese (1977, 1990) vorgeschlagen hat.[1][2]
Die Erstbeschreibung von Bakteriengattungen, -arten und Taxa höherer Rangstufen hat nach einer festgelegten Prozedur zu erfolgen.[3] Ein Taxon bzw. dessen Name erlangt nur Gültigkeit durch Erstpublikation oder Revision im International Journal of Systematic and Evolutionary Microbiology (IJSEM). Der aktuelle Stand, welche Taxa bzw. deren Namen diesbezüglich anerkannt sind, kann in der List of Prokaryotic names with Standing in Nomenclature (LPSN),[4] gepflegt durch Jean P. Euzéby und seit Juli 2013 weitergeführt durch Aidan C. Parte, eingesehen werden. Diese Namen entsprechen den Anforderungen des 1980 reformierten Internationalen Codes der Nomenklatur von Bakterien (ICNB),[5] d. h. jeder dieser Namen benennt ein eindeutig anhand seines hinterlegten Typusmaterials identifizierbares Taxon. Diese Namen werden generell nicht in Anführungszeichen gesetzt.

Darüber hinaus wurde die globale Einteilung (siehe Phylogenetischer Baum) innerhalb der Bakterien reformiert: Die Taxonomie orientiert sich nunmehr auch an Erkenntnissen, die mittels phylogenetischer Analyse, basierend auf Vergleichen von Bakterienerbgut gewonnen werden.[6] Anfangs wurden hierfür die Nukleotide der 16S rRNA, ein für Prokaryoten typischer Vertreter der ribosomalen RNA, sequenziert und verglichen, mittlerweile werden zusätzlich bisweilen weitere phylogenetische Markergene hinzugezogen. Durch den ICNB wird ein Minimalstandard für die Beschreibung neuer Arten empfohlen, der von den jeweiligen Experten festgelegt wird (Recommendation 30b).[5] Ein derartiger Minimalstandard beinhaltet neben genetischen auch phänotypische und ökologische Merkmale.[7]
Eine aktuelle Zusammenstellung der Taxa aus dieser und zahlreichen weiterführenden Publikationen erscheint in Bergey’s Manual of Systematic Bacteriology.[8] Einige dieser Taxa haben ihre Berechtigung, sind aber bis heute nicht valide publiziert oder anderweitig nicht gemäß den Anforderungen des ICNB definiert. Diese Namen, sowie alle Synonyme, die aktuell gültigen Namen eindeutig zugeordnet werden können, werden in Anführungszeichen gesetzt.
Diese Referenzliste höherer Taxa enthält die Taxa der Rangstufen Domäne (für die Bakterien insgesamt), sowie Phylum (oder Stamm im Sinn einer taxonomischen Rangstufe wie bei Eukaryoten) bis Familie (in Ausnahmen auch darunter). Bei manchen Taxa gibt es widersprüchliche Einträge. Diese wurden auf Stichhaltigkeit geprüft, anhand der Originalliteratur und einer phylogenetischen Analyse.[9][10][11] Daher sind einige Abweichungen innerhalb der und von den oben beschriebenen relevanten Veröffentlichungen möglich. Ursachen dafür sind vielfältig und haben ihre Gründe. Eine Änderung einzelner Taxa sollte zunächst diskutiert werden und dann nur mit Angabe der Quelle erfolgen.
Grundlagen
Bakterien und Archaeen können im Gegensatz zu größeren mehrzelligen Eukaryoten nicht leicht in das klassische System der Taxonomie eingefügt werden. Einerseits gibt es keine sexuelle Vermehrung, weshalb der biologische Artbegriff (Ernst Mayr) nicht anwendbar ist, andererseits sind sie so klein, dass eine optische Beschreibung nicht immer wesentliche Erkenntnisse beisteuert, sodass ein phänetischer/morphologischer Artbegriff nur bedingt anwendbar ist. Eine physiologische Beschreibung trug zwar bald zur Klassifizierung bei, konnte jedoch mangels geeigneter Methoden nur eine unvollständige Einteilung bewerkstelligen. Nach der Erfindung der PCR (Polymerase-Kettenreaktion) waren Teile der genetischen Information der einzelnen Organismen zugänglich. Dabei wurde insbesondere die Sequenz der Gene für die RNA-Untereinheiten der ubiquitären Ribosomen als sinnvoller Marker für phylogenetische Analysen entdeckt. Jedes Lebewesen benötigt die in ihrer Entwicklung äußerst konservativen Ribosomen zum Zusammenbau der Proteine. Am erfolgreichsten, wenn auch nicht perfekt, war die Analyse mit Hilfe des Gens der 16S rRNA, Hauptbestandteil der kleinen Untereinheit des Ribosoms. Dadurch eröffneten sich nun ungeahnte Möglichkeiten zur phylogenetischen Analyse der Organismen, zusätzlich zu den bisherigen Methoden. Die Taxonomie der Mikroorganismen konnte überprüft werden – natürlich nicht ohne Auswirkungen. So sind viele bekannte Begriffe in Frage gestellt, aber derzeit noch nicht ganz von neuen abgelöst oder modifiziert, da meist deutlich mehr Arbeit damit verbunden ist, als ein paar Sequenzierungen. Die Systematik der Archaeen ist direkt in den Artikel der Archaeen integriert.
Taxa der Domäne Bakterien, deren Benutzung empfohlen wird
Die folgende Liste folgt LPSN (mit Stand vom 22. Oktober 2020). Taxa sind vom Rang des Phylums bis herunter zur Familie aufgegliedert (mit einigen wenigen Ausnahmen):[12]
Phylum „Abditibacteriota“
- Klasse Abditibacteria
- Ordnung Abditibacteriales
- Familie Abditibacteriaceae
Phylum „Acidobacteria“
- Klasse „Acidobacteriia“
- Ordnung Acidobacteriales
- Familie Acidobacteriaceae
- Ordnung Bryobacterales
- Familie Bryobacteraceae
- Klasse Blastocatellia
- Ordnung Blastocatellales
- Familie Arenimicrobiaceae
- Familie Blastocatellaceae
- Familie Pyrinomonadaceae
- Klasse Holophagae
- Ordnung Acanthopleuribacterales
- Familie Acanthopleuribacteraceae
- Ordnung Holophagales
- Familie Holophagaceae
- Ordnung Thermotomaculales
- Familie Thermotomaculaceae
- Klasse Thermoanaerobaculia
- Ordnung Thermoanaerobaculales
- Familie Thermoanaerobaculaceae
- Klasse Vicinamibacteria
- Ordnung Vicinamibacterales
- Familie Vicinamibacteraceae
Phylum „Actinobacteria“
- Klasse Acidimicrobiia
- Ordnung Acidimicrobiales
- Unterordnung „Acidimicrobineae“
- Familie Acidimicrobiaceae
- Familie Iamiaceae
- Klasse Actinobacteria
- Ordnung Acidothermales
- Familie Acidothermaceae
- Ordnung Actinomycetales
- Unterordnung Actinomycineae
- Familie Actinomycetaceae
- Unterordnung Actinopolysporineae
- Familie Actinopolysporaceae
- Unterordnung Catenulisporineae
- Familie Actinospicaceae
- Familie Catenulisporaceae
- Unterordnung Corynebacterineae
- Familie Corynebacteriaceae
- Familie Dietziaceae
- Familie Mycobacteriaceae
- Familie Nocardiaceae
- Familie Segniliparaceae
- Familie Tsukamurellaceae
- Unterordnung Glycomycineae
- Familie Glycomycetaceae
- Unterordnung Jiangellineae
- Familie Jiangellaceae
- Unterordnung Micromonosporineae
- Familie Micromonosporaceae
- Unterordnung Propionibacterineae
- Familie Nocardioidaceae
- Familie Propionibacteriaceae
- Unterordnung Pseudonocardineae
- Familie Pseudonocardiaceae
- Unterordnung Streptomycineae
- Familie Streptomycetaceae
- Unterordnung Streptosporangineae
- Familie Nocardiopsaceae
- Familie Streptosporangiaceae
- Familie Thermomonosporaceae
- Ordnung Actinopolysporales
- Familie Actinopolysporaceae
- Ordnung Bifidobacteriales
- Familie Bifidobacteriaceae
- Ordnung Catenulisporales
- Familie Actinospicaceae
- Familie Catenulisporaceae
- Ordnung Cryptosporangiales
- Familie Cryptosporangiaceae
- Ordnung Frankiales (alternativ: Motilibacterales)
- Familie Frankiaceae
- Familie Motilibacteraceae
- Ordnung Geodermatophilales
- Familie Antricoccaceae
- Familie Geodermatophilaceae
- Ordnung Glycomycetales
- Familie Glycomycetaceae
- Ordnung Jatrophihabitantales
- Familie Jatrophihabitantaceae
- Ordnung Jiangellales
- Familie Jiangellaceae
- Ordnung Kineosporiales
- Familie Kineosporiaceae
- Ordnung Micrococcales
- Familie Beutenbergiaceae
- Familie Bogoriellaceae
- Familie Brevibacteriaceae
- Familie Cellulomonadaceae
- Familie Demequinaceae
- Familie Dermabacteraceae
- Familie Dermacoccaceae
- Familie Dermatophilaceae
- Familie Intrasporangiaceae
- Familie Jonesiaceae (inklusive ehemaliger Sanguibacteraceae)
- Familie Kytococcaceae
- Familie Microbacteriaceae
- Familie Micrococcaceae
- Familie Ornithinimicrobiaceae
- Familie Promicromonosporaceae
- Familie Rarobacteraceae
- Familie Ruaniaceae
- Familie Tropherymataceae
- Familie Yaniellaceae
- Ordnung Micromonosporales
- Familie Micromonosporaceae
- Ordnung Mycobacteriales (alternativ: Corynebacteriales)
- Familie Corynebacteriacea
- Familie Dietziaceae
- Familie Gordoniaceae
- Familie Lawsonellaceae
- Familie Mycobacteriaceae
- Familie Nocardiaceae
- Familie Segniliparaceae
- Familie Tsukamurellaceae
- Ordnung Nakamurellales
- Familie Nakamurellaceae
- Ordnung Propionibacteriales
- Familie Actinopolymorphaceae
- Familie Kribbellaceae
- Familie Nocardioidaceae
- Familie Propionibacteriaceae
- Ordnung Pseudonocardiales
- Familie Pseudonocardiaceae
- Ordnung Sporichthyales
- Familie Sporichthyaceae
- Ordnung Streptosporangiales
- Familie Streptomycetaceae
- Klasse Coriobacteriia
- Ordnung Coriobacteriales
- Unterordnung „Coriobacterineae“
- Familie Atopobiaceae
- Familie Coriobacteriaceae
- Ordnung Eggerthellales
- Familie Eggerthellaceae
- Klasse Nitriliruptoria
- Ordnung Egibacterales
- Familie Egibacteraceae
- Ordnung Egicoccales
- Familie Egicoccaceae
- Ordnung Euzebyales
- Familie Euzebyaceae
- Ordnung Nitriliruptorales
- Familie Nitriliruptoraceae
- Klasse Rubrobacteria
- Ordnung Gaiellales
- Familie Gaiellaceae
- Ordnung Rubrobacterales
- Unterordnung „Rubrobacterineae“
- Familie Rubrobacteraceae
- Ordnung Solirubrobacterales
- Familie Baekduiaceae
- Familie Conexibacteraceae
- Familie Paraconexibacteraceae
- Familie Parviterribacteraceae
- Familie Patulibacteraceae
- Familie Solirubrobacteraceae
- Klasse Thermoleophilia
- Ordnung Thermoleophilales
- Familie Thermoleophilaceae
Phylum „Aminicenantes“
- Familie „Saccharicenantaceae“
Phylum „Aquificae“
- Klasse Aquificae
- Ordnung Aquificales
- Familie Aquificaceae
- Familie Desulfurobacteriaceae
- Familie Hydrogenothermaceae
Phylum „Armatimonadetes“
- Klasse Armatimonadia
- Ordnung Armatimonadales
- Familie Armatimonadaceae
- Klasse Chthonomonadetes
- Ordnung Chthonomonadales
- Familie Chthonomonadaceae
- Klasse Fimbriimonadia
- Ordnung Fimbriimonadales
- Familie Fimbriimonadaceae
Phylum „Bacteroidetes“
- Klasse Bacteroidia
- Ordnung Bacteroidales
- Familie Bacteroidaceae
- Familie Balneicellaceae
- Familie Lentimicrobiaceae
- Familie Marinifilaceae
- Familie Marinilabiliaceae
- Familie Odoribacteraceae
- Familie Porphyromonadaceae
- Familie Prevotellaceae
- Familie Prolixibacteraceae
- Familie Rikenellaceae
- Ordnung Marinilabiliales
- Familie Salinivirgaceae
- Klasse Chitinophagia
- Ordnung Chitinophagales
- Familie Chitinophagaceae
- Familie Hymenobacteraceae
- Klasse Cytophagia
- Ordnung Cytophagales
- Familie Bernardetiaceae
- Familie Catalimonadaceae
- Familie Cyclobacteriaceae
- Familie Cytophagaceae
- Familie Flammeovirgaceae
- Familie Microscillaceae
- Familie Mooreiaceae
- Familie Persicobacteraceae
- Familie Thermonemataceae
- Klasse Flavobacteria
- Ordnung Flavobacteriales
- Familie Blattabacteriaceae
- Familie Crocinitomicaceae
- Familie Cryomorphaceae
- Familie Flavobacteriaceae
- Familie Ichthyobacteriaceae
- Familie Schleiferiaceae
- Klasse Saprospiria
- Ordnung Saprospirales
- Familie Saprospiraceae
- Klasse Sphingobacteriia
- Ordnung Sphingobacteriales
- Familie Crenotrichaceae
- Familie Filobacteriaceae
- Familie Sphingobacteriaceae
Phylum „Balneolaeota“
- Klasse Balneolia
- Ordnung Balneolales
- Familie Balneolaceae
- Familie Soortiaceae
Phylum „Caldiserica“
- Klasse Caldisericia
- Ordnung Caldisericiales
- Familie Caldisericiaceae
Phylum „Calditrichaeota“
- Gattung Calorithrix
Phylum „Chlamydiae“
- Klasse Chlamydiae
- Ordnung Chlamydiales
- Familie „Actinochlamydiaceae“
- Familie Chlamydiaceae
- Familie „Criblamydiaceae“
- Familie Parachlamydiaceae
- Familie „Parilichlamydiaceae“
- Familie „Piscichlamydiaceae“
- Familie „Rhabdochlamydiaceae“
- Familie Simkaniaceae
- Familie Waddliaceae
Phylum „Chlorobi“
- Klasse „Chlorobia“
- Ordnung Chlorobiales
- Familie Chlorobiaceae
- Klasse Dehalococcoidia
- Ordnung Dehalococcoidales
- Familie Dehalococcoidaceae
- Klasse Ignavibacteria
- Ordnung Ignavibacteriales
- Familie Ignavibacteriaceae
- Familie „Melioribacteraceae“
Phylum „Chloroflexi“
- Klasse Anaerolineae
- Ordnung Anaerolineales
- Familie Anaerolineaceae
- Klasse Ardenticatenia
- Ordnung Ardenticateniales
- Familie Ardenticateniaceae
- Klasse Caldilineae
- Ordnung Caldilineales
- Familie Caldilineaceae
- Klasse Chloroflexia
- Ordnung Chloroflexales
- Unterordnung Chloroflexineae
- Familie Chloroflexaceae
- Familie Oscillochloridaceae
- Unterordnung Roseiflexineae
- Familie Roseiflexaceae
- Ordnung Herpetosiphonales
- Familie Herpetosiphonaceae
- Ordnung Kallotenuales
- Familie Kallotenualaceae
- Klasse Dehalococcoidia
- Ordnung Dehalococcoidales
- Familie Dehalococcoidaceae
- Klasse Ktedonobacteria
- Ordnung Ktedonobacterales
- Familie Ktedonobacteraceae
- Familie Thermosporotrichaceae
- Ordnung Thermogemmatisporales
- Familie Thermogemmatisporaceae
- Klasse „Limnocylindria“
- Gattung „Aquidulcis“
- Klasse Tepidiformia
- Ordnung Tepidiformales
- Familie Tepidiformaceae
- Klasse Thermoflexia
- Ordnung Thermoflexales
- Familie Thermoflexaceae
- Klasse Thermomicrobia
- Unterklasse Sphaerobacteridae
- Ordnung Sphaerobacterales
- Unterordnung „Sphaerobacterineae“
- Familie Sphaerobacteraceae
- Ordnung Thermomicrobiales
- Familie Thermomicrobiaceae
Phylum „Chrysiogenetes“
- Klasse Chrysiogenetes
- Ordnung Chrysiogenales
- Familie Chrysiogenaceae
Phylum „Coprothermobacterota“
- Klasse Coprothermobacteria
- Ordnung Coprothermobacterales
- Familie Coprothermobacteraceae
Phylum „Cryosericota“
- Klasse „Cryosericia“
- Ordnung „Cryosericales“
- Familie „Cryosericaceae“
Phylum „Cyanobacteria“
- Klasse Cyanophyceae
- Ordnung Chroococcales
- Familie Chroococcaceae
- Gattung Chroococcus
- Ordnung Chroococcidiopsidales
- Familie „Aliterellaceae“
- Familie Chroococcidiopsidaceae
- Ordnung „Gloeobacterales“
- Familie Gloeobacteraceae
- Ordnung Gloeomargaritales
- Familie Gloeomargaritaceae
- Ordnung Nostocales
- Familie „Aphanizomenonaceae“
- Familie Calotrichaceae
- Familie Capsosiraceae
- Familie Chlorogloeopsidaceae
- Familie „Fortieaceae“
- Familie Gloeotrichiaceae
- Familie Godleyaceae
- Familie „Hapalosiphonaceae“
- Familie Heteroscytonemataceae
- Familie Nostocaceae
- Familie Rhizonemataceae
- Familie „Rivulariaceae“
- Familie „Scytonemataceae“
- Familie Stigonemataceae
- Familie „Symphyonemataceae“
- Familie Tolypothrichaceae
- Ordnung Oscillatoriales
- Familie „Borziaceae“
- Familie Coleofasciculaceae
- Familie Cyanothecaceae
- Familie Desertifilaceae
- Familie Gomontiellaceae
- Familie Homoeotrichaceae
- Familie Microcoleaceae
- Familie „Oscillatoriaceae“
- Familie Phormidiaceae
- Familie „Pseudonostocaceae“
- Ordnung Pleurocapsales
- Familie „Dermocarpellaceae“
- Familie Hydrococcaceae
- Familie Pleurocapsaceae
- Familie Xenococcaceae
- Ordnung Order Spirulinales
- Familie Spirulinaceae
- Ordnung „Synechococcales“
- Familie Acaryochloridaceae
- Familie „Chamaesiphonaceae“
- Familie Coelosphaeriaceae
- Familie Heteroleibleiniaceae
- Familie Leptolyngbyaceae
- Familie „Merismopediaceae“
- Familie Oculatellaceae
- Familie Prochloraceae
- Familie Pseudanabaenaceae
- Familie Romeriaceae
- Familie Schizotrichaceae
- Familie Synechococcaceae
Phylum „Deferribacteres“
- Klasse Deferribacteres
- Ordnung Deferribacterales
- Familie Calditrichaceae
- Familie Deferribacteraceae
Phylum „Deinococcus-Thermus“
- Klasse Deinococci
- Ordnung Deinococcales
- Familie Deinococcaceae
- Familie Trueperaceae
- Ordnung Thermales
- Familie Thermaceae
- Ordnung Trueperales
- Familie Trueperaceae
Phylum „Dictyoglomi“
- Klasse Dictyoglomia
- Ordnung Dictyoglomales
- Familie Dictyoglomaceae
Phylum „Elusimicrobia“
- Klasse Elusimicrobia
- Ordnung Elusimicrobiales
- Familie Elusimicrobiaceae
- Klasse Endomicrobia
- Ordnung Endomicrobiales
- Familie Endomicrobiaceae
Phylum „Fibrobacteres“
- Klasse Chitinispirillia
- Ordnung Chitinispirillales
- Familie Chitinispirillaceae
- Klasse Chitinivibrionia
- Ordnung Chitinivibrioniales
- Familie Chitinivibrioniaceae
- Klasse Fibrobacteres
- Ordnung Fibrobacterales
- Familie Fibrobacteraceae
Phylum „Firmicutes“
- Klasse Bacilli (alternativ: Firmibacteria oder Teichobacteria)
- Ordnung Caryophanales (alternativ: Bacillales)
- Familie Alicyclobacillaceae
- Familie Bacillaceae
- Familie Caryophanaceae (alternativ: Planococcaceae)
- Familie Listeriaceae
- Familie Paenibacillaceae
- Familie Pasteuriaceae
- Familie Sporolactobacillaceae
- Familie Staphylococcaceae
- Familie Thermoactinomycetaceae
- Ordnung Lactobacillales
- Familie Aerococcaceae
- Familie Carnobacteriaceae
- Familie Enterococcaceae
- Familie Lactobacillaceae
- Familie Leuconostocaceae
- Familie Streptococcaceae
- Klasse Clostridia
- Ordnung Clostridiales (alternativ: Eubacteriales)
- Familie Caldicoprobacteraceae
- Familie „Catabacteriaceae“
- Familie Christensenellaceae
- Familie Defluviitaleaceae
- Familie Eubacteriaceae
- Familie Gracilibacteraceae
- Familie Heliobacteriaceae
- Familie Lachnospiraceae
- Familie Oscillospiraceae (alternativ: Ruminococcaceae)
- Familie Peptococcaceae
- Familie Peptoniphilaceae
- Familie Peptostreptococcaceae
- Familie Proteinivoraceae
- Familie Symbiobacteriaceae
- Familie Syntrophomonadaceae
- Familie Vallitaleaceae
- Familie „Xylanivirgaceae“
- Ordnung Halanaerobiales
- Familie Halanaerobiaceae
- Familie Halobacteroidaceae
- Ordnung Natranaerobiales
- Familie Natranaerobiaceae
- Ordnung Thermoanaerobacterales
- Familie Thermoanaerobacteraceae
- Familie Thermodesulfobiaceae
- Familie Zhaonellaceae
- Ordnung Thermosediminibacterales
- Familie Tepidanaerobacteraceae
- Familie Thermosediminibacteraceae
- Klasse Erysipelotrichia
- Ordnung Erysipelotrichales
- Familie Coprobacillaceae
- Familie Erysipelotrichaceae
- Familie Turicibacteraceae
- Klasse Limnochordia
- Ordnung Limnochordales
- Familie Limnochordaceae
- Klasse „Natranaerobiia“
- Familie „Natranaerofabaceae“
- Klasse Negativicutes
- Ordnung Acidaminococcales
- Familie Acidaminococcaceae
- Ordnung Selenomonadales
- Familie Selenomonadaceae
- Familie Sporomusaceae
- Ordnung Veillonellales
- Familie Veillonellaceae
- Klasse Thermolithobacteria
- Ordnung Thermolithobacterales
- Familie Thermolithobacteraceae
- Klasse Tissierellia
- Ordnung Tissierellales
- Familie Gottschalkiaceae
- Klasse „Tissierellia“
- Familie Gottschalkiaceae
- Familie Tissierellaceae
Phylum „Fusobacteria“
- Klasse Fusobacteriia
- Ordnung Fusobacteriales
- Familie Fusobacteriaceae
- Familie Leptotrichiaceae
Phylum „Gemmatimonadetes“
- Klasse Gemmatimonadetes
- Ordnung Gemmatimonadales
- Familie Gemmatimonadaceae
- Klasse Longimicrobia
- Longimicrobiaceae
Phylum „Kiritimatiellaeota“
- Klasse Kiritimatiellae
- Ordnung Kiritimatiellales
- Familie Kiritimatiellaceae
- Klasse Tichowtungiia
- Ordnung Tichowtungiales
- Familie Tichowtungiaceae
Phylum „Krumholzibacteriota“
- Klasse „Krumholzibacteria“
- Ordnung „Krumholzibacteriales“
- Familie „Krumholzibacteriaceae“
Phylum „Lentisphaerae“
- Klasse Lentisphaeria
- Ordnung Lentisphaerales
- Familie Lentisphaeraceae
- Ordnung Victivallales
- Familie Victivallaceae
- Klasse Oligosphaeria
- Ordnung Oligosphaerales
- Familie Oligosphaeraceae
Phylum „Margulisbacteria“
- Klasse „Termititenacia“
- Ordnung „Termititenacales“
- Familie „Termititenacaceae“
Phylum „Mcinerneyibacteriota“
- Klasse „Mcinerneyibacteria“
- Ordnung „Mcinerneyibacteriales“
- Familie „Mcinerneyibacteriaceae“
Phylum „Melainabacteria“
- Klasse „Melainabacteria“
- Ordnung „Gastranaerophilales“
- Gattung „Gastranaerophilus“
Phylum „Nitrospinae“
- Gattung „Candidatus Nitromaritima“
Phylum „Nitrospira“
- Klasse „Nitrospira“
- Ordnung „Nitrospirales“
- Familie „Nitrospiraceae“
Phylum „Parcubacteria“
- Gattung „Sonnebornia“
Phylum „Parcunitrobacteria“
- Klasse „Parcunitrobacteria“
- Ordnung „Parcunitrobacterales“
- Familie „Parcunitrobacteraceae“
Phylum „Peregrinibacteria“
- Klasse „Peribacteria“
- Ordnung „Peribacterales“
- Familie „Peribacteraceae“
Phylum „Planctomycetes“
Synonym: „Planctobacteria“
- Klasse Phycisphaerae
- Ordnung Phycisphaerales
- Familie Phycisphaeraceae
- Ordnung Sedimentisphaerales
- Familie Anaerohalosphaeraceae
- Familie Sedimentisphaeraceae
- Ordnung Tepidisphaerales
- Familie Tepidisphaeraceae
- Klasse Planctomycetia (alternativ: Planctomycea, vorher: Planctomycetacia)
- Ordnung Gemmatales
- Familie Gemmataceae
- Ordnung Isosphaerales
- Familie Isosphaeraceae
- Ordnung Pirellulales
- Familie Lacipirellulaceae
- Familie Pirellulaceae
- Familie Thermoguttaceae
- Ordnung Planctomycetales
- Familie Gemmataceae
- Familie Isosphaeraceae
- Familie Planctomycetaceae
Klasse Acidithiobacillia
- Ordnung Acidithiobacillales[13]
- Familie Acidithiobacillaceae
- Familie Thermithiobacillaceae
Klasse Alphaproteobacteria
- Ordnung Caulobacterales
- Familie Caulobacteraceae
- Familie Hyphomonadaceae
- Ordnung Emcibacterales
- Familie Emcibacteraceae
- Ordnung „Holosporales“
- Familie Holosporaceae
- Familie „Caedimonadaceae“
- Familie Holosporaceae
- Familie „Paracaedibacteraceae“
- Ordnung Hyphomicrobiales (alernativ: Rhizobiales)
- Familie Aestuariivirgaceae
- Familie Afifellaceae
- Familie Ahrensiaceae
- Familie Alsobacteraceae
- Familie Amorphaceae
- Familie Ancalomicrobiacae
- Familie Aurantimonadaceae
- Familie Bartonellaceae
- Familie Beijerinckiaceae
- Familie Blastochloridaceae
- Familie Boseaceae
- Familie Breoghaniaceae
- Familie Brucellaceae
- Familie Chelatococcaceae
- Familie Cohaesibacteraceae
- Familie Devosiaceae
- Familie Hyphomicrobiaceae
- Familie Kaistiaceae
- Familie Lichenibacteriaceae
- Familie Lichenihabitantaceae
- Familie Methylobacteriaceae
- Familie Methylocystaceae
- Familie Nitrobacteraceae (alternativ: Bradyrhizobiaceae)
- Familie Notoacmeibacteraceae (alternativ: Mabikibacteraceae)
- Familie Parvibaculaceae
- Familie Phreatobacteraceae
- Familie Phyllobacteriaceae
- Familie Pleomorphomonadaceae
- Familie Pseudoxanthobacteraceae
- Familie Rhabdaerophilaceae
- Familie Rhizobiaceae
- Familie Rhodobiaceae
- Familie Roseiarcaceae
- Familie Salinarimonadaceae
- Familie egnochrobactraceae
- Familie Stappiaceae
- Familie Tepidamorphaceae
- Familie Xanthobacteraceae
- Ordnung Iodidimonadales
- Familie Iodidimonadaceae
- Ordnung Kordiimonadales
- Familie „Kordiimonadaceae“
- Familie Temperatibacteraceae
- Ordnung Magnetococcales
- Familie „Magnetaquicoccaceae“
- Familie Magnetococcaceae
- Ordnung Micropepsales
- Micropepsaceae
- Familie Minwuiales
- Ordnung „Parvularculales“
- Familie „Parvularculaceae“
- Ordnung „Pelagibacterales“
- Familie „Pelagibacteraceae“
- Ordnung Rhodobacterales
- Familie Neomegalonemataceae
- Familie Rhodobacteraceae
- Ordnung Rhodospirillales (alternativ: Kiloniellales)
- Familie Acetobacteraceae
- Familie Azospirillaceae
- Familie Geminicoccaceae
- Familie Kiloniellaceae
- Familie Reyranellaceae
- Familie Rhodospirillaceae
- Familie Rhodovibrionaceae Hördt
- Familie Stellaceae Hördt
- Familie Terasakiellaceae
- Familie Thalassobaculaceae
- Familie Thalassospiraceae
- Familie Zavarziniaceae
- Ordnung Rickettsiales
- Familie „Deianiraeaceae“
- Familie Ehrlichiaceae (alternativ: Anaplasmataceae)
- Familie „Midichloriaceae“
- Familie Rickettsiaceae
- Familie „Tenuibacteraceae“
- Ordnung Sneathiellales
- Familie Sneathiellaceae
- Ordnung Sphingomonadales
- Familie Erythrobacteraceae
- Familie Sphingomonadaceae
- Familie Sphingosinicellaceae
- Familie Zymomonadaceae
Klasse Betaproteobacteria
- Ordnung Burkholderiales
- Familie Alcaligenaceae
- Familie Burkholderiaceae
- Familie Comamonadaceae
- Familie Oxalobacteraceae
- Familie Sutterellaceae
- Ordnung „Ferritrophicales“
- Familie „Ferritrophicaceae“
- Ordnung Neisseriales
- Familie Chromobacteriaceae
- Familie Neisseriaceae
- Ordnung Nitrosomonadales (vereinigt mit den jetzt synonymen Methylophilales und Sulfuricellales)
- Familie Gallionellaceae
- Familie Methylophilaceae
- Familie Nitrosomonadaceae
- Familie Spirillaceae
- Familie Sterolibacteriaceae
- Familie Sulfuricellaceae
- Familie Thiobacillaceae
- Ordnung „Procabacteriales“
- Familie „Procabacteriaceae“
- Ordnung Rhodocyclales
- Familie Azonexaceae
- Familie Rhodocyclaceae
- Familie Zoogloeaceae
Klasse Deltaproteobacteria
- Ordnung Bradymonadales
- Familie Bradymonadaceae
- Ordnung Desulfarculales
- Familie Desulfarculaceae
- Ordnung Desulfobacterales
- Familie Desulfobacteraceae
- Familie Desulfobulbaceae
- Familie Nitrospinaceae
- Ordnung „Desulfofervidales“
- Familie „Desulfofervidaceae“
- Ordnung Desulfovibrionales
- Familie Desulfohalobiaceae
- Familie Desulfomicrobiaceae
- Familie Desulfonatronumaceae
- Familie Desulfovibrionaceae
- Ordnung Desulfurellales
- Familie Desulfurellaceae
- Ordnung Desulfuromonadales
- Familie Desulfuromonadaceae
- Familie Geobacteraceae
- Ordnung Myxococcales
- Unterordnung Cystobacterineae
- Familie Anaeromyxobacteraceae
- Familie Archangiaceae (alternativ: Cystobacteraceae)
- Familie Myxococcaceae
- Familie Vulgatibacteraceae
- Unterordnung Nannocystineae
- Familie Kofleriaceae (alternativ Haliangiaceae)
- Familie Nannocystaceae
- Unterordnung Sorangineae
- Familie Labilitrichaceae
- Familie Phaselicystidaceae
- Familie Polyangiaceae
- Familie Sandaracinaceae
- Ordnung Syntrophobacterales
- Familie Syntrophaceae
- Familie Syntrophobacteraceae
Klasse Epsilonproteobacteria
- Ordnung Campylobacterales
- Familie Arcobacteraceae
- Familie Campylobacteraceae
- Familie Helicobacteraceae
- Familie „Hydrogenimonaceae“
- Familie „Thiobarbaceae“
- Ordnung Nautiliales
- Familie Nautiliaceae
- Familie „Thiovulgaceae“
Klasse Gammaproteobacteria
- Ordnung Acidiferrobacterales
- Familie Acidiferrobacteraceae
- Ordnung Aeromonadales
- Familie Aeromonadaceae
- Familie Succinivibrionaceae
- Ordnung Alteromonadales
- Familie Alteromonadaceae
- Familie Celerinatantimonadaceae
- Familie Colwelliaceae
- Familie Ferrimonidaceae
- Familie Idiomarinaceae
- Familie Moritellaceae
- Familie Pseudoalteromonadaceae
- Familie Psychromonadaceae
- Familie Shewanellaceae
- Ordnung Arenicellales
- Familie Arenicellaceae
- Ordnung Cardiobacteriales
- Familie Cardiobacteriaceae
- Ordnung: Cellvibrionales
- Familie Cellvibrionaceae
- Familie Halieaceae
- Familie Microbulbiferaceae
- Familie Porticoccaceae
- Familie Spongiibacteraceae
- Ordnung Chromatiales
- Familie „Aquichromatiaceae“
- Familie Chromatiaceae
- Familie Ectothiorhodospiraceae
- Familie Granulosicoccaceae
- Familie Halothiobacillaceae
- Familie Thioalkalispiraceae
- Familie Thioalkalispiraceae
- Familie Thioprofundaceae
- Familie Wenzhouxiangellaceae
- Familie Woeseiaceae
- Ordnung Enterobacterales (zuvor als Ordnung „Enterobacteriales“ bezeichnet[14])
- Familie Budviciaceae
- Familie Enterobacteriaceae (mit Gattung Phytobacter)
- Familie Erwiniaceae
- Familie Hafniaceae
- Familie Morganellaceae
- Familie Pectobacteriaceae
- Familie Thorselliaceae
- Familie Yersiniaceae
- ohne zugewiesene Familie
- Ordnung Immundisolibacterales
- Familie Immundisolibacteraceae
- Ordnung Legionellales
- Familie Coxiellaceae
- Familie Legionellaceae
- Ordnung Lysobacterales
- Familie Lysobacteraceae
- Familie Rhodanobacteraceae
- Ordnung Methylococcales
- Familie Methylococcaceae
- Familie Methylothermaceae
- Ordnung Nevskiales (inklusive früherer Ordnung „Salinisphaerales“)
- Familie Algiphilaceae
- Familie Nevskiaceae
- Familie Salinisphaeraceae
- Familie Steroidobacteraceae
- Ordnung Oceanospirillales
- Familie Aestuariirhabdaceae
- Familie Alcanivoraceae
- Familie Balneatrichaceae
- Familie Endozoicomonadaceae
- Familie Hahellaceae
- Familie Halomonadaceae
- Familie Kangiellaceae
- Familie Litoricolaceae
- Familie Natronospirillaceae
- Familie Oceanospirillaceae
- Familie Oleiphilaceae
- Familie Saccharospirillaceae
- Ordnung Orbales
- Familie Orbaceae
- Ordnung Pasteurellales
- Familie Pasteurellaceae
- Familie Psittacicellaceae
- Ordnung Pseudomonadales
- Familie „Methanomonadaceae“
- Familie Moraxellaceae
- Familie Pseudomonadaceae
- Familie „Thiorhodaceae“
- Familie Ventosimonadaceae
- Ordnung Thiotrichales
- Familie Beggiatoaceae
- Familie Fastidiosibacteraceae
- Familie Francisellaceae
- Familie Piscirickettsiaceae
- Familie Thiolineaceae
- Familie Thiolineaceae
- Familie Thiotrichaceae
- Ordnung „Vibrionales“
- Familie Vibrionaceae
Klasse Hydrogenophilalia
- Ordnung Hydrogenophilales
- Familie Hydrogenophilaceae
Klasse Oligoflexia
- Ordnung Bacteriovoracales
- Familie Bacteriovoracaceae
- Familie Halobacteriovoraceae
- Familie Peredibacteraceae
- Ordnung Bdellovibrionales
- Familie Bdellovibrionaceae
- Ordnung Oligoflexales[15]
- Familie Oligoflexaceae
- Familie Pseudobacteriovoracaceae
- Ordnung Silvanigrellales[16]
- Familie Silvanigrellalaceae
Klasse „Zetaproteobacteria“
- Ordnung Mariprofundales
- Familie Mariprofundaceae (mit der bisher einzigen Gattung Mariprofundus)[17]
Phylum „Rhodothermaeota“
- Klasse Rhodothermia
- Ordnung Rhodotermales
- Familie Rhodothermaceae
- Familie Rubricoccaceae
- Familie Salinibacteraceae
- Familie Salisaetaceae Park
Phylum „Spirochaetae“
- Klasse Spirochaetes
- Ordnung Brachyspirales
- Familie Brachyspiraceae
- Ordnung Brevinematales
- Familie Brevinemataceae
- Familie „Longinemaceae“
- Ordnung Leptospirales
- Familie Borreliaceae
- Familie „Pillotinaceae“
- Familie Sphaerochaetaceae
- Familie Spirochaetaceae
- Familie Treponemataceae
- Familie Leptospiraceae
- Ordnung Spirochaetales
- Familie Borelliaceae
- Familie „Pillotinaceae“
- Familie Sphaerochaetaceae
- Familie Spirochaetaceae
- Familie Treponemataceae
Phylum „Synergistetes“
- Klasse Synergistia
- Ordnung Synergistales
- Familie Synergistaceae
Phylum „Tenericutes“
- Klasse Mollicutes
- Ordnung Acholeplasmatales
- Familie Acholeplasmataceae
- Ordnung Anaeroplasmatales
- Familie Anaeroplasmataceae
- Ordnung Entomoplasmatales
- Familie Entomoplasmataceae
- Familie Spiroplasmataceae
- Ordnung Haloplasmatales
- Familie Haloplasmataceae
- Ordnung Mycoplasmatales
- Familie Mycoplasmataceae
- Ordnung Mycoplasmoidales
- Familie Metamycoplasmataceae
- Familie Mycoplasmoidaceae
Phylum „Thermodesulfobacteria“
- Klasse Thermodesulfobacteria
- Ordnung Thermodesulfobacteriales
- Familie Thermodesulfobacteriaceae
Phylum „Thermomicrobia“
- Klasse Thermomicrobia
- Ordnung Sphaerobacterales
- Familie Sphaerobacteraceae
- Ordnung Thermomicrobiales
- Familie Thermomicrobiaceae
Phylum „Thermotogota“
Alternativ: „Synthermota“ oder „Thermotogaeota“
- Klasse Thermotogae
- Ordnung Kosmotogales
- Familie Kosmotogaceae
- Ordnung Mesoaciditogales
- Familie Mesoaciditogaceae
- Ordnung Petrotogales
- Familie Petrotogaceae
- Ordnung Thermotogales
- Familie Fervidobacteriaceae
- Familie Thermotogaceae
Phylum „Verrucomicrobia“
- Klasse Opitutae
- Ordnung Opitutales
- Familie Opitutaceae
- Ordnung Puniceicoccales
- Familie Puniceicoccaceae
- Klasse Terrimicrobia
- Ordnung Terrimicrobiales
- Familie „Chthoniobacteraceae“
- Familie Terrimicrobiaceae
- Ordnung Verrucomicrobiae
- Klasse Verrucomicrobiae
- Ordnung Verrucomicrobiales
- Familie Akkermansiaceae
- Familie Rubritaleaceae
- Familie Verrucomicrobiaceae
Taxa, deren Zuordnung nicht oder noch nicht zweifelsfrei feststeht
Die Taxonomie der Bakterien ist Gegenstand zahlreicher, laufender Veränderungen und Verbesserungen aufgrund neuer Erkenntnisse, die einen neutralen, beobachtenden Standpunkt verunmöglichen. Einige höhere Taxa wurden oben nicht berücksichtigt, bei anderen sind in näherer Zukunft Änderungen zu erwarten. Dieser Anhang enthält Kommentare zur Klärung, soweit bekannt:
Phyla bestätigter Gruppen
- Phylum Firmicutes: Die Stellung vieler Mitglieder dieses Phylums ist derzeit schlecht zu klären. Dabei spielt nicht nur historischer Ballast eine Rolle, sondern auch die eingeschränkten Möglichkeiten der phylogenetischen Analyse. Während einige Mitglieder aus nachvollziehbaren Gründen nur vollkommen falsch klassifiziert waren, kann man in einigen Bereichen weitgehende Änderungen nicht ausschließen. Diese betrifft unter anderem auch das Phylum Deferribacteres. Mit der fortschreitenden Analyse ganzer Genome wird möglicherweise weiter Klarheit geschaffen.
- Klasse „Bacilli“
- Ordnung Bacillales
- Familie Caryophanaceae: Sonstige Gründe
- Ordnung Bacillales
- Klasse „Clostridia“
- Ordnung Clostridiales
- Familie Oscillospiraceae: Die Typusgattung ist der Familie der Ruminococcaceae zugeordnet.
- Ordnung Clostridiales
- Klasse „Bacilli“
- Phylum Proteobacteria
- Klasse Gammaproteobacteria: Die Stellung vieler Mitglieder dieses Phylums ist derzeit schlecht zu klären. Dabei spielt nicht nur historischer Ballast eine Rolle, sondern auch die eingeschränkten Möglichkeiten der phylogenetischen Analyse.
- Klasse Deltaproteobacteria: Die Familie der Syntrophorhabdaceae ist dieser Klasse zugeordnet, aber bisher noch keiner Ordnung oder Unterordnung.
- Phylum Tenericutes: Dieses Phylum wurde zusätzlich zur Information der Sequenzen des 16S rRNA Gens durch Unterschiede weiterer phylogenetischer Marker und seine besonderen Eigenschaften von den Firmicutes abgegrenzt. Die Sequenzen des 16S rRNA Gens zeigen direkte Verwandtschaft zur Klasse/Ordnung der „Erysipelotrichi“.
- Phylum Verrucomicrobia
- Klasse
- Ordnung
- Familie Xiphinematobacteriaceae: Ein Typstamm konnte nicht isoliert werden (syntrophe Bakterien, Parasiten, Endosymbionten oder andere Gründe), daher nicht als Art, sondern als Candidatus definiert. Nach den derzeitigen Regeln des ICSB gibt es dafür keinen validierten Platz in der Taxonomie.[18] Vorläufig kein Eintrag.
- Ordnung
- Klasse
- Phylum „Calditrichaeota“: Eine weitere Einteilung in Ordnung und Familie fehlt derzeit (Dezember 2018) noch.
Kandidatengruppen aus Metagenomanalysen
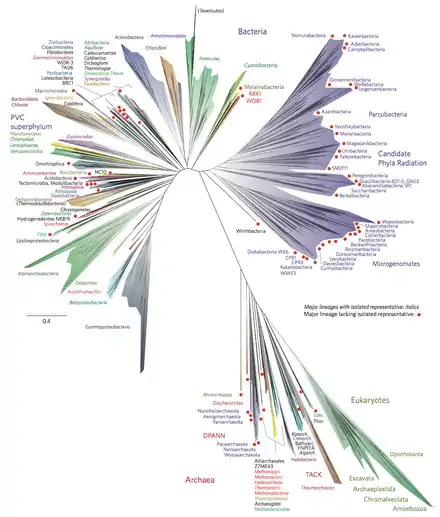
Metagenomanalysen aus verschiedenen Habitaten zeigen, dass die Systematik der kultivierbaren Bakterien auch mit den oben genannten Methoden immer noch ein sehr unvollständiges Bild des gesamten Spektrums liefert. Kleine Formen von Bakterien (und Archaeen) mit langsamem Stoffwechsel blieben bisher unberücksichtigt, machen aber einen großen Anteil im Boden wie auch in den Ozeanen und Süßgewässern aus. Unter Berücksichtigung der vorläufigen Ergebnisse dieser Analysen wurde ein erheblich erweiterter Stammbaum vorgeschlagen.[19][20] Es wird vermutet, dass es diese 15 % der gesamten bakteriellen Diversität ausmachen und aus mehr als 35[21] bis 70[22] verschiedenen Phyla bestehen.
- „Microgenomates“ / OP11[23]
- Es wurde ursprünglich angenommen, dass die „Mikrogenomates“ ein einzelnes Phylum bilden. Tatsächlich gibt es aber Hinweise, dass diese Gruppe über 11 bakterielle Phyla umfasst,[24][25] einschließlich „Curtissbacteria“, „Daviesbacteria“, „Levybacteria“, „Gottesmanbacteria“, „Woesebacteria“, „Amesbacteria“, „Shapirobacteria“, „Roizmanbacteria“, „Beckwithbacteria“, „Collierbacteria“ und „Pacebacteria“. Nach neueren Untersuchungen stehen die „Woykebacteria“ basal in den „Microgenomates“.[22][26] Die Gruppe wurde ursprünglich mit dem Akronym OP11 nach dem Fundort Obsidian Pool (44,6101° N, 110,4388° W) im Yellowstone-Nationalpark benannt.
- Auch die Gruppe der „Parcubacteria“ wurde ursprünglich als ein einziges Phylum von Kandidaten mit einer 16S-rRNA von weniger als 100 Nukleotiden beschrieben. Inzwischen steht aber eine viel größere Vielfalt an solchen 16S rRNA-Sequenzen aus Genomanalysen unkultivierter Organismen zur Verfügung. Man schätzt daher, dass diese Gruppe aus bis zu 28 bakteriellen Phyla bestehen könnte.[29] Passend dazu sind jetzt bereits über 14 Phyla innerhalb dieser Gruppe der Parcubakterien beschrieben worden,[24][25] einschließlich „Kaiserbacteria“, „Adlerbacteria“, „Campbellbacteria“, „Nomurabacteria“, „Giovannonibacteria“, „Wolfebacteria“, „Jorgensenbacteria“, „Yanofskybacteria“, „Azambacteria“, „Moranbacteria“, „Uhrbacteria“ und „Magasanikbacteria“. Nach neueren Untersuchungen gehören etliche weitere Kandidatenphyla zu dieser Gruppe, wie die „Brownbacteria“, die „Hugbacteria“[22] und die „Azambacteria“ (letztere sind offenbar nicht monophyletisch und wurden daher aufgespalten);[25] die Gruppe selbst wurde aufgeteilt in vier größere (und weitere kleinere) Untergruppen „Parcubacteria 1“ bis „Parcubacteria 4“.[30]
- „Patescibacteria“ / CPR
- CPR (englisch Canditade Phyla radiation) ist ein beschreibender Begriff, der sich auf eine monophyletische Gruppe (Klade) von Kandidaten-Phyla innerhalb der Domäne der Bakterien bezieht.[31]
- Da die CPR-Mitglieder bisher bis auf wenige Ausnahmen nicht kultivierbar sind,[32] können sie nicht formell in die bakterielle Taxonomie aufgenommen werden. Für eine Reihe von provisorischen oder Kandidatennamen besteht jedoch bereits eine allgemeine Übereinkunft.[33]
- Die „Patescibacteria“ wurden ursprünglich als Superphylum vorgeschlagen, um die Gruppen der „Microgenomates“ (OP11), „Parcubacteria“ (OD1) und „Gracilibacteria“ (GNO2/BD1-5) zusammenzufassen.
- Neuere phylogenetische Analysen zeigen, dass der letzte gemeinsame Vorfahre dieser Taxa derselbe Knoten ist wie der der CPR.[31]
- Die „Peregrinibacteria“ scheinen eher mit den „Gracilibacteria“ eine gemeinsame Klade innerhalb von CPR zu bilden, als den „Parcubacteria“ anzugehören.
- Die „Saccharibacteria“ (TM7)[34][32][35] könnten ähnlich eher mit den „Berkalbacteria“ eine gemeinsame Klade bilden, als den „Parcubacteria“ anzugehören. Das anfangs benutzte für diese Gruppe benutzte Akronym TM7 leitet sich ab von „Torf, Mittlere Schicht“. Dies ist die erste Gruppe der CPR, bei denen die Isolation von Vertretern gelang.
- Die „Dojkabacteria“ (WS6) und die „Katanobacteria“ (WWE3) könnten in beide in einer basalen Position (d. h. ohne weitere Zuordnung) noch CPR angehören.[22][36][30] WS ist Akronym für Wurtsmith contaminated aquifer.
- „Wirthbacteria“
- „Wirthbacteria“ ist ein vorgeschlagenes Bakterienphylum, der nur eine bekannte Stichprobe aus dem Aquifer des Kaltwassergeysirs Crystal Geyser, der Spezies „Wirthibacter wanneri“. Dieses Bakterium steht in einer basalen Position zur CPR-Gruppe (Candidate Phyla Radiation), wird aber nicht als Teil dieser Gruppe angesehen.[37] Diese Bakterien wurden durch Genomanalyse identifiziert und konnten bisher noch nicht kultiviert werden.[38][39] Sie weisen einige Merkmale wie die Mitglieder der CPR-Gruppe auf wie z. B. geringe Größe, fehlende Atmungsketten, reduzierter Stoffwechsel, niedrige Nukleotid- und Aminosäuresynthese usw., und stehen dieser Gruppe daher nahe.[40] Die letzten drei genannten Merkmale erschweren die Kultivierung dieser Bakterien.
- „Planctobacteria“ / PVC
- Die „Planctobacteria“ (auch als PVC-Gruppe bezeichnet, benannt nach den Mitgliedsphyla „Planctomycetes“, „Verrucomicrobia“ und „Chlamydiae“) umfasst insgesamt folgende Phyla: „Chlamydiae“, „Lentisphaerae“, „Omnitrophica“, „Planctomycetes“, „Poribacteria“ und „Verrucomicrobia“.[33][41]
- „Sphingobacteria“ / FCB
- Die „Sphingobacteria“ (auch als FCB-Gruppe bezeichnet, benannt nach den Mitgliedsphyla „Fibrobacteres“, „Chlorobi“ und „Bacteroidetes“) umfassen insgesamt folgende Phyla: „Bacteroidetes“, „Calditrichaeota“, „Chlorobi“ inklusive des möglichen Synonyms „Ignavibacteriae“, „Cloacimonetes“, „Fibrobacteres“, „Gemmatimonadetes“, „Latescibacteria“, „Marinimicrobia“ und „Zixibacteria“.[33][41]
- Die Bezeichnung „Sphingobacteria“ wird nach LPSN teilweise als Synonym für das Teilphylum „Bacteroidetes“ verwendet.
- „Terrabacteria“
- Das vorgeschlagene Superphylum „Terrabacteria“ umfasst die Phyla „Actinobacteria“, „Armatimonadetes“ (OP10), „Cyanobacteria“, „Deinococcus–Thermus“, „Chloroflexi“ und „Firmicutes“.[42][43][33][41]
- Es wurde vorgeschlagen, dass einige Mitgliedsklassen aus bisherigen Phylum „Proteobacteria“ als eigenständige Phyla anzuerkennen, was die „Proteobacteria“ in den Rang eines Superphylums erheben würde.[29] Zudem bildet das bisherige Phylum der Deltaproteobakteria keine konsistente monophyletische Abstammungslinie mit den anderen Klassen der „Proteobakteria“.[38]
- „kryptische Superphyla“

- Mehrere Kandidaten-Phyla („Microgenomates“, „Omnitrophica“, „Parcubacteria“ und Saccharibacteria) und mehrere akzeptierte Phyla („Elusimicrobia“, „Caldiserica“ und „Armatimonadetes“) wurden vorgeschlagen, in den Rang von Superphyla zu erheben, die fälschlicherweise als Phyla beschrieben wurden, weil Regeln zur Definition eines Bakterienphylums fehlen (und erst recht eines Superphylums), oder weil aufgrund einer ursprünglich mangelnden Sequenzvielfalt in den Gendatenbanken zu dem Zeitpunkt, als das betreffende Phylum etabliert wurde. So wird z. B. vorgeschlagen, dass der zunächst als Phylum vorgeschlagene Kandidat „Parcubacteria“ in Wirklichkeit ein Superphylum ist, das 28 untergeordnete Phyla umfasst,[29] mit vier größeren Untergruppen „Parcubacteria 1“ bis „Parcubacteria 4“ (s. o.).[30] Ebenso ist das Phylum „Elusimicrobia“ in Wirklichkeit eher ebenfalls ein Superphylum, das 7 untergeordnete Phyla umfasst.[29] Die CPR-Gruppe wäre dann konsequenterweise in den Rang eines Reichs oder wenigstens Unterreichs (en. infrakingdom) zu erheben.
Liste von CPR und Verwandte
Anbei eine vorläufige Systematik der vorgeschlagenen Phyla von CPR und naher Verwandter. Die Zuordnung zu Microgenomates, Parcubacteria und weitere folgt dabei Jaffe (2020).[30]
- „Microgenomates“ (OP11) [en] – nach Brown et al. (2015),[24] bis auf „Blackburnbacteria“, „Chisholmbacteria“ und „Woykebacteria“:
- Den „Microgenomates“ nahestehend:
- „Parcubacteria“ (OD1) – nach Brown et al. (2015), Fig. S2a,[24] und – markiert mit [*] – Anantharaman et al. (Okt. 2016),[25] bis auf „Brownbacteria“, „Hugbacteria“, „Gribaldobacteria“ und „Torokbacteria“:
- „Parcubacteria 1“[30]
- „Buchananbacteria“ (RIF37) [*]
- „Falkowbacteria“
- „Jacksonbacteria“ (RIF38) [*]
- „Kerfeldbacteria“ (RIF4) [*]
- „Komeilibacteria“ (RIF6) [*] (gelegentliche Fehlschreibung als „Komelilbacteria“[25])
- „Kuenenbacteria“
- „Magasanikbacteria“[44]
- „Uhrbacteria i“ (offenbar polyphyletisch, gesplittet, ad-hoc-Nummerierung hier)[30]
- „Uhrbacteria ii“[30]
- Den „Parcubacteria 1“ nahestehend:
- „Doudnabacteria“ (SM2F11)[24] [*]
- Ebenso, aber nicht bei Jaffe et al. (2020) aufgeführt:
- „Veblenbacteria“ (RIF39) [*]
- „Parcubacteria 2“[30]
- „Gribaldobacteria“[30]
- „Nealsonbacteria“ (RIF40) [*]
- „Staskawiczbacteria“ (RIF20) [*]
- „Spechtbacteria“ (RIF19) [*]
- „Terrybacteria“ (RIF13) [*]
- „Wildermuthbacteria“ (RIF21) [*]
- „Parcubacteria 3“[30]
- „Brennerbacteria“ (RIF18) [*]
- „Colwellbacteria“ (RIF41) [*]
- „Harrisonbacteria“ (RIF43) [*]
- „Jorgensenbacteria“
- „Liptonbacteria“ (RIF42) [*]
- „Wolfebacteria“
- „Parcubacteria 4“[30]
- „Adlerbacteria“
- „Campbellbacteria i“ (offenbar polyphyletisch, gesplittet, ad-hoc-Nummerierung hier)[30]
- „Campbellbacteria ii“[30]
- „Kaiserbacteria“
- „Lloydbacteria“ (RIF45) [*]
- „Nomurabacteria“ [en]
- „Taylorbacteria“ (RIF16) [*]
- „Vogelbacteria“ (RIF14) [*]
- „Yonathbacteria“ (RIF44) [*]
- „Zambryskibacteria“ (RIF15) [*]
- Den „Parcubacteria 4“ nahestehend:
- „Giovannonibacteria“
- „Ryanbacteria“ (RIF10) [*]
- „Sungbacteria“ (RIF17) [*]
- „Tagabacteria“ (RIF12) [*]
- Ebenso, aber nicht bei Jaffe et al. (2020) aufgeführt:
- „Andersenbacteria“ (RIF9) [*]
- „Niyogibacteria“ (RIF11) [*]
- „Portnoybacteria“ (RIF22) [*]
- Nicht-klassifizierte „Parcubacteria“:
- Saccharibacteria-Berkelbakteria-Klade – nach Jaffe et al.(2020),[30] bis auf „Lindowbacteria“:
- „Berkelbacteria“ (ACD58) [en][47]
- „Howlettbacteria“[30]
- „Kazanbacteria“ (3B-28)[30][48]
- „Saccharibacteria“ (TM7) [en][33][49]
- ebenso, aber nicht bei Jaffe et al. (2020) aufgeführt:
- „Lindowbacteria“ (RIF2)[25]
- Gracilibacteria-Absconditabacteria-Peregrinibacteria-Klade – nach Jaffe et al.(2020),[30] bis auf „Fertabacteria“:
- Ebenso, aber nicht bei Jaffe et al. (2020) aufgeführt:
Einzelnachweise
- Carl R. Woese, G. E. Fox: Phylogenetic structure of the prokaryotic domain: the primary kingdoms. In: Proceedings of the National Academy of Sciences of the United States of America. Band 74, Nr. 11, November 1977, S. 5088–5090, ISSN 0027-8424, PMID 270744, PMC 432104 (freier Volltext)
- Carl R. Woese, O. Kandler, M. L. Wheelis: Towards a natural system of organisms: proposal for the domains Archaea, Bacteria, and Eucarya, in: Proceedings of the National Academy of Sciences. Band 87, Nr. 12, Juni 1990, S. 4576–4579, ISSN 0027-8424, doi:10.1073/pnas.87.12.4576, PMID 2112744i PMC 54159 (freier Volltext)
- B. J. Tindall, P. Kämpfer, J. P. Euzéby, A. Oren: Valid publication of names of prokaryotes according to the rules of nomenclature: past history and current practice. In: International Journal of Systematic and Evolutionary Microbiology. Band 56, Nr. 11, November 2006, S. 2715–2720, ISSN 1466-5026, doi:10.1099/ijs.0.64780-0, PMID 17082418
- J. P. Euzéby: List of bacterial names with standing in nomenclature: a folder available on the Internet. In: International Journal of Systematic Bacteriology. Band 47, 1997, S. 590–592, PMID 9103655
- S. P. Lapage, P. H. A. Sneath, E. F. Lessel, V. B. D. Skerman, H. P. R. Seeliger, W. A. Clark (Hrsg.): International Code of Nomenclature of Bacteria – Bacteriological Code, 1990 Revision. ASM Press, Washington (DC), USA 1992, ISBN 1-55581-039-X (online).
- Carl R. Woese, E. Stackebrandt, T. J. Macke, G. E. Fox: A phylogenetic definition of the major eubacterial taxa, in: Systematic and Applied Microbiology. Band 6, 1985, S. 143–151, ISSN 0723-2020, PMID 11542017
- P. Mattarelli, W. Holzapfel at al.: Recommended minimal standards for description of new taxa of the genera Bifidobacterium, Lactobacillus and related genera. In: International Journal of Systematic and Evolutionary Microbiology. Band 64, Nr. 4, April 2014, S. 1434–1451, ISSN 1466-5026, doi:10.1099/ijs.0.060046-0
- Bergey's Manual Trust, Department of Microbiology, 527 Biological, Sciences Building, University of Georgia, Athens, GA 30602-2605, USA
- W. Ludwig at al.: ARB: a software environment for sequence data. In: Nucleic Acids Research. Band 32, Nr. 4, 2004, S. 1363–1371, ISSN 1362-4962, doi:10.1093/nar/gkh293, PMID 14985472, PMC 390282 (freier Volltext)
- E. Pruesse, C. Quast et al.: SILVA: a comprehensive online resource for quality checked and aligned ribosomal RNA sequence data compatible with ARB, in: Nucleic Acids Research. Band 35, Nr. 21, 2007, S. 7188–7196, ISSN 1362-4962, doi:10.1093/nar/gkm864, PMID 17947321, PMC 2175337 (freier Volltext)
- Pablo Yarza, M. Richter, J. Peplies, J. Euzéby, R. Amann, K. H. Schleifer, W. Ludwig, F. O. Glöckner, R. Rosselló-Móra: The All-Species Living Tree project: a 16S rRNA-based phylogenetic tree of all sequenced type strains, in: Systematic and Applied Microbiology. Band 31, Nr. 4, September 2008, S. 241–250, ISSN 0723-2020, doi:10.1016/j.syapm.2008.07.001, PMID 18692976
- LPSN: Domain, §"Bacteria"
- K. P. Williams, D. P. Kelly: Proposal for a new class within the phylum Proteobacteria, Acidithiobacillia classis nov., with the type order Acidithiobacillales, and emended description of the class Gammaproteobacteria. In: International Journal of Systematic and Evolutionary Microbiology. Nr. 63, August 2013, S. 2901–2906, doi:10.1099/ijs.0.049270-0.
- M. Adeolu, S. Alnajar, S. Naushad, R. S. Gupta: Genome-based phylogeny and taxonomy of the ‘Enterobacteriales’: proposal for Enterobacterales ord. nov. divided into the families Enterobacteriaceae, Erwiniaceae fam. nov., Pectobacteriaceae fam. nov., Yersiniaceae fam. nov., Hafniaceae fam. nov., Morganellaceae fam. nov., and Budviciaceae fam. nov. In: International Journal of Systematic and Evolutionary Microbiology. Nr. 66, Dezember 2016, S. 5575–5599, doi:10.1099/ijsem.0.001485.
- R. Nakai, M. Nishijima, N. Tazato, Y. Handa, F. Karray, S. Sayadi, H. Isoda, T. Naganuma: Oligoflexus tunisiensis gen. nov., sp. nov., a Gram-negative, aerobic, filamentous bacterium of a novel proteobacterial lineage, and description of Oligoflexaceae fam. nov., Oligoflexales ord. nov. and Oligoflexia classis nov. In: International Journal of Systematic and Evolutionary Microbiology. Nr. 64, Oktober 2014, S. 3353–3359, doi:10.1099/ijs.0.060798-0.
- Martin W. Hahn, Johanna Schmidt, Ulrike Koll, Manfred Rohde, Susanne Verbarg, Alexandra Pitt, Ryosuke Nakai, Takeshi Naganuma, Elke Lang: Silvanigrella aquatica gen. nov., sp. nov., isolated from a freshwater lake, description of Silvanigrellaceae fam. nov. and Silvanigrellales ord. nov., reclassification of the order Bdellovibrionales in the class Oligoflexia, reclassification of the families Bacteriovoracaceae and Halobacteriovoraceae in the new order Bacteriovoracales ord. nov., and reclassification of the family Pseudobacteriovoracaceae in the order Oligoflexales. In: International Journal of Systematic and Evolutionary Microbiology. Nr. 67, August 2017, S. 2555–2568, doi:10.1099/ijsem.0.001965.
- David Emerson, Jeremy A. Rentz, Timothy G. Lilburn, Richard E. Davis, Henry Aldrich, Clara Chan, Craig L. Moyer, Anna-Louise Reysenbach: A Novel Lineage of Proteobacteria Involved in Formation of Marine Fe-Oxidizing Microbial Mat Communities. In: PLoS ONE. Band 2, Nr. 8, August 2007, S. e667, doi:10.1371/journal.pone.0000667.
- P. De Vos, H. G. Trüper: Judicial Commission of the International Committee on Systematic Bacteriology. IXth International (IUMS) Congress of Bacteriology and Applied Microbiology. Minutes of the meetings, 14, 15 and 18 August 1999, Sydney, Australia. In: International Journal of Systematic and Evolutionary Microbiology. Band 50, 2000, S. 2239–2244.
- Two Major Microbial Groups Discovered That Can’t Breathe – May Predate the Evolution of Respiration. Auf: SciTechDaily vom 31. August 2020, Quelle: Bigelow Laboratory for Ocean Science.
- Jacob P. Beam, Eric D. Becraft, Julia M. Brown, Frederik Schulz, Jessica K. Jarett, Oliver Bezuidt, Nicole J. Poulton, Kayla Clark, Peter F. Dunfield, Nikolai V. Ravin, John R. Spear, Brian P. Hedlund, Konstantinos A. Kormas, Stefan M. Sievert, Mostafa S. Elshahed, Hazel A. Barton, Matthew B. Stott, Jonathan A. Eisen, Duane P. Moser, Tullis C. Onstott, Tanja Woyke, Ramunas Stepanauskas: Ancestral Absence of Electron Transport Chains in Patescibacteria and DPANN. In: Frontiers in Microbiology. Band 11, 2020, doi:10.3389/fmicb.2020.01848.
- Donovan H. Parks, Christian Rinke, Maria Chuvochina, Pierre-Alain Chaumeil, Ben J. Woodcroft, Paul N. Evans, Philip Hugenholtz, Gene W. Tyson: Recovery of nearly 8,000 metagenome-assembled genomes substantially expands the tree of life. In: Nature Microbiology. Band 2, S. 1533–1542, 11. September 2017, doi:10.1038/s41564-017-0012-7, mit Korrektur vom 12. Dezember 2017, doi:10.1038/s41564-017-0083-5
- Robert E. Danczak, M. D. Johnston, C. Kenah, M. Slattery, K. C. Wrighton, M. J. Wilkins: Members of the candidate phyla radiation are functionally differentiated by carbon- and nitrogen-cycling capabilities. In: Microbiome. Band 5, Nr. 1, September 2017, S. 112. doi:10.1186/s40168-017-0331-1. PMID 28865481. PMC 5581439 (freier Volltext).
- Philip Hugenholtz, Brett M. Goebel, Norman R. Pace: Impact of Culture-Independent Studies on the Emerging Phylogenetic View of Bacterial Diversity. In: Journal of Bacteriology. Band 180, Nr. 24, 15. Dezember 1998, ISSN 1098-5530, S. 4765–4774. doi:10.1128/jb.180.24.6793-6793.1998. PMID 9733676. PMC 107498 (freier Volltext).
- Christopher T. Brown, Laura A. Hug, Brian C. Brown, Itai Sharon, Cindy J. Castelle, Kenneth H. Williams, Jillian F. Banfield: Unusual biology across a group comprising more than 15% of domain Bacteria. In: Nature. Band 523, Nr. 7559, 2015, ISSN 1476-4687, S. 208–211. bibcode:2015Natur.523..208B. doi:10.1038/nature14486. PMID 26083755.
- Karthik Anantharaman, Christopher T. Brown, Laura A. Hug, Itai Sharon, Cindy J. Castelle, Alexander J. Probst, Brian C. Thomas, Andrea Singh, Michael J. Wilkins, Ulas Karaoz, Eoin L. Brodie: Thousands of microbial genomes shed light on interconnected biogeochemical processes in an aquifer system. In: Nature Communications. Band 7, Nr. 1, 24. Oktober 2016, ISSN 2041-1723, S. 13219. bibcode:2016NatCo...713219A. doi:10.1038/ncomms13219. PMID 27774985. PMC 5079060 (freier Volltext).
- NCBI: Candidatus Woykebacteria (phylum)
- J. Kirk Harris, Scott T. Kelley, Norman R. Pace: New Perspective on Uncultured Bacterial Phylogenetic Division OP11. In: Applied and Environmental Microbiology. Band 70, Nr. 2, Februar 2004, ISSN 0099-2240, S. 845–849. doi:10.1128/AEM.70.2.845-849.2004. PMID 14766563. PMC 348892 (freier Volltext).
- LinkFang: Parcubacteria (spanisch)
- Pablo Yarza, Pelin Yilmaz, Elmar Pruesse, Frank Oliver Glöckner, Wolfgang Ludwig, Karl-Heinz Schleifer, William B. Whitman, Jean Euzéby, Rudolf Amann, Ramon Rosselló-Móra: Uniting the classification of cultured and uncultured bacteria and archaea using 16S rRNA gene sequences. In: Nature Reviews Microbiology. Band 12, Nr. 9, September 2014, ISSN 1740-1534, S. 635–645. doi:10.1038/nrmicro3330. PMID 25118885.
- Alexander L. Jaffe, Cindy J. Castelle, Paula B. Matheus Carnevali, Simonetta Gribaldo, Jillian F. Banfield: The rise of diversity in metabolic platforms across the Candidate Phyla Radiation. In: BMC Biology. Band 18, Nr. 69, Juni 2020 (@BMC, doi:10.1186/s12915-020-00804-5, Fig. S2).
- Cindy J. Castelle, Jillian F. Banfield: Major New Microbial Groups Expand Diversity and Alter our Understanding of the Tree of Life. In: Cell. Band 172, Nr. 6, März 2018, S. 1181–1197. doi:10.1016/j.cell.2018.02.016. PMID 29522741.
- X. He, J. S. McLean, A. Edlund, S. Yooseph, A. P. Hall, S. Y. Liu et al.: Cultivation of a human-associated TM7 phylotype reveals a reduced genome and epibiotic parasitic lifestyle. In: Proceedings of the National Academy of Sciences of the United States of America. (PNAS) Band 112, 2015, S. 244–249, doi:10.1073/pnas.1419038112.
- C. Rinke et al.: Insights into the phylogeny and coding potential of microbial dark matter. In: Nature. Band 499, Nr. 7459, 2013, S. 431–437. bibcode:2013Natur.499..431R. doi:10.1038/nature12352. PMID 23851394.
- Jeffrey S. McLean, Batbileg Bor, Thao T. To, Quanhui Liu, Kristopher A. Kerns, Lindsey Solden, Kelly Wrighton, Xuesong He, Wenyuan Shi: Evidence of independent acquisition and adaption of ultra-small bacteria to human hosts across the highly diverse yet reduced genomes of the phylum Saccharibacteria (Host Adaptation of the Saccharibacteria Phylum), auf: bioRxiv (PrePrint), 2. Februar 2018, doi:10.1101/258137.
- Jeffrey S. McLean, Batbileg Bor, Kristopher A. Kerns, Quanhui Liu, Thao T. To, Lindsey Solden, Erik L. Hendrickson, Kelly Wrighton, Wenyuan Shi, Xuesong He: Acquisition and Adaptation of Ultra-small Parasitic Reduced Genome Bacteria to Mammalian Hosts. In: Cell Reports. Band 32, Nr. 3, 21. Juli 2020, 107939, doi:10.1016/j.celrep.2020.107939
- Sonda Guermazi, Patrick Daegelen, Catherine Dauga, Delphine Rivière, Théodore Bouchez, Jean Jacques Godon, Gábor Gyapay, Abdelghani Sghir, Eric Pelletier, Jean Weissenbach, Denis Le Paslier: Discovery and characterization of a new bacterial candidate division by an anaerobic sludge digester metagenomic approach. In: Environmental Microbiology. Band 10, Nr. 8, August 2008, ISSN 1462-2912, S. 2111–2123. doi:10.1111/j.1462-2920.2008.01632.x. PMID 18459975. PMC 2702496 (freier Volltext).
- A. J. Probst, C. J. Castelle, A. Singh, C. T. Brown, K. Anantharaman, I. Sharon, L. A. Hug, D. Burstein, J. B. Emerson, B. C. Thomas, J. F. Banfield: Genomic resolution of a cold subsurface aquifer community provides metabolic insights for novel microbes adapted to high CO2 concentrations.. In: Environmental Microbiology. Band 19, Nr. 2, Februar 2017, S. 459–474. doi:10.1111/1462-2920.13362. PMID 27112493.
- Laura A. Hug, Brett J. Baker, Karthik Anantharaman, Christopher T. Brown, Alexander J. Probst, Cindy J. Castelle, Cristina N. Butterfield, Alex W. Hernsdorf, Yuki Amano, Kotaro Ise, Yohey Suzuki, Natasha Dudek, David A. Relman, Kari M. Finstad, Ronald Amundson, Brian C. Thomas, Jillian F. Banfield: A new view of the tree of life. In: Nature Microbiology. Band 16048, Nr. 5, April 2016, S. 16048. doi:10.1038/nmicrobiol.2016.48. PMID 27572647. PDF
- B. J. Tully, R. Sachdeva, E. D. Graham, J. F. Heidelberg: 290 Metagenome-assembled Genomes from the Mediterranean Sea: Ongoing Effort to Generate Genomes from the Tara Oceans Dataset Auf: biorxiv.org vom 16. April 2016, Artikel 069484.
- Charlotte D. Vavourakis, Adrian-Stefan Andrei, Maliheh Mehrshad, Rohit Ghai, Dimitry Y. Sorokin, Gerard Muyzer: A metagenomics roadmap to the uncultured genome diversity in hypersaline soda lake sediments. In: Microbiome. Band 6, Nr. 168, Springer, 19. September 2018, doi:10.1186/s40168-018-0548-7
- Y. Sekiguchi et al.: First genomic insights into members of a candidate bacterial phylum responsible for wastewater bulking. In: PeerJ. Band 3, 2015, S. e740. doi:10.7717/peerj.740. PMID 25650158. PMC 4312070 (freier Volltext).
- F. U. Battistuzzi, A. Feijao, S. B. Hedges: A genomic timescale of prokaryote evolution: insights into the origin of methanogenesis, phototrophy, and the colonization of land. In: BMC Evolutionary Biology. Band 4, November 2004, S. 44. doi:10.1186/1471-2148-4-44. PMID 15535883. PMC 533871 (freier Volltext).
- F. U. Battistuzzi, S. B. Hedges: A Major Clade of Prokaryotes with Ancient Adaptations to Life on Land. In: Molecular Biology and Evolution. Band 26, Nr. 2, 6. November 2008, S. 335–343. doi:10.1093/molbev/msn247. PMID 18988685.
- NCBI: Candidatus Magasanikbacteria (phylum)
- LPSN: Phylum "Candidatus Parcunitrobacteria"
- Cindy J. Castelle, Christopher T. Brown, Brian C. Thomas, Kenneth H. Williams, Jillian F. Banfield: Unusual respiratory capacity and nitrogen metabolism in a Parcubacterium (OD1) of the Candidate Phyla Radiation. In: Scientific Reports. Band 7, 40101, 9. Januar 2017, doi:10.1038/srep40101
- Kelly C. Wrighton, Cindy J. Castelle, Michael J. Wilkins, Laura A. Hug, Itai Sharon, Brian C. Thomas, Kim M. Handley, Sean W. Mullin, Carrie D. Nicora, Andrea Singh, Mary S. Lipton: Metabolic interdependencies between phylogenetically novel fermenters and respiratory organisms in an unconfined aquifer. In: The ISME Journal. Band 8, Nr. 7, Juli 2014, ISSN 1751-7370, S. 1452–1463. doi:10.1038/ismej.2013.249. PMID 24621521. PMC 4069391 (freier Volltext).
- UniProt: candidate division Kazan-3B-28
- H. Rheims, F. A Rainey, E. Stackebrandt: A molecular approach to search for diversity among bacteria in the environment. In: Journal of Industrial Microbiology & Biotechnology. Band 17, Nr. 3–4, September 1996, ISSN 0169-4146, S. 159–169. doi:10.1007/bf01574689.
- Ruth E. Ley, J. Kirk Harris, Joshua Wilcox, John R. Spear, Scott R. Miller, Brad M. Bebout, Julia A. Maresca, Donald A. Bryant, Mitchell L. Sogin, Norman R. Pace: Unexpected Diversity and Complexity of the Guerrero Negro Hypersaline Microbial Mat. In: Applied and Environmental Microbiology. Band 72, Nr. 5, 1. Mai 2006, ISSN 0099-2240, S. 3685–3695. doi:10.1128/AEM.72.5.3685-3695.2006. PMID 16672518. PMC 1472358 (freier Volltext).
- K. C. Wrighton, B. C. Thomas, I. Sharon, C. S. Miller, C. J. Castelle, N. C. VerBerkmoes, M. J. Wilkins, R. L. Hettich, M. S. Lipton, K. H. Williams, P. E. Long: Fermentation, Hydrogen, and Sulfur Metabolism in Multiple Uncultivated Bacterial Phyla. In: Science. Band 337, Nr. 6102, 27. September 2012, ISSN 0036-8075, S. 1661–1665. bibcode:2012Sci...337.1661W. doi:10.1126/science.1224041. PMID 23019650.
- NCBI: Candidatus Peregrinibacteria (phylum)
- UniProt: Taxonomy - Candidatus Peregrinibacteria (PHYLUM)
- Karthik Anantharaman, Christopher T. Brown, David Burstein, Cindy Castelle: Analysis of five complete genome sequences for members of the class Peribacteria in the recently recognized Peregrinibacteria bacterial phylum. In: PeerJ. Band 4, Nr. 8, Artikel e1607, Januar 2016, doi:10.7717/peerj.1607.
- Natasha K. Dudek, Christine L. Sun, David Burstein, Rose S. Kantor, Daniela S. Aliaga Goltsman, Elisabeth M. Bik, Brian C. Thomas, Jillian F. Banfield, David A. Relman: Novel Microbial Diversity and Functional Potential in the Marine Mammal Oral Microbiome. In: Current Biology. Band 27, Nr. 24, 18. Dezember 2017, ISSN 0960-9822, S. 3752–3762.e6. doi:10.1016/j.cub.2017.10.040. PMID 29153320.-->
Weblinks
- International Journal of Systematic and Evolutionary Microbiology
- List of Prokaryotic names with Standing in Nomenclature
- Bergey's Manual
- Rosa León-Zayas, Logan Peoples, Jennifer F. Biddle, Sheila Podell, Mark Novotny, James Cameron, Roger S. Lasken, Douglas H. Bartlett: [The metabolic potential of the single cell genomes obtained from the Challenger Deep, Mariana Trench within the Candidate Superphylum Parcubacteria (OD1)], in: Environ Microbiol. 19(7), S. 2769–2784, online 22. Juni 2017, doi:10.1111/1462-2920.13789, PMC 5524542 (freier Volltext), PMID 28474498 (Magasanikbacteria ist verschrieben zu Magadsanikbacteria)