Thermostabilität
Die Thermostabilität bezeichnet in der Chemie und insbesondere Organik und Biochemie die Eigenschaft einer Verbindung, relativ hohe Temperaturen zu überstehen (molekulare Hitzebeständigkeit). Das Gegenteil der Thermostabilität ist die Thermolabilität. Diese Thermostabilität bezieht sich dabei vor allem auf die Struktur des Moleküls, wird jedoch auch anwendungsspezifisch über die Fähigkeit zur Ausübung einer bestimmten Funktion definiert.
Thermostabilität von Kunststoffen
Thermoplastische Kunststoffe werden zur Verarbeitung erhitzt. Damit sie sich dabei nicht zersetzen werden Additive zugesetzt, die dies verhindern.
Beispielsweise werden Polyvinylchlorid eigene Stabilisatoren zugesetzt, um die Thermostabilität während der Verarbeitung zu erhöhen und die Witterungs- und Alterungsbeständigkeit zu verbessern. Dazu werden Verbindungen, beispielsweise Stearate oder Carboxylate[1] auf Basis von Schwermetallen wie Blei, Cadmium, Zinn, Barium/Zink, Calcium/Zink und Calcium/Aluminium/Zink wie Cadmiumstearat oder Bleistearat, eingesetzt.[2] Im Aufschmelzprozess freiwerdendes Chlor, welches den Kunststoff zerstören würde (siehe dazu auch Chlor#Chemische Eigenschaften), zerstört die leicht spaltbaren Metallverbindungen, die dabei als "Säurefänger" wirken. Das freiwerdende Chlor wird also abgefangen und es bilden sich Metallchloride[3]. Cadmiumverbindungen als Stabilisator wurden 2001 von der EU verboten, bis 2015 sollen (laut einer Quelle aus 2010) auch Blei-Stabilisatoren ersetzt sein (freiwilliges Minderungsziel).[4] Derartige metallhältige Thermostabilisatoren können durch Hydrotalcit (ein Magnesium-Aluminium-Hydroxycarbonat) ersetzt werden.[3]
Thermostabilität von Proteinen
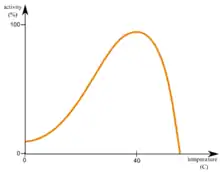
Der Begriff wird vor allem auf Biomoleküle und besonders Proteinstrukturen angewandt, da Proteine ihre Funktionsfähigkeit aufgrund der Denaturierung oft schon bei vergleichsweise niedrigen Temperaturen verlieren. Da in der Verfahrenstechnik jedoch höhere Temperaturen einen höheren Stoffumsatz ermöglichen (RGT-Regel) bzw. diese aus anderweitigen Gründen notwendig sind, um ein gewünschtes Reaktionsprodukt zu erhalten, kommt den thermostabilen Biomolekülen hier eine hohe Bedeutung zu. Ein Beispiel hierfür ist die Polymerase-Kettenreaktion, in der thermostabile DNA-Polymerasen von Organismen wie Thermus aquaticus genutzt werden. Organismen, die aufgrund ihrer thermostabilen Strukturen ein hohes Temperaturoptimum besitzen, werden als thermophil bezeichnet. Thermostabile Proteine besitzen zur zusätzlichen Stabilisierung ihrer Proteinfaltung oftmals eine kompakte Struktur und vermehrt Wasserstoffbrückenbindungen, Salzbrücken, Hydrolyse-unempfindlichere Aminosäuren und vergleichsweise hohe Affinitäten der Monomere eines Proteinkomplexes zueinander. Bei rekombinanten thermostabilen Proteinen wird oftmals bei der Proteinreinigung eine Hitzefällung verwendet, um alle anderen Proteine aus der Lösung auszufällen.
Da insbesondere Protein-basierte Toxine oftmals hitzelabil sind, können Toxine in thermostabile und thermolabile Toxine eingeteilt werden. Während thermolabile Toxine wie einige Lektine durch Erhitzen inaktiviert werden, überstehen thermostabile Toxine wie Amatoxine diese Behandlung ohne größere Verluste. Dies hat besondere Bedeutung für den Effekt des Garens von im Rohzustand toxischen Nahrungsmitteln (z. B. Kartoffeln, Bohnen, Linsen und manche Pilze).
Thermische Desinfektionsverfahren basieren auf der Überwindung der Thermostabilität der Proteine von Pathogenen.
Die Thermostabilität von Proteinen kann durch Protein-Engineering, durch Quervernetzung oder durch Kopplung an Polymere erhöht werden.[5]
Literatur
- Jeremy M. Berg, John L. Tymoczko, Lubert Stryer: Stryer Biochemie. 7. Auflage, Springer-Verlag, Berlin/Heidelberg 2013, ISBN 978-3-8274-2988-9.
- Michael T. Madigan, John M. Martinko: Brock Mikrobiologie 11. Auflage, Pearson Studium, München 2006, ISBN 3-8273-7187-2.
Einzelnachweise
- Zusatz (sic!) und Füllstoffe bei Kunststoffen, Website über Kunststoff-Technik, zuletzt abgerufen im Februar 2020
- Gesamtbericht Behandlungs- und Verwertungswege für PVC-Abfälle; Bundesministerium für Land- und Forstwirtschaft, Umwelt und Wasserwirtschaft, Wien, Dezember, 2002 (PDF-Datei), zuletzt abgerufen im Februar 2020
- Hans Jürgen Wernicke und Joachim Großmann: „Umweltfreundliche Stabilisierung von PVC durch synthetische Hydrotalcite“; Aktuelle Wochenschau der GDCh; 2008, zuletzt abgerufen im Februar 2020
- Vinyl 2010. Freiwillige Selbstverpflichtung der PVC-Industrie. The European Council of Vinyl Manufacturers (Industrieverband) (PDF-Datei), zuletzt abgerufen im Februar 2020
- E. P. DeBenedictis, E. Hamed, S. Keten: Mechanical Reinforcement of Proteins with Polymer Conjugation. In: ACS Nano. Band 10, Nummer 2, Februar 2016, S. 2259–2267, doi:10.1021/acsnano.5b06917, PMID 26687555.