Erythromycin
Erythromycin ist ein Stoffgemisch aus strukturell sehr ähnlichen Verbindungen, die von dem Bakterium Saccharopolyspora erythraea gebildet werden. Wegen seiner antibiotischen Wirkung wird Erythromycin als Arzneistoff verwendet.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
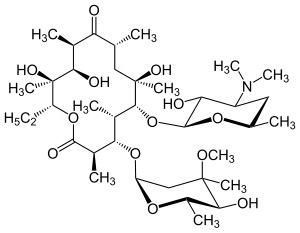 | ||||||||||||||||||||||
| Erythromycin A | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Erythromycin | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C37H67NO13 | |||||||||||||||||||||
| Kurzbeschreibung |
weißer bis gelber, kristalliner Feststoff[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse |
Makrolid-Antibiotikum | |||||||||||||||||||||
| Wirkmechanismus |
Hemmung der bakteriellen Proteinsynthese | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 733,93 g·mol−1 | |||||||||||||||||||||
| Dichte |
1,209 g/cm3[2] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| pKS-Wert |
8,6–8,8[3] | |||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Brechungsindex |
1,535[2] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||||||||
Die Hauptkomponente ist das Erythromycin A, daneben kommen bis zu 5 % Erythromycin B und in geringerer Menge Erythromycin C vor.[5] Chemisch zählt Erythromycin zu den Glycosiden, pharmakologisch gehört es zu den Makrolidantibiotika. Verwendet wird Erythromycin zur Behandlung von Infektionen mit grampositiven Keimen (Streptokokken, Staphylokokken), anaeroben Keimen (Propionibakterien, Corynebakterien) und Mykoplasmen.
Geschichte
1949 schickte der philippinische Wissenschaftler Abelardo Aguilar Bodenproben aus der Provinz Iloilo an seinen Arbeitgeber, das Pharmaunternehmen Lilly. Dort isolierte dann[6] eine Arbeitsgruppe unter James M. McGuire aus Kulturfiltraten Erythromycin als Stoffwechselprodukt von Streptomyces erythreus (heute Saccharopolyspora erythraea). Seit 1952 als Ilosone vermarktet erhielt Lilly 1953 das U.S. Patent 2,653,899 für diese Verbindung.[7] Weitere Handelsnamen waren Erycinum (Schering) und Erythromycin (Abbott). Die Totalsynthese des Erythromycins gelang Robert B. Woodward und Mitarbeitern 1981 ausgehend von 4-Benzyloxybuttersäure und Thian-4-on.[8][9][10]
Wirkungsmechanismus
Erythromycin hemmt den durch den Elongationsfaktor EF-G katalysierten Vorgang der Translokation bei der Translation. EF-G hat dabei die Funktion einer GTPase, bewirkt also den Zerfall von GTP in GDP+Pi. Die dabei frei werdende Energie wird genutzt, um die freien tRNA-Moleküle aus dem Ribosom zu lösen und so dessen Fortbewegung zu ermöglichen. Ein Fehlen des Elongationsfaktors verhindert die Proteinbiosynthese.
Erythromycin wirkt gegen grampositive Keime, gegen wenige gramnegative Keime (Bordetella, Legionellen, Chlamydien) sowie gegen Mykoplasmen und einige Rickettsien. Es ist ein Schmalspektrumantibiotikum.
Klinische Angaben
Anwendungsgebiete
Das Wirkungsspektrum von Erythromycin ist mit dem Wirkungsspektrum von einigen Penicillinen vergleichbar, wodurch sich ähnliche Anwendungsgebiete ergeben. Daher kann Erythromycin eingesetzt werden, wenn Allergien gegen β-Lactam-Antibiotika bestehen oder wenn Resistenzen deren Anwendung verhindern.
Eine orale Therapie ist angezeigt bei durch Erythromycin-empfindliche Krankheitserreger verursachten Infektionskrankheiten des Hals-, Nasen- und Ohrbereichs (Mittelohrentzündung, Nasennebenhöhlenentzündung), der tiefen Atemwege (Bronchitis, Lungenentzündung), der Bindehaut, bei Wundrose (Erysipel), Diphtherie, schweren Formen der Acne vulgaris und bestimmten Formen der Harnröhrenentzündung. Wenn (besser wirksame) andere Antibiotika nicht gegeben werden können, z. B. bei Penicillinallergie, ist Erythromycin auch angezeigt zur Behandlung von Entzündungen des Rachenraums (Pharyngitis) oder der Rachenmandeln (Tonsillitis), des Scharlach oder der Syphilis.
Ist die orale Gabe nicht möglich, kann Erythromycin parenteral verabreicht werden.
Topisch kommt Erythromycin insbesondere in der Therapie entzündlicher Akneformen zum Einsatz.
Erythromycin kann auch bei Motilitäts- und Entleerungsstörungen des Magens eingesetzt werden, wenn die First-line-Medikamente Metoclopramid und Domperidon keine Besserung erzielen. Die Anwendung von Erythromycin als Prokinetikum geschieht allerdings unter den Voraussetzungen des Off-Label-Use. Erythromycin bindet bereits in subantibiotischen Dosen an den Motilinrezeptor und bewirkt so eine Förderung der gastrointestinalen Peristaltik, eine Relaxation der Pylorusmuskulatur und koordiniert die motorischen Aktivitäten des Magens und Duodenums.[11]
Wechselwirkungen und Nebenwirkungen
Erythromycin ist ein Hemmstoff des Cytochroms P450 3A4,[12] 3A5 sowie 3A7.[13] Somit ist die Biotransformation von Arzneistoffen, bei denen dieses Enzym beteiligt ist, z. B. Ciclosporin, Diazepam, Lidocain, Warfarin u. v. a., beeinträchtigt, was zur Wirkstoffakkumulation und zur Verstärkung von Haupt- und Nebenwirkungen führt.[14]
Erythromycin ist gut verträglich, die häufigsten unerwünschten Wirkungen sind leichte Magen-Darm-Störungen. Erythromycin ist ein starkes Prokinetikum, das die Magenentleerung beschleunigt. Sehr selten treten anaphylaktische Reaktionen, Tinnitus oder meist vorübergehende Hörverluste bzw. Taubheit auf.
Es kann jedoch auch zu Herzrhythmusstörungen durch Verlängerung der QTc-Zeit kommen.[15]
Chemische und pharmazeutische Informationen
Gemeinsam ist den Erythromycinen ein 14-gliedriger Lactonring ohne Doppelbindungen (Erythronolid-Struktur). Dieser ist an jedem zweiten C-Atom methylverzweigt und ist glykosidisch am C-6 mit dem Aminozucker Desosamin verknüpft und am C-4 mit einem Neutralzucker (Erythromycin A und B: Cladinose, Erythromycin C und D: Mycarose).
Erythromycin A ist in Wasser schwer löslich und bildet farblose bis schwach gelbliche Kristalle.
Die Erythromycine sind trocken stabil, zersetzen sich jedoch in Lösung schon bei Raumtemperatur allmählich. Beim Erhitzen über 60 °C sowie in saurer oder alkalischer Lösung geschieht der Abbau rapide.[3]
| Erythromycin | Allgemeine Struktur | R1 | R2 |
|---|---|---|---|
| A |  |
–OH | –CH3 |
| B | –H | –CH3 | |
| C | –OH | –H |
Pharmakokinetik

Erythromycin wird überwiegend biliär mit einer Halbwertzeit von 1,5 bis 2,5 Stunden ausgeschieden. Daher ist Verabreichung im etwa 6-stündlichen Rhythmus angezeigt.[16]
Salze und Ester
Erythromycinbase ist nicht säurestabil, so dass für die perorale Behandlung entweder magensaftresistente Arzneiformen zur Anwendung kommen oder aber säurefeste Derivate des Erythromycins in der Arzneimittelherstellung verwendet werden müssen: so werden die Ester der Hydroxygruppe am C-2’ des Desoxamins, Erythromycinstearat und Erythromycinethylsuccinat und Erythromycinestolat, das Dodecylsulfatsalz des Erythromycinpropionats, in Tabletten, Kapseln und Suspensionen eingesetzt. Die Ester sind Prodrugs, da die freie 2'-OH-Gruppe des Aminozuckers für die Bindung wichtig ist.
Wasserlösliche Salze wie Erythromycinlactobionat werden für die Herstellung parenteraler Arzneiformen verwendet.
Erythromycin als freie Base wird in äußerlich anzuwendenden Zubereitungen verwendet, etwa in alkoholischen Lösungen, Gel-, Creme- oder Salbengrundlage (z. B. zur topischen Therapie der Akne).
Andere Derivate
Erythromycin ist die Leitsubstanz der Makrolidantibiotika. Durch Partialsynthese gewinnt man aus Erythromycin das 7-O-Methyl-Erithromycin (Clarithromycin) und Erythromycin-9-{(E)-O-[(2-methoxyethoxy)methyl]oxim} (Roxithromycin).
Das ringsubstituierte Azithromycin unterscheidet sich vom Erythromycin A durch die Erweiterung der Erythronolid-Struktur um ein C-Atom zwischen C-9 und C-10, die Carbonylfunktion am C-10 durch eine Methylaminogruppe ersetzt ist (Azalid).
Clarithromycin, Roxithromycin und Azithromycin werden ebenfalls als Arzneistoffe verwendet.
Biosynthese
Der Enzymkomplex
Der Erythromycinvorläufer wird durch eine modulare Polyketidsynthase synthetisiert[17]. Ein solches Enzym besitzt zahlreiche aktive Zentren, organisiert in mehreren Modulen, welche das Kohlenstoffgerüst wie am Fließband aufbauen. Das Enzym Desoxyerythronolid B-Synthase (DEBS), welches an der Biosynthese von Erythromycin A in Saccharopolyspora erythraea beteiligt ist besteht aus 6 Modulen, einem Beladungsmodul und einem Freigabemodul (insgesamt 8)[18]. Es sind 28 aktive Zentren in dem großen Enzymkomplex enthalten:
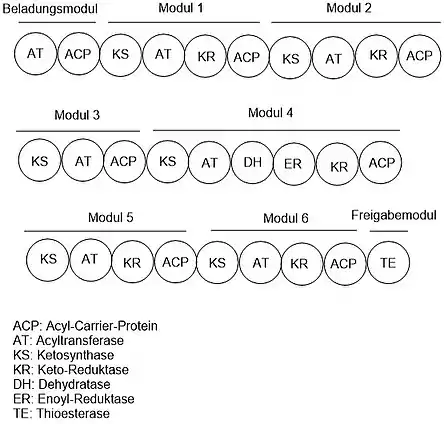
Im Beladungsmodul wird Propionyl-CoA unter Abspaltung von HS-CoA auf das DEBS-Enzym beladen. Über die sechs Module hinweg werden sechs weitere Propionylgruppen angelagert und modifiziert, bis eine C15-Kette vorliegt. Das Substrat wandert dabei linear durch die Module, vergleichbar mit einer Fließbandarbeit. Das Freigabemodul cyclisiert die Kette zu einem vierzehngliedrigen Lacton-Heterozyklus, das 6-Desoxyerythronolid B (6dEB). Dieses Lacton wird vom Enzym freigegeben und in wenigen Schritten zum Erythromycin A modifiziert.
Die einzelnen aktiven Zentren
Die Funktion der aktiven Zentren sind nachfolgend kurz erläutert. In Klammern stehen die Reaktionstypen:
- ACP verankert das Substrat mit dem Enzymkomplex über einen Thioester.
- AT transferiert das Substrat auf die entsprechenden ACPs. (Umesterung)
- KS übernimmt das Substrat von ACP und koppelt es mit einer weiteren Propionylgruppe. (Umesterung und Esterkondensation)
- KR reduziert einen β-Ketothioester zu einem β-Hydroxythioester. (Reduktion)
- DH eliminiert Wasser aus einem β-Hydroxythioester und erzeugt einen α-β-ungesättigten Thioester. (Eliminierung/Dehydratisierung)
- ER hydriert den α-β-ungesättigten Thioester an der Doppelbindung. (Hydrierung)
- TE cyclisiert das Substrat zum Lacton. (Umesterung)
Bereitstellung und Kopplung von Propionylgruppen
Das Kohlenstoffgrundgerüst wird lediglich aus Propionylgruppen aufgebaut. Dabei startet die Zelle mit Propionyl-CoA. Alle weiteren Propionylgruppen werden aus Methyl-Malonyl-CoA gewonnen. Das folgende Schema zeigt die Kopplung zweier Propionyl-Einheiten. Die Zahlen im Subscript der Enzyme beziehen sich auf das Modul. 0 = Beladungsmodul, 1 = Modul 1 (vgl. oberes Schema).
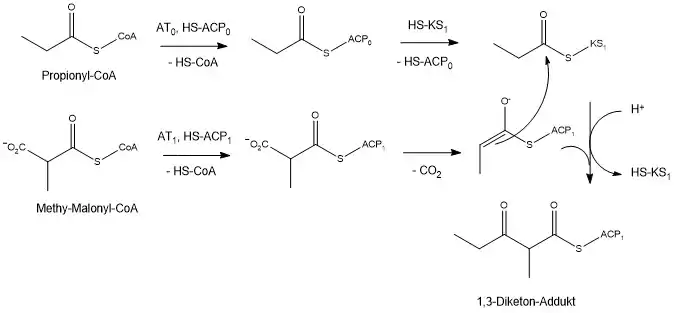
Im Beladungsmodul überträgt AT0 Propionyl aus Propionyl-CoA auf ACP0. Schließlich wird Propionyl auf KS1 in Modul 1 übertragen. In Modul 1 wird weiterhin Methyl-Malonyl aus Methyl-Malonyl-CoA durch AT1 auf ACP1 übertragen. Methyl-Malonyl-ACP1 wird dann zu einem Enolat decarboxyliert und kann Propionyl-S-KS1 nucleophil angreifen. Diese Reaktion entspricht einer Claisen-(Thio-)Esterkondensation.
Reaktionsweg
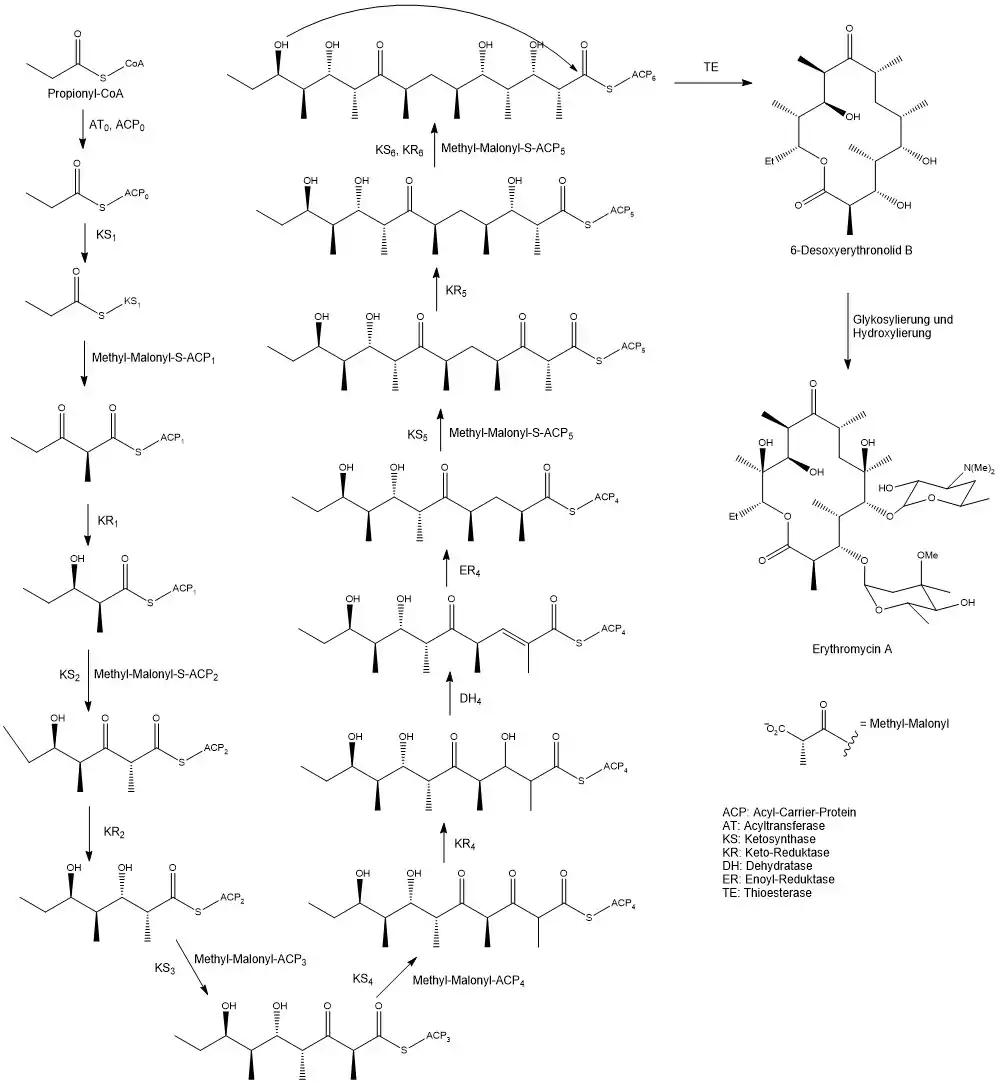
Das folgende Schema zeigt den gesamten Reaktionsweg vom Propionyl-CoA zum 6-dEB und schließlich zum Erythromycin A. Die Bereitstellung von Methyl-Malonyl-S-ACP wird nicht mehr explizit dargestellt.
Handelsnamen
- Monopräparate
- AknedermEry (D), Aknefug-EL[19] (D), Aknemycin Lösung/ Salbe (D), Aknilox (CH), Erios (CH), Eryaknen (D, A, CH), Eryfluid (A), Erythrocin (A), Inderm (D), Infectomycin (D), Meromycin (A), Paediathrocin (D), Sanasepton (D), Stiemycine (D), zahlreiche Generika (D, A, CH)
- Kombinationspräparate
- Aknemycin Emulsion/ Plus/ Salbe (D, A, CH), Isotrexin (D, A), Zineryt (D)
- Tiermedizin
- Erythrocin vet., Erythrocin, Erythromycinthiocyanat, Erytrotil
Literatur
- Rote Liste – Arzneimittelverzeichnis für Deutschland. Rote Liste Service (rote-liste.de [abgerufen am 8. Juli 2011] DocCheck-Passwort erforderlich).
- Europäische Arzneibuch-Kommission (Hrsg.): Europäisches Arzneibuch (Pharmacopoea Europaea, Ph.Eur.).
Weblinks
- Informationen bei MedlinePlus (englisch)
Einzelnachweise
- Datenblatt Erythromycin (PDF) bei Calbiochem, abgerufen am 7. Dezember 2015.
- Erythromycin bei ChemSpider
- F. von Bruchhausen, S. Ebel, A. W. Frahm, E. Hackenthal: Hagers Handbuch der Pharmazeutischen Praxis. Band 8: Stoffe E–O 5. Auflage. Birkhäuser, 1991, ISBN 978-3-540-52688-9, S. 70.
- Datenblatt Erythromycin, mikronisiert bei Caelo, Stand: 27. November 2018; abgerufen am 19. Dezember 2019.
- Theodor Dingermann (Hrsg.), Rudolf Hänsel (Hrsg.) und Ilse Zündorf (Hrsg.): Pharmazeutische Biologie: Molekulare Grundlagen und klinische Anwendungen. Springer Verlag Berlin; 1. Auflage 2002; ISBN 3-540-42844-5; S. 316–317.
- Karl Wurm, A. M. Walter: Infektionskrankheiten. In: Ludwig Heilmeyer (Hrsg.): Lehrbuch der Inneren Medizin. Springer-Verlag, Berlin/Göttingen/Heidelberg 1955; 2. Auflage ebenda 1961, S. 9–223, hier: S. 53 (isoliert 1952).
- Patent US2653899: Erythromycin, its salts, and method of preparation. Angemeldet am 14. April 1952, veröffentlicht am 29. September 1953, Anmelder: Eli Lilly and Company, Erfinder: Robert L. Bunch, James M. McGuire.
- R.B. Woodward et al.: Asymmetric Total Synthesis of Erythromycin. 1. Synthesis of an Erythronolide A Seco Acid Derivative via Asymmetric Induction. In: Journal of the American Chemical Society, 1981, 103, S. 3210.
- R.B. Woodward et al.: Asymmetric Total Synthesis of Erythromycin. 2. Synthesis of an Erythronolide A Lactone System. In: Journal of the American Chemical Society, 1981, 103, S. 3213.
- R.B. Woodward et al.: Asymmetric Total Synthesis of Erythromycin. 3. Total Synthesis of Erythromycin. In: Journal of the American Chemical Society, 1981, 103, S. 3215.
- Mutschler, Arzneimittelwirkungen, 9. Auflage, Wissenschaftliche Verlagsgesellschaft Stuttgart, 2008 ISBN 978-3-8047-1952-1
- WA. Ray et al.: Oral Erythromycin and the Risk of Sudden Death from Cardiac Causes. In: N. Engl. J. Med., 2004, 351, 11, S. 1089–1096. PMID 15356306, freier Volltext (PDF) (englisch).
- Department of Medicine at Indiana University: P450 Drug Interaction Table.
- GR. Robertson et al.: Transgenic mouse models of human CYP3A4 gene regulation. In: Mol Pharmacol., 2003, 64 (1), S. 42–50. PMID 12815159, freier Volltext (PDF) (englisch).
- Torsten Kratz, Albert Diefenbacher: Psychopharmakotherapie im Alter. Vermeidung von Arzneimittelinteraktionen und Polypharmazie. In: Deutsches Ärzteblatt. Band 116, Heft 29 f. (22. Juli) 2019, S. 508–517, S. 512.
- H. Lüllmann, K. Mohr, L. Hein: Pharmakologie und Toxikologie, 16. Aufl. Georg Thieme Verlag, Stuttgart, 2006.
- Joan L. Slonczewski, John W. Foster: Mikrobiologie. 2. Auflage. Springer-Verlag, Berlin Heidelberg 2012, ISBN 978-3-8274-2909-4, S. 656.
- Donald Voet, Judith G. Voet, Charlotte W. Pratt: Lehrbuch der Biochemie. 3. Auflage. Wiley-VCH, Weinheim 2019, ISBN 978-3-527-34286-0, S. 846.
- Rote Liste 2017 – Arzneimittelverzeichnis für Deutschland (einschließlich EU-Zulassungen und bestimmter Medizinprodukte). Auflage 57. Rote Liste Service, Frankfurt/Main 2017, ISBN 978-3-946057-10-9, S. 613.