Racemisierung
Die Racemisierung bezeichnet eine Angleichung der Konzentrationen zweier spiegelbildlicher Moleküle (Enantiomere). Bei vollständiger Racemisierung entsteht ein Racemat, das 1:1-Gemisch der beiden Enantiomere.
Eigenschaften
Die Racemisierung ist ein Begriff aus der Stereochemie, welcher die Umwandlung von nichtracemischen Enantiomerengemischen oder reinen Enantiomeren chiraler chemischer Verbindungen in das Racemat beschreibt, wobei ein vorhandener Enantiomerenüberschuss vollständig abgebaut wird. Bei vollständiger Racemisierung entsteht ein Racemat, dessen ee= 0 ist (der ee ist der Enantiomerenüberschuss). Ist der ee-Wert ≠ 0, so spricht man von partieller (teilweiser) Racemisierung.
Die Racemisierung wird für die Gewinnung von erwünschten Enantiomeren aus einem Gemisch mit unerwünschten Enantiomeren benutzt. Wird in einem Verfahren das (R)-Enantiomer aus einem Racemat durch Racematspaltung gewonnen, bleiben 50 % des Ausgangsstoffes als (S)-Enantiomer zurück. Durch Racemisierung kann man das (S)-Enantiomer wieder in das Racemat überführen bzw. teilweise racemisieren und erneut als Ausgangsstoff einsetzen. Wenn die Racemisierung gleichzeitig in situ mit der Racematspaltung durchgeführt wird, spricht man von dynamischer Racematspaltung.
Der Mechanismus der Racemisierung hängt stark von der Art des Stoffes ab. Racemisierung tritt etwa als Folge von SN1-Reaktionen auf. Dabei entsteht eine trigonal-planare Anordnung um das nun positiv geladene Kohlenstoffatom (Carbenium-Ion). Deshalb kann das Kohlenstoffatom nun von beiden Seiten her angegriffen werden. So entstehen bei der Reaktion beide Enantiomere, auch wenn man ein einziges Enantiomer als Ausgangsmaterial verwendet.[1] Beispielsweise setzt sich (R)-3-Brom-3-methylhexan mit Wasser zu (R)-3-Methyl-3-hexanol und (S)-3-Methyl-3-hexanol im Verhältnis 50:50 um, es entsteht also (RS)-3-Methyl-3-hexanol, ein Racemat.
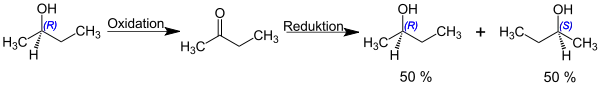
Ein enantiomerenreiner sekundärer Alkohol mit einem Stereozentrum an jenem Kohlenstoffatom an das die Hydroxygruppe gebunden ist, kann durch Oxidation zum betreffenden Keton und Reduktion anschließende dieses Ketons mit Natriumborhydrid in den racemischen sekundären Alkohol umgewandelt, also racemisiert werden.
Altersbestimmung
Biomoleküle entstehen aufgrund der enzymatischen Biosynthese in der Regel enantiomerenrein, d. h. nur eines der beiden möglichen Enantiomere wird gebildet. Über längere Zeitabstände kommt allerdings eine Racemisierung vor, beginnend ab dem Zeitpunkt des Todes, beispielsweise bei den Aminosäuren.[2] Die Bestimmung der Racemisierung zur Altersbestimmung durch Aminosäuredatierung eignet sich für Zeiträume von 1.000 bis 100.000 Jahren.[3]
Peptidsynthese
In der Peptidsynthese ist die gelegentlich zu beobachtende teilweise Racemisierung einzelner Aminosäure-Bausteine ein unerwünschter Prozess, da dabei zwei oder mehr Peptide unterschiedlicher Stereochemie (Diastereomere) resultieren, die wegen der großen chemischen Ähnlichkeit oft nur schwer zu reinigen sind. Die so gebildeten diastereomeren Peptide besitzen in der Regel deutlich unterschiedliche physiologische – z. B. pharmakologische – Wirkungen. Durch Auswahl geeigneter Kupplungsreagenzien kann die Racemisierung bei der Peptidsynthese gemindert werden. Im Anschluss an eine Peptidsynthese wird oftmals eine Racemisierungsprüfung durchgeführt.
Weblinks
Einzelnachweise
- Heinz G. O. Becker, Werner Berger, Günter Domschke, Egon Fanghänel, Jürgen Faust, Mechthild Fischer, Fritjof Gentz, Karl Gewald, Reiner Gluch, Roland Mayer, Klaus Müller, Dietrich Pavel, Hermann Schmidt, Karl Schollberg, Klaus Schwetlick, Erika Seiler und Günter Zeppenfeld: Organikum, Johann Ambrosius Barth Verlag, 1993, 19. Auflage, S. 216–217, ISBN 3-335-00343-8.
- P. M. Masters, J. L. Bada, J. S. Zigler: Aspartic acid racemization in heavy molecular weight crystallins and water insoluble protein from normal human lenses and cataracts. In: Proceedings of the National Academy of Sciences. Band 75, Nummer 3, März 1978, S. 1204–1208, PMID 274711, PMC 411438 (freier Volltext).
- Josef Riederer: Kunstwerke chemisch betrachtet. Springer-Verlag, 2013, ISBN 978-3-642-81588-1, S. 142.