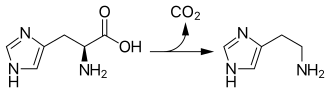
Histidindecarboxylase
Die Histidin-Decarboxylase (kurz HDC) ist ein Enzym, das die Bildung des biogenen Amins und Neurotransmitters Histamin durch Abspaltung von Kohlendioxid (Decarboxylierung) aus Histidin katalysiert. Als Kofaktor ist an das Enzym als prosthetische Gruppe gebundenes Pyridoxalphosphat (aktive Form des Pyridoxins) an der katalysierten Reaktion beteiligt. Die enzymatische Decarboxylierung von Histidin mit Hilfe der Histidin-Decarboxylase, welche der erste Schritt beim Abbau der Aminosäure Histidin und der letzte der Histamin-Biosynthese ist, findet in Tieren, Pflanzen und vielen Bakterien statt.[1][2][3]
| Histidindecarboxylase | ||
|---|---|---|
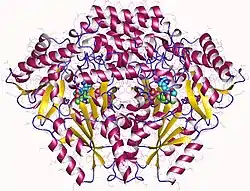 | ||
| Histidindecarboxylase homodimer, Human 4E1O | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 662 Aminosäuren | |
| Sekundär- bis Quartärstruktur | Homodimer | |
| Kofaktor | Pyridoxalphosphat | |
| Bezeichner | ||
| Gen-Name | HDC | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 4.1.1.22, Lyase | |
| Reaktionsart | Decarboxylierung | |
| Substrat | L-Histidin | |
| Produkte | Histamin | |
| Vorkommen | ||
| Homologie-Familie | Decarboxylase | |
| Übergeordnetes Taxon | Tiere, Bakterien | |
| Orthologe | ||
| Mensch | Hausmaus | |
| Entrez | 3067 | 15186 |
| Ensembl | ENSG00000140287 | ENSMUSG00000027360 |
| UniProt | P19113 | P23738 |
| Refseq (mRNA) | NM_001306146 | NM_008230 |
| Refseq (Protein) | NP_001293075 | NP_032256 |
| Genlocus | Chr 15: 50.24 – 50.27 Mb | Chr 2: 126.59 – 126.62 Mb |
| PubMed-Suche | 3067 | 15186 |
Katalysierte Reaktion
Einzelnachweise
- UniProt P19113
- H. M. Epps: Studies on bacterial amino-acid decarboxylases: 4. l(-)-histidine decarboxylase from Cl. welchii Type A. In: The Biochemical Journal. Band 39, Nr. 1, 1945, ISSN 0264-6021, S. 42–46, PMID 16747851, PMC 1258146 (freier Volltext).
- E. Sandmeier, T. I. Hale, P. Christen: Multiple evolutionary origin of pyridoxal-5'-phosphate-dependent amino acid decarboxylases. In: European Journal of Biochemistry. Band 221, Nr. 3, 1. Mai 1994, ISSN 0014-2956, S. 997–1002, PMID 8181483.
Weblinks
Wikibooks: Biochemie und Pathobiochemie: Histidin-Stoffwechsel – Lern- und Lehrmaterialien
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. The authors of the article are listed here. Additional terms may apply for the media files, click on images to show image meta data.