Curcumin
Curcumin (abgeleitet aus arabisch كركم kourkoum ‚Safran‘)[6] ist eine intensiv orange-gelbe, natürlich vorkommende chemische Verbindung, aus der Gruppe der Diarylheptanoide. Über eine ungesättigte C7-Kette, die eine 1,3-Diketoneinheit enthält, sind dabei zwei o-Methoxyphenolreste miteinander verbunden. Die Verbindung kann zur Stoffgruppe der pflanzlichen Polyphenole gezählt werden.[7]
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
.svg.png.webp) | ||||||||||||||||||||||
| Keto-Form | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Curcumin | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C21H20O6 | |||||||||||||||||||||
| Kurzbeschreibung |
orange-gelber Feststoff[3] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 368,39 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit |
nahezu unlöslich in Wasser[3] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Curcumin ist der Hauptbestandteil des Würz-, Heil- und Färbemittels Kurkuma, das zusammen mit anderen Gewürzen im Currypulver verwendet wird.[8]
Geschichte
Die Geschichte von Curcumin reicht über 5000 Jahre zurück bis in die Blütezeit der indischen Heilkunst Ayurveda. Es wurde nicht nur als Bestandteil von Nahrungsmitteln, sondern auch zur Behandlung verschiedener Beschwerden verwendet. Kurkuma wurde bereits 1280 von Marco Polo in den Berichten seiner Reisen nach China und Indien erwähnt. Das Gewürz wurde im 13. Jahrhundert von arabischen Kaufleuten von Indien nach Europa gebracht. Kurkuma wurde während der britischen Herrschaft in Indien in Kombination mit anderen Gewürzen als Currypulver verwendet.[9]
1815 berichteten Pierre-Joseph Pelletier und Heinrich August von Vogel von ihren Versuchen, den gelben Farbstoff aus der Kurkumapflanze, den sie Curcumin benannten, zu isolieren.[10] August Vogel jr. beschrieb 1842 eine reine, aber nicht kristalline Präparation von Curcumin.[11] In kristalliner Form wurde Curcumin erstmals 1870 unabhängig voneinander von F. W. Daube und Y. Iwanof-Gajewsky isoliert und analytisch untersucht.[12][13] 1897 wurde von Giacomo Luigi Ciamician und Paolo Silber für Curcumin die Summenformel C21H20O6 ermittelt.[14] Die Struktur von Curcumin wurde 1910 durch J. Miłobȩdzka, St. v. Kostanecki und V. Lampe aufgeklärt. Sie konnten zeigen, dass Curcumin durch Kochen mit Kalilauge zur Ferulasäure gespalten wird.[15] Die Struktur wurde 1918 durch die Erstsynthese von V. Lampe bestätigt.[16]
Vorkommen und Gewinnung
_Im_IMG_2441.jpg.webp)
Curcumin findet sich in Wurzeln und Schoten von Gelbwurzgewächsen der Pflanzengattung Curcuma. Man kennt etwa 120 verschiedene Pflanzenarten dieser Gattung, wobei die Indische Gelbwurz (Curcuma longa) und die Javanische Gelbwurz (Curcuma xanthorriza) die bekanntesten Vertreter sind.[3] Das Verbreitungsgebiet der Pflanzen sind die tropischen und subtropischen Regionen in Indien, China und weiteren südostasiatischen Staaten. Der weltweit größte Produzent, Verbraucher und Exporteur von Kurkuma ist Indien. Die jährliche Produktion lag in den Jahren 2008/2009 bei ca. 900000 Tonnen.[8]
Kurkuma enthält zwischen 2 und 9 % Curcuminoide. Dabei ist Curcumin mit über 50 % Hauptbestandteil neben weiteren Verbindungen, wie beispielsweise Demethoxycurcumin[17] und Bisdemethoxycurcumin[18].
Curcumin erhält man durch Lösungsmittelextraktion aus den getrockneten und gemahlenen Rhizomen der Kurkumapflanze. Der Extrakt wird durch Kristallisation gereinigt. Curcumin kann durch Umsetzung mit frisch zubereitetem Aluminiumoxid in wässrigem Medium in den Aluminiumlack überführt werden, der nach der Filtration mit Wasser gewaschen und getrocknet wird.[19]
Biosynthese
Die Biosynthese der Curcuminoide geht von L-Phenylalanin (1) aus. Über Zimtsäure und p-Cumarsäure wird p-Cumaroyl-CoA (2) gebildet. Dieses kondensiert mit Malonyl-CoA (4) zur Diketidzwischenstufe 5. Aus 5 und einem weiteren Molekül p-Cumaroyl-CoA wird mit dem Enzym Curcumin-Synthase Bisdemethoxycurcumin (7) synthetisiert. Aus diesem entsteht mit Hydroxylasen und O-Methyltransferasen zunächst Demethoxycurcumin (8) und aus diesem schließlich Curcumin (9). Alternativ kann aus p-Cumaroyl-CoA (2) über vier Stufen das Feruloyl-CoA (3) gebildet werden, das dann ebenfalls mit Malonyl-CoA (4) zur Diketidzwischenstufe 6 umgesetzt wird. Aus Zwischenstufe 6 wird mit einem weiteren Molekül Feruloyl-CoA (3) direkt Curcumin (9) synthetisiert.[8][20][21]
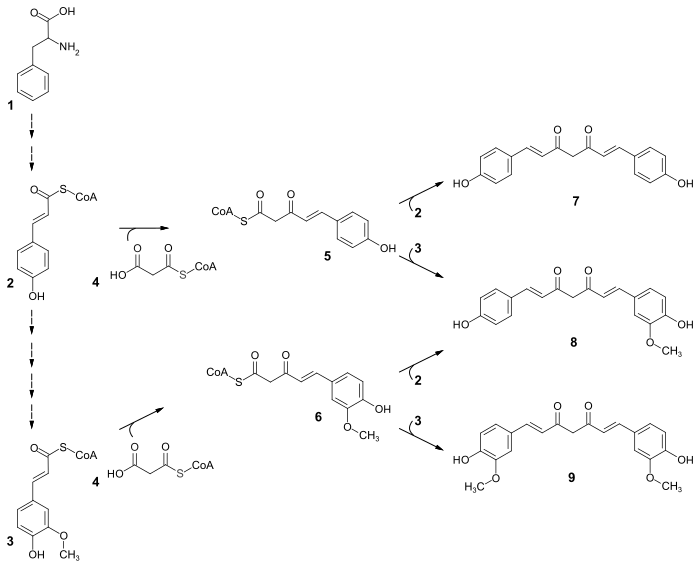
Nach einer anderen Publikation zur Biosynthese von Curcumin wird der Weg über die Zwischenstufen Zimtsäure und Cinnamoyl-CoA bevorzugt.[22]
Synthese
Es gibt verschiedene Synthesewege für die Herstellung von Curcumin.[8][23][24]
Die Erstsynthese von Curcumin durch V. Lampe erfolgte in einer mehrstufigen Reaktionsfolge ausgehend von Carbomethoxyferuloylchlorid (1) und Acetessigester (2). Die Kondensation der beiden Ausgangsprodukte in Gegenwart von Natriumethanolat ergibt die Zwischenstufe (3), die durch Verseifung und Decarboxylierung in das Carbomethoxyferuloylaceton (4) überführt wird. Erneute Kondensation mit Carbomethoxyferuloylchlorid (1) ergibt das Triketon (5), das durch Kochen in Eisessig unter Abspaltung von Essigsäure zum Dicarbomethoxycurcumin (6) reagiert. Durch Verseifung des Kohlensäureesters mit verdünnter Kalilauge erhält man Curcumin (7).[16]
.svg.png.webp)
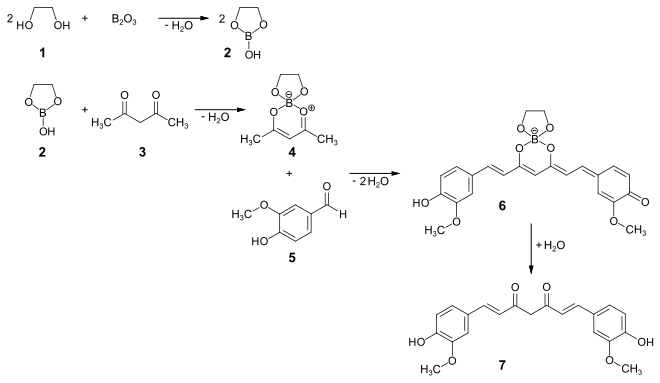
1950 wurde eine Eintopfsynthese von Curcumin (3) durch Umsetzung von Vanillin (1) und Acetylaceton (2) in Gegenwart von Bortrioxid in einer zweifachen Aldolkondensation veröffentlicht.[25]
.svg.png.webp)
Dabei wird durch die Bildung eines Bisacetylacetonato-Bor-Komplexes eine Knoevenagel-Reaktion an der acideren 3-Position von Acetylaceton vermieden, so dass die Reaktion ausschließlich an den terminalen Methylgruppen erfolgt.[26][27]
boron_complex.svg.png.webp)
Die ursprünglich sehr geringe Ausbeute von ca. 10 % konnte 1964 mit einer Weiterentwicklung des Verfahrens durch den Zusatz von Tri-sec-butylborat und Butylamin signifikant gesteigert werden.[28]
Eine Reihe weiterer Verfahrensvarianten wurden in der Folgezeit publiziert. So reagiert beispielsweise Ethylenglycol (1) mit Bortrioxid zu einem löslichen 1,3,2-Dioxaborolanol (2). Durch Umsetzung mit Acetylaceton (3) erhält man die Spiroverbindung 4 die mit Vanillin (5) über die Zwischenstufe 6 Curcumin (7) ergibt.[29][30]
Eigenschaften
Durch eine Keto-Enol-Tautomerie kann man für das Curcumin drei mögliche Tautomere formulieren. Dies sind neben der Diketo- und der Keto-Enol-Form ein Dienol-Tautomer unter Einbeziehung der phenolischen Hydroxygruppe.[31]
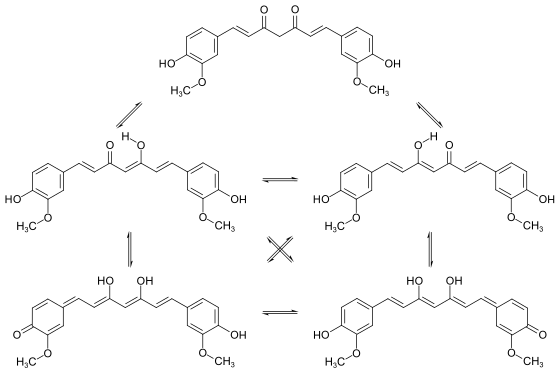
Da die Keto-Enol-Form durch eine intramolekulare Wasserstoffbrückenbindung zwischen den beiden Sauerstoffatomen stabilisiert wird, ist dies in aller Regel die bevorzugte Struktur.
In Lösung hängt das Keto-Enol-Gleichgewicht von der Polarität und dem pH-Wert des Lösungsmittels ab. Während in unpolaren Lösungsmitteln die Enolform dominiert, liegt in polaren Lösungsmitteln bevorzugt die Diketoform vor. Das Diketotautomer dominiert in sauren und neutralen Medien und die Verbindung fungiert als Protonendonator. Dagegen wird bei pH >8 die Enolatform bevorzugt und Curcumin wirkt als Elektronendonor.[8] Quantitative Untersuchungen des Tautomerengleichgewichts in Ethanol/Wasser-Gemischen zeigen, dass in reinem Ethanol nur die Enol-Keto-Form vorliegt und mit zunehmendem Wassergehalt der Anteil des Diketo-Tautomers zunimmt.[31]
Röntgenbeugungsstudien an Einkristallen von Curcumin zeigten, dass das Molekül im festen Zustand drei substituierte planare Gruppen besitzt, die durch Doppelbindungen verbunden sind. Der Winkel zwischen den Ebenen der beiden Arylgruppen beträgt −162°. Im Kristall liegt Curcumin vorzugsweise in der cis-Enol-Konfiguration vor und es besteht eine starke intramolekulare Wasserstoffbrückenbindung. Der enolische Wasserstoff wird zu gleichen Teilen von den beiden Sauerstoffatomen geteilt.[32]
Das chromophore System von Curcumin bedingt die gelbe Farbe, wobei die höchste Absorption bei 420 nm in organischen Lösungsmitteln wie Methanol auftritt. In wässriger Lösung nimmt die Absorption stark ab und die UV/VIS-Spektren zeigen eine pH-Abhängigkeit. In alkalischer Lösung liegt das Absorptionsmaximum bei 463 nm zeigt bei Erniedrigung des pH-Werts eine hypsochrome Verschiebung zu 422 nm bei abnehmender Intensität.[8]
Curcumin ist ein Säure-Base-Indikator. Bei pH <1 ist die Verbindung protoniert und zeigt eine Rotfärbung. Im pH-Bereich 1–7 weist die neutrale Verbindung eine leuchtend gelbe Farbe auf. Bei pH >7 wird Curcumin deprotoniert und es erfolgt bei pH 8–9 wiederum ein Farbumschlag nach Rot.[8]
Die Verbindung ist in Ethanol, Methanol, konzentrierter Essigsäure, Dichlormethan, Chloroform, Ethylacetat, Dimethylsulfoxid und Aceton löslich. In Ethanol zeigt sie eine schwach grüne Fluoreszenz. In Wasser und Diethylether ist Curcumin unlöslich.[8]
Curcumin ist lichtempfindlich und in alkalischer Lösung nicht stabil.[8]
Verwendung
Lebensmittel

Curcumin wurde 1962 als einer der ersten Lebensmittelzusatzstoffe durch die Richtlinie des Rats zur Angleichung der Rechtsvorschriften der Mitgliedstaaten für färbende Stoffe, die in Lebensmitteln verwendet werden dürfen in der EWG zugelassen und erhielt die E-Nummer E 100. Auch in der aktuellen Verordnung (EG) Nr. 1333/2008 für Lebensmittelzusatzstoffe wird es als Lebensmittelfarbstoff aufgeführt. Darin wird auch geregelt, dass eine Verwendung nur in bestimmten Lebensmitteln und nur mit einer maximalen Dosiermenge zulässig ist. So sind z. B. in verschiedenen Fleisch- und Wurstprodukten max. 20, in Schmelzkäse und weinhaltige Getränke max. 100, in verschieden Milchprodukten, wie Sahne oder Speiseeis max. 150, in Fischrogen, max. 300 und in Würzmitteln bis zu 500 mg/kg erlaubt. Dabei wird die maximale Dosiermenge oft für die Summe eine Gruppe von Farbstoffen (E 100, E 102, E 120, E 122, E 160e und E 161b) festgelegt. Für einige Nahrungsmittelkategorien, wie Streichfette, Brotaufstriche, Konfitüre, Marmelade und verschiedene Kartoffelprodukte gibt es keine Mengenbeschränkung (quantum satis).[33] Der Einsatz in festen und flüssigen Nahrungsergänzungsmitteln mit maximalen Mengen von 300, bzw. 100 mg/kg ist ebenfalls erlaubt.[33]
Durch das Gremium für Lebensmittelzusatzstoffe und Lebensmitteln zugesetzte Nährstoffquellen (ANS) der Europäischen Behörde für Lebensmittelsicherheit wurde eine erlaubte Tagesdosis (ADI) von 3 mg/kg Körpergewicht festgelegt.[19] Nach der in der Verordnung (EU) Nr. 231/2012 definierten Spezifikation für den Lebensmittelfarbstoff E 100, darf das Produkt neben Curcumin das Demethoxycurcumin und Bisdemethoxycurcumin in unterschiedlicher Zusammensetzung enthalten. Der Gehalt dieser Farbstoffe muss mindestens 90 % betragen.[34]
Als Bestandteil der frischen Kurkumawurzel oder häufiger von Kurkumapulver, also der getrockneten und gemahlenen Kurkumawurzel, wird Curcumin als Gewürz in der indischen und thailändischen Küche verwendet. Darüber hinaus ist Curcumin Bestandteil sämtlicher Curry-Mischungen und Curry-Pasten.[35] Das Gewürz hat ein pfeffriges Aroma und einen mild-würzigen Geschmack mit bitterem Nachgeschmack. Neben vielen Currygerichten wird es in Chutneys und nordafrikanischen Lammgerichten verwendet.[36] Kurkuma fällt gemäß Artikel 3 der Verordnung (EG) Nr. 1333/2008 nicht unter die Lebensmittelzusatzstoffe, wenn es wegen seiner aromatisierenden, geschmacklichen oder ernährungsphysiologischen Eigenschaften verwendet wird.[33]
Textilfarbstoff
Cuarcumin ist ein Direktfarbstoff für Baumwolle und Seide. Aufgrund seiner geringen Lichtechtheit und der Unbeständigkeit im Alkalischen hat die Verwendung als Textilfarbstoff keine Bedeutung.[37]
Analytik
Bereits 1870 wurde eine Farbänderung von Curcumin durch Borsäure beobachtet.[38] Diese Farbreaktion von Curcumin mit Borsäure, bzw. Boraten zu dem roten Farbstoff Rosocyanin, bzw. in Gegenwart von Oxalsäure zu dem Farbstoff Rubrocurcumin wird in der analytischen Chemie zur quantitativen Analyse verwendet. Hierzu wird eine Probe des Bor-haltigen Materials oxidativ aufgeschlossen und die dadurch gebildete Borsäure anschließend mit Curcumin kolorimetrisch bestimmt.[39][40][41] Für die qualitative Analyse von Borsäure kann Curcuminpapier – ein mit einer ethanolischen Curcuminlösung imprägniertes und getrocknetes Filterpapier – verwendet werden. Bei Anwesenheit von Borsäure zeigt das Curcuminpapier eine rötliche bis orangerote Färbung, die beim Betupfen mit einer 2%igen Natriumcarbonatlösung nach Blauviolett bis Blauschwarz umschlägt. Bei Abwesenheit von Borsäure verändert sich die gelbe Farbe des Curcuminpapiers nicht und wird durch die Natriumcarbonatlösung rotbraun gefärbt.[42]
Medizinische Aspekte
Curcumin findet als Hauptbestandteil von Kurkuma Verwendung in der traditionellen indischen und chinesischen Medizin. In der ayurvedischen Medizin wird es zur Behandlung von Atemwegserkrankungen, sowie Lebererkrankungen, Anorexie, Rheuma und Sinusitis verwendet. In der traditionellen chinesischen Medizin wird es bei der Behandlung von Unterleibsschmerzen eingesetzt.[43] 1937 erschien der erste wissenschaftliche Artikel zur Behandlung von Gallenerkrankungen durch Curcuma. Insbesondere in den letzten Jahren ist die Zahl der wissenschaftlichen Artikel zu Curcumin rasant angestiegen. In der medizinischen Datenbank PubMed sind bis Ende 2020 zum Schlagwort Curcumin über 16000 Artikel zu finden.[44] Es werden verschiedene gesundheitsfördernde Effekte wie antioxidative, antibakterielle, entzündungshemmende, schmerzlindernde, wundheilende und verdauungsfördernde Eigenschaften beschrieben. Ebenso werden antikanzerogene und neuroprotektive Wirkungen von Curcumin untersucht.[8] In Makrophagen erhöht Curcumin in vitro die Translation der zugehörigen mRNA des Glucocorticoid-induzierten Leuzin-Zipper Proteins, welches entzündungshemmend wirkt. Damit besitzt Curcumin eine ähnliche Wirkungsweise wie das Glucocorticoid Cortison, welches die Expression des Gens des Glucocorticoid-induzierten Leuzin-Zipper Proteins erhöht. Da Curcumin dabei jedoch, anders als Cortison, den Glucocorticoid-Rezeptor umgeht, wird vermutet, dass es dadurch nicht zu den eventuelle Nebenwirkungen des Cortisons kommt.[45][46]
Bioverfügbarkeit
Da Curcumin schwer wasserlöslich ist, wird es im Magen-Darm-Trakt nur in einem sehr geringen Maß absorbiert.[47][48] Durch Erhitzen oder Auflösung in Öl wird die Bioverfügbarkeit von in Lebensmitteln enthaltenem Curcumin erhöht.[49] Zusätzlich wird absorbiertes Curcumin durch den First-Pass-Effekt vor allem in den Nieren durch Sulfatierung und Glucuronidierung sehr schnell metabolisiert.[50][51] Die dabei entstehenden Metabolite besitzen keine medizinische Wirksamkeit mehr und werden ausgeschieden.[52]
Unter Anwendung von Adsorptions-Mediatoren werden mehrere Ansätze für eine erhöhte Bioverfügbarkeit untersucht. Ein Curcumin-Phospholipid-Komplex hat eine 29-fach höhere Bioverfügbarkeit als herkömmliches Curcumin.[53][54] Schwarzer-Pfeffer-Extrakt (Piperin) bewirkt eine 20-fache Bioverfügbarkeit von Curcumin und wird in den meisten Nahrungsergänzungsmitteln mit Curcumin eingesetzt.[55] Verschiedene Ansätze zur Verbesserung der Bioverfügbarkeit von Curcumin-Formulierungen werden in einem neueren Online-Übersichtsartikel zusammengefasst,[56] wobei Zubereitungen mit Curcumin, das in hydrophoben Trägern dispergiert ist, die besten Ergebnisse erzielt. Auch Cyclodextrin ist als Träger geeignet.[57]
In-vitro-Studien
Da Curcumin als eines der stärksten Pan-assay interference compounds (PAINS) falsch-positive Ergebnisse in chemischen Untersuchungen (zum Beispiel Hochdurchsatz-Screenings) bewirken kann, muss ein Großteil der dazu publizierten Ergebnisse aus In-vitro-Studien hinterfragt werden. Aufgrund der geringen oralen Bioverfügbarkeit von Curcumin sind die Ergebnisse von In-vitro-Studien nicht direkt auf den Menschen übertragbar. Zahlreiche Ansätze zielen daher auf eine Erhöhung der Bioverfügbarkeit von Curcumin-Formulierungen ab (siehe oben). Kurkuma-Pulver enthält zahlreiche unterschiedliche Komponenten, so dass die in In-vitro-Studien gezeigten Effekte auch durch andere Komponenten verursacht werden könnten.[58][59]
Zellseneszenz
Curcumin zeigt in Modellen eine lebensverlängernde Wirkung. Die Verbindung wirkt stimulierend auf die Expression des SIRT1-Gens und hat dadurch indirekt eine antioxidative und entzündungshemmende Wirkung. Eine Studie zeigte, dass durch Curcumin und SIRT1-Aktivierung die Wasserstoffperoxid-induzierte Seneszenz in menschlichen Nabelvenen-Endothelzellen abgedämpft werden kann. Dies könnte demnach auch die Entstehung von vaskulären Erkrankungen wie beispielsweise Arteriosklerose vorbeugen.[60] Curcumin ist in der Lage, in Mäusezellen in vitro die Anzahl seneszenter Zellen zu verringern. In seiner Effizienz wurde es dabei in dieser Studie nur von Fisetin, einem Flavonoid, übertroffen.[61]
Andererseits kann Curcumin dosisabhängig selbst zelluläre Seneszenz induzieren. Dabei werden viele Signalwege beeinflusst, welche in der Gesamtheit dazu beitragen, zelluläre Seneszenz zu verursachen. Der Hauptmechanismus, über welchen Curcumin zelluläre Seneszenz auslöst, ist noch unbekannt. Bisher ist bekannt, dass die durch Curcumin ausgelöste Seneszenz unabhängig von den Zellen der vaskulären glatten Muskulatur ist, und dass die ROS-Produktion und die ATM-Aktivierung keinen großen Einfluss auf den Verlauf der Seneszenz haben. Besonders stark werden die Signalwege AMPK, ATM, Sirtuin 1 und p300 beeinflusst, welche in ihrem wechselseitigen Zusammenspiel maßgeblich zur zellulären Seneszenz beitragen. Dennoch besteht die Möglichkeit, dass die durch Curcumin ausgelöste Seneszenz unter Umständen im Gesamtbild vorteilhaft für das Gewebe bzw. den Organismus ist.[62]
Arthrose und Schmerzen
Eine Übersichtsstudie ergab, dass Curcumin bei Arthrosepatienten sowohl die Schmerzen verringern als auch die Beweglichkeit verbessern kann: Die berücksichtigten Studien ergaben eine hochsignifikante Reduktion des Pain Visual Analogue Score (PVAS) durch Curcumin im Vergleich mit einem Placebo (P< .00001) sowie eine Reduktion des Western Ontario and McMaster Universities Osteoarthritis Index (WOMAC) (P= .009). Zusätzlich wurde kein signifikanter Unterschied des PVAS zwischen Curcumin und Schmerzmedikamenten (Ibuprofen, Diclofenac, Glucosamin) festgestellt. Dies lässt darauf schließen, dass Curcumin einen ähnlichen schmerzlindernden Effekt aufweist wie diese Schmerzmittel. Ein Curcumin-Phospholipid konnte im Vergleich zu Chondroitin auch den Karnofsky-Index der Patienten verbessern.[63]
Weblinks
- Curcumin in Nahrungsergänzungsmitteln: Gesundheitlich akzeptable tägliche Aufnahmemenge kann überschritten werden. In: Bundesinstitut für Risikobewertung (Hrsg.): BfR-Stellungnahmen. Band 2021, Nr. 40, 14. Dezember 2021, S. 12, doi:10.17590/20211214-121912 (bund.de [PDF]).
- Refined exposure assessment for curcumin (E 100). In: EFSA (Hrsg.): EFSA Journal. Band 12, Nr. 10, 2014, S. 43, doi:10.2903/j.efsa.2014.3876 (wiley.com).
- Stellungnahme zur Einstufung von Produkten, die Curcumin mit verbesserter Bioverfügbarkeit enthalten. In: bvl.bund.de. Februar 2020, abgerufen am 9. Januar 2022.
Einzelnachweise
- Eintrag zu E 100: Curcumin in der Europäischen Datenbank für Lebensmittelzusatzstoffe, abgerufen am 27. Juni 2020.
- Eintrag zu CURCUMIN in der CosIng-Datenbank der EU-Kommission, abgerufen am 6. August 2020.
- Eintrag zu Curcumin I. In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. Februar 2019.
- Eintrag zu Curcumin in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM)
- Datenblatt Curcumin bei Sigma-Aldrich, abgerufen am 23. März 2011 (PDF).
- Paolo Scartezzini, Ester Speroni: Review on some plants of Indian traditional medicine with antioxidant activity. In: Journal of Ethnopharmacology. Band 71, Nr. 1-2, Juli 2000, S. 23, doi:10.1016/s0378-8741(00)00213-0.
- Stéphane Quideau, Denis Deffieux, Céline Douat-Casassus, Laurent Pouységu: Pflanzliche Polyphenole: chemische Eigenschaften, biologische Aktivität und Synthese. In: Angewandte Chemie. Band 123, Nr. 3, 17. Januar 2011, S. 610, doi:10.1002/ange.201000044.
- Tuba Esatbeyoglu, Patricia Huebbe, Insa M. A. Ernst, Dawn Chin, Anika E. Wagner und Gerald Rimbach: Curcumin – vom Molekül zur biologischen Wirkung. In: Angewandte Chemie. Band 124, Nr. 1, 2012, S. 2–28, doi:10.1002/ange.201107724.
- Bharat B. Aggarwal, Chitra Sundaram, Nikita Malani, Haruyo Ichikawa: Curcumin: The Indian Solid Gold. In: Advances in Experimental Medicine and Biology. Band 595. Springer, Boston 2007, S. 1–75, doi:10.1007/978-0-387-46401-5_1.
- A. Vogel, J. Pelletier: Examen chimique de la racine de Curcuma. In: Journal de Pharmacie. 1815.
- August Vogel jun: Ueber die Darstellung des Curcumins, dessen chemische Eigenschaften und elementare Zusammensetzung. In: Abhandlungen der Mathematisch-Physikalischen Classe der Königlich Bayerischen Akademie der Wissenschaften. Band 3. München 1843, S. 551 (eingeschränkte Vorschau in der Google-Buchsuche).
- F. W. Daube: Ueber Curcumin, den Farbstoff der Curcumawurzel. In: Berichte der deutschen chemischen Gesellschaft. Band 3, Nr. 1, Januar 1870, S. 609, doi:10.1002/cber.187000301196.
- unbekannt: V. v. Richter, aus Petersburg am 2/14. Juni. In: Berichte der deutschen chemischen Gesellschaft. Band 3, Nr. 1, Januar 1870, S. 622, doi:10.1002/cber.187000301201.
- Giacomo Ciamician, P. Silber: Zur Kenntniss des Curcumins. In: Berichte der deutschen chemischen Gesellschaft. Band 30, Nr. 1, Januar 1897, S. 192, doi:10.1002/cber.18970300138.
- J. Miłobȩdzka, St. v. Kostanecki, V. Lampe: Zur Kenntnis des Curcumins. In: Berichte der deutschen chemischen Gesellschaft. Band 43, Nr. 2, April 1910, S. 2163, doi:10.1002/cber.191004302168.
- V. Lampe: Synthese von Curcumin. In: Berichte der deutschen chemischen Gesellschaft. Band 51, Nr. 2, Juli 1918, S. 1347, doi:10.1002/cber.19180510223.
- Externe Identifikatoren von bzw. Datenbank-Links zu Demethoxycurcumin: CAS-Nummer: 22608-11-3, EG-Nummer: 663-429-8, ECHA-InfoCard: 100.189.739, PubChem: 5469424, ChemSpider: 4579941, Wikidata: Q5264607.
- Externe Identifikatoren von bzw. Datenbank-Links zu Bisdemethoxycurcumin: CAS-Nummer: 33171-05-0, PubChem: 5315472, ChemSpider: 4474770, Wikidata: Q4917168.
- EFSA Panel on Food Additives and Nutrient Sources added to Food (ANS): Scientific Opinion on the re‐evaluation of curcumin (E 100) as a food additive. Hrsg.: European Food Safety Authority. Parma 6. September 2010, doi:10.2903/j.efsa.2010.1679.
- Maria del Carmen Ramirez-Ahumada, Barbara N. Timmermann, David R. Gang: Biosynthesis of curcuminoids and gingerols in turmeric (Curcuma longa) and ginger (Zingiber officinale): Identification of curcuminoid synthase and hydroxycinnamoyl-CoA thioesterases. In: Phytochemistry. Band 67, Nr. 18, September 2006, S. 2017, doi:10.1016/j.phytochem.2006.06.028.
- Yohei Katsuyama, Tomoko Kita, Nobutaka Funa, Sueharu Horinouchi: Curcuminoid Biosynthesis by Two Type III Polyketide Synthases in the Herb Curcuma longa. In: Journal of Biological Chemistry. Band 284, Nr. 17, April 2009, S. 11160, doi:10.1074/jbc.m900070200.
- Tomoko Kita, Shinsuke Imai, Hiroshi Sawada, Hidehiko Kumagai, Haruo Seto: The Biosynthetic Pathway of Curcuminoid in Turmeric (Curcuma longa) as Revealed by 13C-Labeled Precursors. In: Bioscience, Biotechnology, and Biochemistry. Band 72, Nr. 7, 22. Mai 2014, S. 1789, doi:10.1271/bbb.80075.
- Jens Kruse: Curcumin und synthetische Derivate als umgebungssensitive Fluoreszenzsonden. Dissertation, Christian-Albrechts-Universität. Kiel 2003 (uni-kiel.de [PDF]).
- Silvia Schmautz: Curcumin: Novel therapeutic applications of an old traditional drug. With focus on Alzheimer´s Disease. Diplomarbeit, Universität Wien. 2007 (englisch, univie.ac.at [PDF]).
- T. Pavolini, F. Gambarin, A. M. Grinzato: Curcumina e curcuminoidi. In: Ann.Chimica. (Rome). Band 40, 1950, S. 280; Chem.Abstr. Band 52, 1951, S. 816. (books.google.de)
- Uffe Pedersen, Preben B. Rasmussen, Sven-Olov Lawesson: Synthesis of Naturally Occurring Curcuminoids and Related Compounds. In: Liebigs Annalen der Chemie. Band 1985, Nr. 8, 12. August 1985, S. 1557–1569, doi:10.1002/jlac.198519850805.
- Dirk Rohde: Darstellung und Eigenschaftsuntersuchungen an 1,3,2-Dioxaborinen mit variablen Coliganden am Boratom. sundoc.bibliothek.uni-halle.de
- H. J. J. Pabon: A synthesis of curcumin and related compounds. In: Recueil des Travaux Chimiques des Pays-Bas. Band 83, Nr. 4, 1964, S. 379–386, doi:10.1002/recl.19640830407.
- Patent US2961459: Glycol Pyroborates. Angemeldet am 27. April 1956, veröffentlicht am 22. November 1960, Anmelder: Standard Oil Company, Erfinder: Clark G. Spike.
- Patent DE2501220A1: Einstufenverfahren zur Herstellung von substituierten 1,7-Diphenyl-5-hydroxyhepta-(1,4,6)-trien-(3)-onen. Angemeldet am 14. Januar 1975, veröffentlicht am 15. Juli 1976, Anmelder: Ludwig Heumann & Co. GmbH, Erfinder: Walter Liebenow, Ingomar Grafe.
- Yana Manolova, Vera Deneva, Liudmil Antonov u. a.: The effect of the water on the curcumin tautomerism: A quantitative approach. In: Spectrochimica Acta. Band 132A, Nr. 1, 2014, S. 815–820, doi:10.1016/j.saa.2014.05.096.
- K. Indira Priyadarsini: Chemical and Structural Features Influencing the Biological Activity of Curcumin. In: Current Pharmaceutical Design. Band 19, Nr. 11, 1. April 2013, S. 2093–2100, doi:10.2174/138161213805289228.
- Verordnung (EG) Nr. 1333/2008 des Europäischen Parlaments und des Rates vom 16. Dezember 2008 über Lebensmittelzusatzstoffe in der konsolidierten Fassung vom 8. August 2021
- Verordnung (EU) Nr. 231/2012 der Kommission vom 9. März 2012 mit Spezifikationen für die in den Anhängen II und III der Verordnung (EG) Nr. 1333/2008 des Europäischen Parlaments und des Rates aufgeführten Lebensmittelzusatzstoffe
- Julia Pfliegl: Kurkuma (Curcumin), das indische Gewürz mit Heilwirkung. In: Utopia.de. Utopia GmbH, 13. Juni 2018, abgerufen am 12. März 2021.
- Susanne Bodensteiner, Reinhard Hess, Bettina Matthaei: Kräuter & Gewürze. das Kochbuch. 1. Auflage. Gräfe & Unzer, München 2011, ISBN 978-3-8338-2262-9, S. 16 (eingeschränkte Vorschau in der Google-Buchsuche).
- Hermann Römpp: Curcuma. In: Chemielexikon. 5. Auflage. I (A–F). Franck’sche Verlagshandlung, Stuttgart 1962, S. 1006.
- F. W. Daube: Ueber den krystallisirten Farbstoff der Curcuma. In: Journal für Praktische Chemie. Band 2, Nr. 1, 1870, S. 86, doi:10.1002/prac.18700020104.
- G. S. Spicer, J. D. H. Strickland: 906. Compounds of curcumin and boric acid. Part I. The structure of rosocyanin. In: Journal of the Chemical Society. 1952, S. 4644, doi:10.1039/jr9520004644.
- G. S. Spicer, J. D. H. Strickland: 907. Compounds of curcumin and boric acid. Part II. The structure of rubrocurcumin. In: Journal of the Chemical Society. 1952, S. 4650, doi:10.1039/jr9520004650.
- James A. Naftel: Colorimetric Microdetermination of Boron. In: Industrial & Engineering Chemistry Analytical Edition. Band 11, Nr. 7, 1. Juli 1939, S. 407, doi:10.1021/ac50135a029.
- Allgemeine Untersuchungsmethoden. Chemische und Biologische Methoden. In: A. Bömer, A. Juckenack, J. Tillmans (Hrsg.): Handbuch der Lebensmittelchemie. Band 2. Springer-Verlag, Berlin, Heidelberg 1935, ISBN 978-3-662-01948-1 (eingeschränkte Vorschau in der Google-Buchsuche).
- Ajay Goel, Ajaikumar B. Kunnumakkara, Bharat B. Aggarwal: Curcumin as “Curecumin”: From kitchen to clinic. In: Biochemical Pharmacology. Band 75, Nr. 4, 2008, ISSN 0006-2952, S. 787–809, doi:10.1016/j.bcp.2007.08.016 (sciencedirect.com).
- PubMed.gov. Curcumin. National Library of Medicine, abgerufen am 5. Mai 2021.
- Volker Budinger: Curcumin besser als Cortison? In: Deutsche Apotheker Zeitung. 22. November 2016, abgerufen am 6. Mai 2021.
- Jessica Hoppstädter, Nina Hachenthal, Jenny Vanessa Valbuena-Perez, Sebastian Lampe, Ksenia Astanina: Induction of Glucocorticoid-induced Leucine Zipper (GILZ) Contributes to Anti-inflammatory Effects of the Natural Product Curcumin in Macrophages *. In: Journal of Biological Chemistry. Band 291, Nr. 44, 28. Oktober 2016, ISSN 0021-9258, S. 22949–22960, doi:10.1074/jbc.M116.733253, PMID 27629417.
- Tonnesen u. a.: Studies of curcumin and curcuminoids XXVII. Cyclodextrin complexation: Solubility, chemical and photochemical stability. In: Int J Pharm. Band 244, 2002, S. 127–135. PMID 12204572.
- Pan u. a.: Biotransformation of curcumin through reduction and glucuronidation in mice. In: Drug Metab Dispos. Band 27, 1999, S. 486–494. PMID 10101144.
- T. H. Marczylo, R. D. Verschoyle, D. N. Cooke, P. Morazzoni, W. P. Steward, A. J. Gescher: Comparison of systemic availability of curcumin with that of curcumin formulated with phosphatidylcholine. In: Cancer Chemotherapy and Pharmacology. Band 60, Nr. 22, 2007, S. 171–177.
- Wahlström B., Blennow G.: A Study on the Fate of Curcumin in the Rat. In: Acta Pharmacologica et Toxicologica. Nr. 43, 1978, S. 86–92. doi:10.1111/j.1600-0773.1978.tb02240.x.
- Garcea G., Jones D. J., Singh R., Dennison A. R., Farmer P. B., Sharma R. A., Steward W. P., Gescher A. J., Berry D. P.: Detection of curcumin and its metabolites in hepatic tissue and portal blood of patients following oral administration. In: British Journal of Cancer. Nr. 90, 2004, S. 1011–1015. doi:10.1038/sj.bjc.6601623.
- Preetha Anand, Ajaikumar B. Kunnumakkara, Robert A. Newman, Bharat B. Aggarwal: Bioavailability of Curcumin: Problems and Promises. In: Molecular Pharmaceutics. Band 6, 2007, S. 807–818. doi:10.1021/mp700113r.
- Cuomo u. a.: Comparative absorption of a standardized curcuminoid mixture and its lecithin formulation. In: J Nat Prod. Band 74, Nr. 4, 25. Apr 2011, S. 664–669. PMID 21413691.
- N. K. Gupta, V. K. Dixit: Bioavailability enhancement of curcumin by complexation with phosphatidyl choline. In: J Pharm Sci. Band 100, Nr. 5, Mai 2011, S. 1987–1995. PMID 21374628.
- G. Shoba, D. Joy u. a.: Influence of piperine on the pharmacokinetics of curcumin in animals and human volunteers. In: Planta Med. Band 64, Nr. 4, Mai 1998, S. 353–356.
- Brad J. Douglass, Dallas L. Clouatre: Beyond Yellow Curry: Assessing Commercial Curcumin Absorption Technologies. In: Journal of the American College of Nutrition. Band 34, Nr. 4, 2015, S. 347–358, doi:10.1080/07315724.2014.950392, PMID 25856323 (englisch).
- Martin Purpura, Ryan P. Lowery, Jacob M. Wilson, Haider Mannan, Gerald Münch, Valentina Razmovski-Naumovski: Analysis of different innovative formulations of curcumin for improved relative oral bioavailability in human subjects. In: European Journal of Nutrition. Band 57, Nr. 3, April 2018, S. 929, doi:10.1007/s00394-016-1376-9.
- Kathryn M. Nelson, Jayme L. Dahlin, Jonathan Bisson, James Graham, Guido F. Pauli, Michael A. Walters: The Essential Medicinal Chemistry of Curcumin. In: Journal of Medicinal Chemistry. 11. Januar 2017, doi:10.1021/acs.jmedchem.6b00975.
- Monya Baker: Deceptive curcumin offers cautionary tale for chemists. In: Nature. Band 541, Nr. 7636, 9. Januar 2017, S. 144–145, doi:10.1038/541144a.
- Yueliu Sun, Xiaorong Hu, Gangying Hu, Changwu Xu, Hong Jiang: Curcumin Attenuates Hydrogen Peroxide-Induced Premature Senescence via the Activation of SIRT1 in Human Umbilical Vein Endothelial Cells. In: Biological & Pharmaceutical Bulletin. Band 38, Nr. 8, 2015, ISSN 0918-6158, S. 1134–1141, doi:10.1248/bpb.b15-00012.
- Matthew J. Yousefzadeh, Yi Zhu, Sara J. McGowan, Luise Angelini, Heike Fuhrmann-Stroissnigg, Ming Xu, Yuan Yuan Ling, Kendra I. Melos, Tamar Pirtskhalava, Christina L. Inman, Collin McGuckian, Erin A. Wade, Jonathon I. Kato, Diego Grassi, Mark Wentworth, Christin E. Burd, Edgar A. Arriaga, Warren L. Ladiges, Tamara Tchkonia, James L. Kirkland, Paul D. Robbins, Laura J. Niedernhofer: Fisetin is a senotherapeutic that extends health and lifespan. In: EBioMedicine. Band 36, 2018, S. 18–28, doi:10.1016/j.ebiom.2018.09.015, PMID 30279143.
- Wioleta Grabowska, Grażyna Mosieniak, Natalia Achtabowska, Robert Czochara, Grzegorz Litwinienko: Curcumin induces multiple signaling pathways leading to vascular smooth muscle cell senescence. In: Biogerontology. Band 20, Nr. 6, 2019, ISSN 1389-5729, S. 783–798, doi:10.1007/s10522-019-09825-2, PMID 31372798, PMC 6790191 (freier Volltext).
- James W. Daily, Mini Yang, Sunmin Park: Efficacy of Turmeric Extracts and Curcumin for Alleviating the Symptoms of Joint Arthritis: A Systematic Review and Meta-Analysis of Randomized Clinical Trials. In: Journal of Medicinal Food. Band 19, Nr. 8, 1. August 2016, S. 717–729, doi:10.1089/jmf.2016.3705, PMID 27533649.
- Y. Koronyo et al., Retinal amyloid pathology and proof-of-concept imaging trial in Alzheimer’s disease, JCI Insight 2 (2017), doi:10.1172/jci.insight.93621
- Photonik: Alzheimerdiagnose per Augenscan, Photonik, 28. September 2017, abgerufen am 7. August 2020
