Borsäure
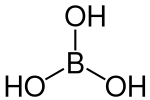
Borsäure (auch: Orthoborsäure, Acidum boricum), H3BO3, ist die einfachste Sauerstoffsäure des Bors. Ihre Salze heißen Borate.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Borsäure | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | H3BO3 | |||||||||||||||||||||
| Kurzbeschreibung |
weißes Pulver[3] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
S02AA03 | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 61,83 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte |
1,49 g·cm−3 (23 °C)[4] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit |
löslich in Wasser (49,2 g·l−1 bei 20 °C)[4] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Zulassungsverfahren unter REACH |
besonders besorgniserregend: fortpflanzungsgefährdend (CMR)[7] | |||||||||||||||||||||
| MAK |
DFG/Schweiz: 10 mg·m−3 (gemessen als einatembarer Staub/Aerosolanteil)[5][8] | |||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||||||||
| ΔHf0 |
−1094,3 kJ/mol[9] | |||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Vorkommen und Gewinnung
Freie Borsäure findet sich in den Wasserdampfquellen (Fumarolen) Mittelitaliens in der Toskana; aus diesen Quellen lässt sich die Säure durch Eindampfen in glänzende Plättchen gewinnen. Ebenfalls in der Toskana kommt die Borsäure als Mineral Sassolin vor. Große Bedeutung haben aber Alkali- und Erdalkalisalze wie beispielsweise das Mineral Kernit Na2[B4O6 (OH)2] · 3 H2O. Ein ähnliches, selteneres Mineral ist Borax, dieses enthält 8 bzw. 10 Äquivalente Kristallwasser. Jenes wird heutzutage aber überwiegend aus Kernit gewonnen. Durch Behandeln von Borax mit Salzsäure oder Schwefelsäure lässt sich Borsäure freisetzen.
Eigenschaften
Reine Borsäure bildet schuppige, farblos-glänzende Kristalle, die bei schnellem Erhitzen in einem geschlossenen System einen Schmelzpunkt von 171 °C haben. Diese bilden eine Schichtstruktur aus, bei der zwischen den einzelnen Borsäuremolekülen Wasserstoffbrückenbindungen ausgebildet werden. Der Abstand zweier Schichten beträgt 318 Pikometer (pm).
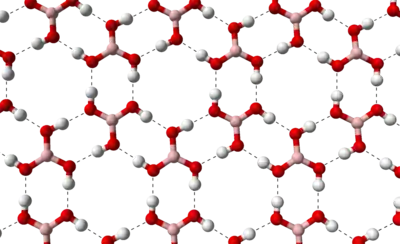
Sie löst sich anfangs nur schwer in Wasser, aber mit steigender Konzentration beschleunigt sich dieser Vorgang. Die Lösung reagiert schwach sauer. Beim Erhitzen der Orthoborsäure spaltet sich Wasser ab, und es entsteht die in mehreren Modifikationen auftretende Metaborsäure HBO2 und schließlich unter weiterer Wasserabspaltung Dibortrioxid (B2O3).
Trotz ihrer drei Wasserstoffatome reagiert Borsäure in Wasser wie eine einprotonige Säure und reagiert zum Tetrahydroxoborat-Ion, B(OH)4−. Hierbei verhält sie sich nicht wie eine Brønsted-Säure als Protonendonator, sondern wie eine Lewis-Säure als Elektronenpaarakzeptor unter Bildung eines Adduktes mit einem Hydroxid-Ion:
Borsäure ist eine sehr schwache Säure (pKs = 9,25). Durch Umsetzung mit mehrwertigen Alkoholen wie zum Beispiel Mannitol kann die Säurestärke erheblich gesteigert werden. Dies ist bedingt durch eine Verschiebung des Gleichgewichtes auf die rechte Seite hin zu einem Tetraoxoborat-Derivat infolge einer Veresterung:
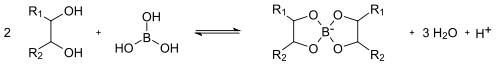
Diese Umsetzung wird zur alkalimetrischen Titration von Borsäure verwendet.
Nachweis

Borsäure und ihre Salze, die Borate, bilden mit Methanol und der wasserentziehenden konzentrierten Schwefelsäure den flüchtigen Borsäuretrimethylester, der mit grüner Flamme brennt und zum qualitativen Nachweis dient.[10]
Verwendung
Borsäure ist ein Zwischenprodukt zur Herstellung von Borosilikatglas, Porzellan, Emaille. Die Weltjahresproduktion von Borsäure beträgt über 2.000.000 Tonnen.[11]

In der Medizin wurde Borsäure als wässrige Lösung (Borwasser) und Salbe (Borsalbe) als mildes Desinfektionsmittel[12] verwendet. Seit dem Rückruf borsäurehaltiger Medikamente 1984 durch das damalige Bundesgesundheitsamt ist Borsäure sowie deren Ester und Salze nur noch für die Pufferung und Isotonisierung von Augentropfen sowie zur Verwendung in homöopathischen Verdünnungen zugelassen.[13]
3%ige Borsäurelösung (Borwasser) kann bei Verätzungen durch Laugen verwendet werden. Sie wirkt selbst nicht ätzend und kann Laugen neutralisieren.
In der Lebensmittelindustrie wird Borsäure als Konservierungsmittel mit der Bezeichnung E 284 verwendet.
Borsäure wird in Desinfektionsmitteln, als Bleichmittel in Spülmitteln sowie als Fungizid und Insektizid (z. B. zur Bekämpfung von Flöhen und Kakerlaken) verwendet.[11][14][15]
Im Baubereich werden Borsäure sowie Borax und andere Borate (Borsalze) zum vorbeugenden Holzschutz, in Beizen sowie als Flammschutzmittel und zur Prävention von Schimmel und Schädlingsbefall bei organischen Dämmstoffen eingesetzt. Beispielsweise war bei Zellulosedämmstoffen ein 8%iger Zusatz üblich, der aber aufgrund neuerer Richtlinien auf 5,5 % begrenzt werden muss.[16]
In Druckwasserreaktoren wird gelöste Borsäure als Neutronenabsorber zur Regelung der Kettenreaktion verwendet. Sie beruht auf dem großen Absorptions-Wirkungsquerschnitt des in natürlichem Bor zu 20 % enthaltenen Isotops 10B für thermische Neutronen. Hierbei erfolgt die Kernreaktion
- .
Borsäure wird zur Berechnung des Kohlenstoffdioxid-Gehaltes in erdgeschichtlichen Zeiten benutzt. Wenn sich der pH-Wert ins Alkalische verändert, wandelt sich die Borsäure in Borat, das Salz der Borsäure, um. Dabei kommt es zu einer Isotopenfraktionierung, da 10Bor bevorzugt in das Borat eingebaut wird. Da Foraminiferen (fossile als auch rezente Einzeller) und andere Schalentiere Borat für den Aufbau ihrer Schale benötigen, kann anhand des Isotopen-Verhältnisses festgestellt werden, welcher pH-Wert zu welchem Zeitpunkt der Erdgeschichte in diesem Gebiet vorlag. Da die Schalen solcher Einzeller als auch Muscheln etc. den Hauptteil des marinen Sediments stellen, können von dort einfach Sedimentkerne entnommen und im Labor auf die beiden Bor-Isotope untersucht werden. Solche Ergebnisse korrelieren hervorragend mit den in Eiskernen eingeschlossenen Luftblasen.
Bei der Verbrennung von Borsäuretrimethylester entsteht eine grüne Flamme, die Borsäureester anderer Alkohole zeigen bei der Verbrennung einen grünen Flammensaum. Diese Eigenschaft wird zur Identifizierung von Methanol genutzt (Schulversuch)[17] und in der Pyrotechnik, um beispielsweise die Flammen von Feuerstäben, Poi oder Feuerschalen zu färben.
In als Spielzeug verkauftem Slime wurden bis zu 1,3 % Borsäure nachgewiesen.[18] Mit dem Borsäuregehalt steigt die Viskosität der schleimigen Masse. Bei Herstellung ist auf konstant niedrigen Gehalt zu achten, da ab einer täglichen Aufnahme von 0,57 mg/kg Körpergewicht mit einer gesundheitlichen Beeinträchtigung gerechnet werden müsse.[19]
Gefahrstofflisten
Im Juni 2010 wurde Borsäure durch die ECHA auf die Kandidatenliste für SVHC (substance of very high concern) aufgenommen. Nach Inkrafttreten der CLP-Verordnung und der REACH-Änderungs-VO 790/2009/EG wurde Borsäure als reproduktionstoxisch gekennzeichnet. Auch Gemische, die freie Borsäure in einer Konzentration von 5,5 % oder mehr enthalten, sind nach der GHS-Verordnung als reproduktionstoxisch zu kennzeichnen.
Einzelnachweise
- Eintrag zu E 284: Boric acid in der Europäischen Datenbank für Lebensmittelzusatzstoffe, abgerufen am 29. Dezember 2020.
- Eintrag zu BORIC ACID in der CosIng-Datenbank der EU-Kommission, abgerufen am 26. Februar 2020.
- Datenblatt Borsäure (PDF) bei Merck, abgerufen am 19. Januar 2011.
- Eintrag zu Borsäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2018. (JavaScript erforderlich)
- Eintrag zu Borsäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 19. April 2014.
- Eintrag zu Boric acid im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Eintrag in der SVHC-Liste der Europäischen Chemikalienagentur, abgerufen am 16. Juli 2014.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 10043-35-3 bzw. Borsäure), abgerufen am 2. November 2015.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-6.
- Gerhart Jander, Ewald Blasius, Joachim Strähle, Eberhard Schweda: Lehrbuch der analytischen und präparativen anorganischen Chemie. 16. Auflage. S. Hirzel Verlag, Stuttgart 2006, ISBN 978-3-7776-1388-8, S. 368.
- BMG Engineering AG: Studie vom 22.1.2013 zum Umgang mit Bor bei der Altlastenbeurteilung im Auftrag des Kantons Aargau, Schweiz; abgerufen im September 2016
- Bassermann; in: Das neue große farbige Lexikon; 1988, ISBN 3-8094-0002-5, S. 640.
- Stellungnahme der Arzneimittelkommission der Deutschen Apotheker vom 23. November 1999, abgerufen am 22. November 2010.
- Das Biochemische Taschenbuch, 1956 von H.M. Rauen, empfiehlt eine Mischung von 10 % Pyrethrum, 40 % Borsäure und 50 % Kaolin in alle Ritzen zu blasen, in denen sich Kakerlaken aufhalten könnten, Springer-Verlag, 2013.
- Chiara Noli, Fabia Scarampella, Stefano Toma - Praktische Dermatologie bei Hund und Katze: Klinik - Diagnose - Therapie ...: "Borsäure und deren salzige Verbindungen führen zu Löchern in der Parasitenhüllen und damit zu einem Absterben durch Dehydration", Schlütersche Verlagsgesellschaft mbH, 2014
- Datenblatt 1 und Datenblatt 2 (Memento vom 13. September 2016 im Internet Archive) Isofloc Zellulosedämmstoff
- Fokus Chemie, Einführungsphase, S. 22, Cornelsen-Verlag 2010.
- Stellungnahme des BfR (früher BgVV) vom 3. März 1995: Borsäuregehalt in Slime zu hoch (PDF; 27 kB). Stand 8. Oktober 2008.
- BfR (früher BgVV): Borsäure in Hüpfknete (PDF; 50 kB) - Gesundheitliche Bewertung Nr. 014/2005 des BfR vom 27. Oktober 2004. Stand 8. Oktober 2008.
