Sirtuin-1
Sirtuin-1 (Sir2, Sirt1) (Gen: SIRT1) ist ein Enzym, das mehrere Regulations-Proteine durch Deacetylierung oder Komplexbildung modifiziert und so beim Menschen und anderen vielzelligen Tieren Teil der Signaltransduktion ist. Sirtuin-1 bremst die Einleitung des Zelltods, die Differenzierung von Muskelzellen, und schaltet den Stoffwechsel auf die Fettverbrennung um. Die früher vermutete Fähigkeit, die Bildung von Heterochromatin stimulieren zu können, ist weniger stark ausgeprägt. Sirtuin-1 wird durch Resveratrol, einen Inhaltsstoff insbesondere von blauen Weinbeeren, und anderen Flavonoiden wie Butein, Piceatannol und Quercetin aktiviert. Ein experimenteller Wirkstoff, SRT1720, aktivierte Sirtuin-1 bei Mäusen so, dass sie trotz fettreicher Kost schlank und leistungsstark blieben.[1][2] SIRT1 zeigt direkte Interaktionen mit 136 Proteinen in der Protein interaktion Netzwerk.[3]
| Sirtuin-1 | ||
|---|---|---|
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 747 Aminosäuren | |
| Kofaktor | NAD+, Zink | |
| Bezeichner | ||
| Gen-Namen | SIRT1 ; SIR2 | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 3.5.1.-, Hydrolase | |
| Reaktionsart | Deacetylierung von Acetyl-Lysin in Acetyl-Peptiden, ADP-Ribosylierung | |
| Substrat | Acetyl-Peptid + NAD+ (Peptide sind p53, ku70, TAF1B, PCAF, MYOD1, Histone, HIV-Tat), Peptid + NAD+ | |
| Produkte | Peptid + Acetyl-NAD+, Nicotinamid + ADP-ribosyliertes Peptid | |
| Orthologe | ||
| Mensch | Hausmaus | |
| Entrez | 23411 | 93759 |
| Ensembl | ENSG00000096717 | ENSMUSG00000020063 |
| UniProt | Q96EB6 | Q923E4 |
| Refseq (mRNA) | NM_001142498 | NM_001159589 |
| Refseq (Protein) | NP_001135970 | NP_001153061 |
| Genlocus | Chr 10: 67.88 – 67.92 Mb | Chr 10: 63.32 – 63.38 Mb |
| PubMed-Suche | 23411 | 93759 |
Funktion
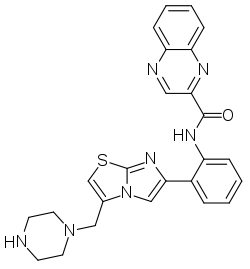
Sirtuin-1 ist eines von sieben Sirtuinen im Menschen, die alle die Fähigkeit zur Deacetylierung besitzen (bevorzugt die Aminosäure Lysin im Zielpeptid), jedoch unterschiedliche Angriffspeptide haben.[4]
- p53, dessen Aktivität als Transkriptionsfaktor durch Deacetylierung verringert wird, wodurch die Zell-Apoptose, die beispielsweise als Antwort auf DNA-Schaden oder oxidativen Stress erfolgt, hinausgezögert wird. Sirtuin-1 ist in der Lage, der Acetylierung von p53 durch den Tumorsuppressor PML entgegenzuwirken
- Forkhead-Box-Proteine, deren Deacetylierung parallel zu der von p53 die Apoptose verzögert. Zusätzlich wird durch Komplexbildung mit FOXO3 die Robustheit der Zelle gegen oxidativen Stress gestärkt
- das DNA-Reparaturprotein ku70, das den Apoptose-einleitenden Faktor bax absondert
- den Transkriptionsfaktor PGC1A, wodurch die Glukoneogenese und der Export von Glukose aus der Leber angekurbelt wird
- Histone 1, 3 und 4, die zumindest in der Bäckerhefe durch Sirtuin-1 deacetyliert wurden, um die Heterochromatin-Bildung einzuleiten
Weiterhin wirkt Sirtuin-1 unter anderem durch direkte Bindung an
- PPARγ, der selbst und dessen Kofaktoren Ncor und Smrt durch Sirtuin-1 im Hungerzustand gebunden werden, wodurch vermehrt Fette aus weißen Adipozyten mobilisiert werden. Gleichzeitig werden durch Sirtuin-1 die Neubildung von Fettzellen gestoppt und ausdifferenzierte Zellen lysiert. Allein die Lyse von Fettzellen ist bereits ausreichend, um die Lebensverlängerung bei Versuchen mit Mäusen zu erklären
- FOXO3 und p53 nur bei Hungersituation, wobei beide Faktoren und Hunger vorhanden sein müssen, damit Sirtuin-1 an PPARγ wirken kann. Das bedeutet, dass FOXO3, p53 und Sirtuin-1 zusammen ein System bilden, das auf Hungerzustand reagiert.
Hemmung
Der Tumorsuppressor DBC1 (deleted in breast cancer) ist ein natürlicher Inhibitor für Sirtuin-1.
Pharmakologie
Aufgrund der Wirkungen des Sirtuin-1 im Körper erscheint es sinnvoll, den Spiegel des Proteins bei bestehendem oder drohendem Diabetes mellitus Typ 2 zu erhöhen. Ebenso versprechen sich manche Pharmakologen, durch Aktivierung der Sirtuin-1-Signalwege die Langlebigkeit von Menschen im Allgemeinen zu erhöhen. Bisher standen dafür nur Empfehlungen zur Ernährung zur Verfügung, die besonders die bekannte Wirkung des Resveratrol betrafen.
Seit 2007 stehen der Industrie Substanzen zu Gebot, die die aktivierende Wirkung des Resveratrol übertreffen. Insbesondere soll es sich bei der Substanz SRT1720 um eine Wirkungssteigerung um den Faktor 1000 handeln, was die tägliche Einnahme auf den Milligramm-Bereich reduzieren würde.[5]
Einzelnachweise
- UniProt Q96EB6
- J. N. Feige et al.: Specific SIRT1 Activation Mimics Low Energy Levels and Protects against Diet-Induced Metabolic Disorders by Enhancing Fat Oxidation. Cell Metabolism 8/5/2008: 347–348 doi:10.1016/j.cmet.2008.08.017.
- Sharma et al., 2012: Interactomic and pharmacological insights on human Sirt-1. Front. Pharmacol. 3:40. doi:10.3389/fphar.2012.00040.
- Sirtuin-1. In: Online Mendelian Inheritance in Man. (englisch).
- J. C. Milne et al.: Small molecule activators of SIRT1 as therapeutics for the treatment of type 2 diabetes. Nature 450/7170/2007: 712–716. PMID 18046409.
Literatur
- Rubinsztein, D.C., Marino, G., Kroemer, G. (2011): Autophagy and aging. In: Cell. 146(5):682-695. PMID 21884931