Flavonoide
Die Flavonoide sind eine Gruppe von Naturstoffen, zu denen ein Großteil der Blütenfarbstoffe gehört. Flavonoide zählen zur Gruppe der Polyphenole. Sie leiten sich formal vom Grundkörper Flavan (2-Phenylchroman) ab: zwei aromatische Ringe, die durch einen Tetrahydropyran-Ring verbunden sind. In der Natur gibt es rund 8000 Verbindungen, deren Vielfalt durch verschiedene Oxidationsstufen im sauerstoffhaltigen Ring, unterschiedliche Substitutionen an den aromatischen Ringen und das Anhängen von Zuckern (Glykosid-Bildung) entsteht. Die Biosynthese verläuft über den Shikimisäureweg.
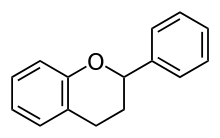
Flavonoide sind universell in Pflanzen als sekundäre Pflanzenstoffe vorhanden, somit auch in der menschlichen Nahrung. Ihnen werden besonders antioxidative Eigenschaften zugeschrieben. Etliche flavonoidhaltige Pflanzen werden medizinisch genutzt.
Die Flavonoide wurden in den 1930er-Jahren vom Nobelpreisträger Albert Szent-Györgyi entdeckt und zunächst als „Vitamin P“ bezeichnet. Das „P“ im Vitamin P steht für „Permeabilitätsfaktor“.[1][2]
Name

Einige Pflanzen wie die Färber-Eiche (Quercus tinctoria), der Färberwau (Reseda luteola) oder der Färbermaulbeerbaum (Maclura tinctoria) wurden in der Vergangenheit zum Gelbfärben verwendet. Nachdem man ihre Inhaltsstoffe identifiziert hatte, nannte man diese Gruppe von Farbstoffen Flavone, nach dem lateinischen Wort flavus für gelb. Als man erkannte, dass sehr viele Inhaltsstoffe zwar gleichartig aufgebaut, aber von anderer Farbe oder farblos sind, nannte man die Stoffgruppe Flavonoide.[3]
Vorkommen

Flavonoide sind im Pflanzenreich universell verbreitet und kommen sowohl in Samenpflanzen als auch in Moosen und Farnen vor. Nur von wenigen Mikroorganismen ist die Bildung von Flavonoiden bekannt, so etwa vom Gießkannenschimmel Aspergillus candidus. Tiere können keine Flavonoide bilden. Das Vorkommen in manchen Tierarten, etwa in den Flügeln mancher Schmetterlinge, ist auf die Aufnahme pflanzlicher Flavonoide mit der Nahrung und ihre Einlagerung in den Körper zurückzuführen.[4] Nach anderen Angaben sind die Flavonoide auf die Pflanzen beschränkt.[3]
Struktur, Vielfalt und Untergruppen
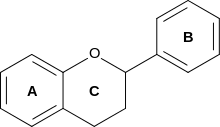
Das Grundgerüst der Flavonoide besteht aus zwei aromatischen Ringen, die über eine C3-Brücke verbunden sind. Ring A zeigt meist das Substitionsmuster des Phloroglucins auf, was auf seine Herkunft aus dem Polyketidstoffwechsel hinweist. Ring B und die C3-Brücke stammen aus dem Shikimisäureweg, Ring B ist dabei meist an 4' hydroxyliert, häufig auch an 3' oder 3' und 5'. Die C3-Brücke ist bei den allermeisten Flavonoiden (Ausnahme Chalkone) zu einem O-heterozyklischen Ring geschlossen (Ring C). Die Grundstruktur der Flavonoide ist somit das Flavan (2-Phenylchroman). Seltener ist Ring B versetzt auf die Position 3 (Isoflavan, abgeleitet davon die Isoflavone), oder 4 (Neoflavan).[3]
Insgesamt sind bereits über 8000 verschiedene Flavonoide beschrieben worden (Stand 2006). Die Ausgestaltung, besonders der Oxidationsgrad an der C3-Brücke, dient zur Gliederung der Flavonoide in die verschiedenen Untergruppen.[3]
Sechs große Untergruppen kommen in den meisten höheren Pflanzen vor: Chalkone, Flavone, Flavonole, Flavandiole, Anthocyanidine und Kondensierte Tannine. Die Aurone sind sehr weit verbreitet, aber nicht ubiquitär. Auf wenige Gruppen beschränkt sind etwa die Isoflavone (v. a. in Fabaceae), und 3-Deoxy-Anthocyanidine, die als Vorstufe der Phlobaphene bspw. von Vitis vinifera, Arachis hypogaea und Pinus sylvestris gebildet werden.[5]
Die strukturelle Vielfalt der Flavonoide geht zurück auf die Vielzahl der Substitutionsmuster an den Ringen A und B, sowie darauf, dass die Flavonoide meist nicht frei, sondern als Glykoside vorliegen. Es sind über 80 verschiedene Zucker nachgewiesen. Für das Quercetin sind 179 verschiedene Glykoside beschrieben worden.[6]
| Untergruppe | Grundstruktur | Beispiele |
|---|---|---|
| Flavanole |  |
Catechin, Gallocatechin, Epicatechin, Epigallocatechingallat |
| Flavanonole |  |
Taxifolin |
| Chalkone |  |
Isoliquiritigenin, Xanthohumol (R2 = OH) |
| Anthocyanidine (Anthocyane) („Flavenole“) |
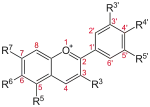 |
Cyanidin, Delphinidin, Malvidin, Pelargonidin, Peonidin, Petunidin (R3 = OH) |
| Flavonole |  |
Morin, Quercetin (Glycosid Rutin und Methylether Isorhamnetin), Kaempferol, Myricetin, Fisetin |
| Aurone |  |
Aureusidin |
| Flavone | 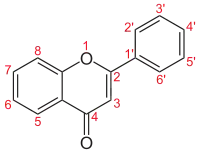 |
Luteolin, Apigenin |
| Flavanone |  |
Hesperetin, Naringenin, Eriodictyol |
| Isoflavone | 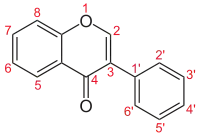 |
Genistein, Daidzein, Licoricidin |
Biosynthese
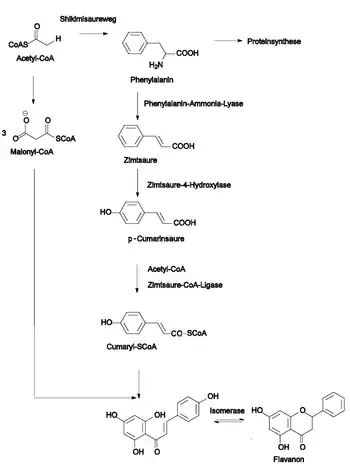
Ausgangspunkt für die Biosynthese der Flavonoide ist die aromatische Aminosäure Phenylalanin, die über den Shikimisäureweg gebildet wird. Phenylalanin wird durch die Phenylalanin-Ammoniak-Lyase (PAL) in trans-Zimtsäure umgewandelt. Diese wird wiederum durch die Zimtsäure-4-Hydroxylase zu p-Cumarsäure hydroxyliert. Dieser Weg ist allen Phenylpropanoiden gemeinsam. Die p-Cumarsäure wird zu Cumaryl-Coenzym A aktiviert.[7]
Im nächsten Schritt wird der zweite aromatische Ring gebildet: das Enzym Chalcon-Synthase (CHS) bildet aus dem Cinnamoyl-CoA und drei Molekülen Malonyl-Coenzym A, die aus dem Fettsäuresyntheseweg stammen, das Chalcon. Chalcon steht durch die Wirkung der Chalcon-Isomerase (CHI) mit dem Flavanon im Gleichgewicht. Damit erfolgt der Ringschluss des dritten Ringes.[7]
Die drei Schlüsselenzyme (PAL, CHS und CHI) sowie teilweise die Enzyme der weiteren Syntheseschritte liegen als Enzymkomplexe vor. Wahrscheinlich befindet sich der Komplex an der cytosolischen Seite des Endoplasmatischen Reticulums.[5]
Vom Flavanon führen die verschiedenen Wege zu den Flavonen, Flavonolen, Isoflavonen und Anthocyanidinen.[7]
Die Biosynthese der Flavonoide wird durch Licht induziert, die Speicherung erfolgt vorwiegend in der Vakuole.[8]
Der Großteil der Enzyme für die Flavonoid-Biosynthese stammt aus drei Enzymklassen, die in allen Organismen vorkommen: Oxoglutarat-abhängige Dioxygenasen, NADPH-abhängige Reduktasen und Cytochrom-P450-Hydroxylasen. Die beiden Schlüsselenzyme CHS und CHI gehören zu anderen Familien. CHI dürfte sowohl bezüglich Sequenz wie dreidimensionaler Struktur einzigartig für die Pflanzen sein. CHS wiederum gehört zur Superfamilie der pflanzlichen Polyketid-Synthasen.[5]
Bedeutung
Die verschiedenen Flavonoide erfüllen in den Pflanzen eine Vielzahl von Funktionen.

Flavonoide bilden die wichtigste Gruppe unter den Blütenfarbstoffen und dienen hier der Anlockung von Bestäubern. Die Anthocyanidine liefern eine Vielfalt von Farben, die von Orange über Rot bis Blau reichen. In allen anthocyanidinhaltigen Blüten sind auch Flavone und/oder Flavonole enthalten, die der Stabilisierung der Anthocyanidine dienen, in höheren Konzentrationen aber auch eine Verschiebung der Blütenfarbe in den Blaubereich bewirken. Gelbe Blütenfarbe wird seltener durch Flavonoide verursacht. Flavonole wie Gossypetin und Quercetagetin sind für die gelbe Blütenfarbe in Gossypium hirsutum, Primula vulgaris und einigen Korbblütlern wie Chrysanthemum segetum verantwortlich. Chalkone und Aurone bedingen die gelbe Blütenfarbe in einigen anderen Korbblütlern wie Coreopsis und Dahlia und in neun weiteren Pflanzenfamilien. Häufig kommen in Korbblütlern gelbe Flavonoide zusammen mit den ebenfalls gelben Carotinoiden vor. Weiße Blütenfarbe wird zu 95 % durch Flavonoide bedingt: Flavone wie Luteolin und Apigenin und Flavonole wie Kaempferol und Quercetin, wobei Flavonole etwas weiter im langwelligen Bereich absorbieren.[9]
Die kondensierten Tannine interagieren mit den Glykoproteinen im Speichel von Herbivoren und wirken adstringierend. Sie vermindern die Verdaubarkeit der Pflanzen und schrecken so viele potentielle Herbivoren ab.[4]
Andere Flavonoide fungieren als Fraßschutz gegen Herbivoren (Repellent). Für spezialisierte Insekten sind solche Flavonoide wiederum Fraß-Stimulantien.[4] Besonders Flavon- und Flavonol-Glykoside, etwa basierend auf Rutin, Quercitrin und Isoquercitrin, sind für Insekten toxisch, während sie für höhere Tiere ungiftig sind. Das Wachstum verschiedener Schmetterlingsraupen reduziert sich bei Anwesenheit von bspw. Isoquercitrin in der Nahrung dramatisch, auf 10 % der Kontrollgruppen. Diese Flavonoide kommen vorwiegend in krautigen Pflanzen vor und dürften hier die kondensierten Tannine der Holzpflanzen ersetzen.[10]
Besonders Flavone und Flavonole fungieren als Schutz gegen UV-Strahlung und kurzwelliges Licht.[4] Sie werden in freier Form von Pflanzen an extremen Standorten wie in ariden oder alpinen Gebieten an der Blattoberfläche abgelagert, häufig in Form von mehlartigen Belagen. Sie verhindern so die photooxidative Zerstörung von Membranen und Fotosynthesepigmenten. Aufgrund ihrer Lipophilie reduzieren sie auch die Besiedlung der Blattoberfläche mit Mikroorganismen. Die Flavonoide haben aber auch direkt antivirale, antibakterielle[11] und antifungale Wirkung.[12]
Bestimmte Pflanzenflavonoide spielen eine Rolle in der Regulation der Genexpression des Knöllchenbakteriums Rhizobium.[4]
Stark methoxylierte Flavonoide finden sich häufig in Knospen-Exsudaten und anderen lipophilen Sekreten. Sie wirken fungizid, ebenso das Nobiletin in Citrus-Blättern.[4]
Flavonoide dienen als strukturelles Leitmotiv zur Entwicklung selektiver GABAA-Rezeptor-Liganden.[13]
Flavonoide in Nahrung und Medizin

Nahrung
_in_the_European_Union.png.webp)
_in_the_European_Union.png.webp)
Flavonoide sind unter anderem enthalten in Äpfeln, Birnen, Trauben, Kirschen, Pflaumen, Beeren, Zwiebeln, Grünkohl, Auberginen, Soja und schwarzem und grünem Tee.[15][16]
Der Mensch nimmt Flavonoide mit der Nahrung in größeren Mengen auf. Rund zwei Drittel der rund ein Gramm umfassenden phenolischen Substanzen, die der Mensch täglich zu sich nimmt, sind Flavonoide. Die Hauptgruppe sind dabei Flavanole (insbesondere in Ländern mit Teekonsum).[14] Über lange Zeit wurde angenommen, dass die potentielle Wirkung von Flavonoiden auf deren antioxidativen Effekten beruht,[3] allerdings wird das zunehmend angezweifelt und andere Wirkungsweisen sind wahrscheinlicher.[17]
Epidemiologische Studien zeigten ein geringeres Risiko für verschiedene Krankheiten bei höherer Flavonoidaufnahme, darunter etwa Sterblichkeit durch Herz-Kreislauf-Erkrankungen. Flavonoide wirken auf den Arachidonsäure-Stoffwechsel und damit auf die Blutgerinnung. Ob Flavonoide auch direkt gegen Krebs bzw. dessen Entstehung wirksam sind, ist noch Gegenstand der Forschung.[18]
Für einige Verbindungen wurde in In-vitro-Tests eine mutagene oder genotoxische Wirkung gezeigt.[19] Extrakte von grünem Tee stehen im Verdacht, leberschädigend zu sein.[20] Eine Nebenwirkung eines inzwischen vom Markt genommenen Arzneimittels auf (+)-Catechin-Basis war unter anderem hämolytische Anämie.[21] Weiterhin stehen Flavonoide im Verdacht, zu einem vorzeitigen Verschluss des ductus arteriosus zu führen.[22]
Bestimmte Flavonoide führen zu einer starken Hemmung der Cytochrom-P450-abhängigen Monooxygenasen (Phase-I-Enzyme), andere wiederum zu einer Aktivierung. Es kann auch eine dosisabhängige Aktivierung von Phase-II-Enzymen kommen. All dies kann zu Wechselwirkungen mit Arzneistoffen führen, etwa bei Grapefruit.[6]
Pharmazeutische Bedeutung

Etliche flavonoidhaltige Arzneidrogen werden therapeutisch genutzt, daneben auch einige Reinstoffe. Sie werden als Venenmittel eingesetzt aufgrund ihrer gefäßschützenden, ödemprotektiven Wirkung, als Herz-Kreislaufmittel wegen ihrer positiv inotropen, antihypertensiven Wirkung, als Diuretika, als Spasmolytika bei Magen-Darm-Beschwerden sowie als Lebertherapeutika. Ihre Wirkung wird hauptsächlich auf ihre antioxidativen Eigenschaften sowie die Hemmung von Enzymen zurückgeführt.[3]
Epidemiologische, wie auch die meisten In-vivo-Studien deuten an, dass Flavonoide einen positiven Einfluss auf verschiedene Herz-Kreislauf-Erkrankungen haben. Traditionell wurden diese Effekte nur ihren antioxidativen Aktivitäten zugeschrieben. Jedoch gibt es neben der unmittelbaren Bindung reaktiver Sauerstoffspezies (ROS) eine Vielzahl anderer Effekte, die in pharmakologisch erreichbaren Konzentrationen auch für den positiven kardiovaskulären Einfluss der Flavonoide wie z. B. Taxifolin verantwortlich sein können. Dazu gehören insbesondere die Hemmung der ROS-bildenden Enzyme, Hemmung der Thrombozytenfunktion, Hemmung der Leukozyten-Aktivierung und gefäßerweiternde Eigenschaften.[23]
Unter den zahlreichen Wirkungen von Flavonoiden, die in In-vitro- und In-vivo-Versuchen nachgewiesen wurden, sind die wichtigsten:[3]
- antiallergische und antiphlogistische Wirkung
- antivirale und antimikrobielle Wirkung
- antioxidative Wirkung
- antiproliferative und antikanzerogene Wirkung
Flavonoide wirken über mehrere Wirkungsmechanismen. Im Vordergrund stehen dabei die Interaktion mit DNA und Enzymen, die Aktivierung von Zellen, ihre Eigenschaft als Radikalfänger sowie die Beeinflussung verschiedener Signaltransduktionswege in den Zellen (NF-κB, MAPK). Flavonoide hemmen über dreißig Enzyme im menschlichen Körper. Sie aktivieren verschiedenste Zelltypen des Immunsystems. Die beiden letzten Eigenschaften sind etwa für die entzündungshemmende Wirkung von Flavonoiden verantwortlich.[3]
Folgende Flavonoide werden als Reinstoffe als Venenmittel genutzt:[3]
- Citrusbioflavonoide, Hesperidin
- Diosmin
- Rutin und Hydroxymethylrutinoside
Unter den Arzneidrogen überwiegen solche, die Flavonolglykoside und Glykosylflavone enthalten. Wichtige Arzneidrogen, die größere Mengen an Flavonoiden enthalten, sind:[3]
- Arnikablüten (Arnika)
- Birkenblätter (Hänge-Birke, Moor-Birke)
- Buchweizenkraut (Fagopyrum esculentum)
- Ginkgoblätter (Ginkgo)
- Goldrutenkraut (aus Solidago virgaurea, Solidago gigantea und Solidago canadensis)
- Holunderblüten (Schwarzer Holunder)
- Hopfenzapfen (Echter Hopfen)
- Kamillenblüten (Kamille)
- Katzenpfötchenblüten (Gewöhnliches Katzenpfötchen)
- Lärchenholz (Sibirische Lärche)
- Mädesüßkraut und -blüten (Mädesüß)
- Mariendistelfrüchte (Mariendistel)
- Passionsblumenkraut (aus Passiflora incarnata)
- Bitterorangenschale (Bitterorange)
- Ringelblumenblüten (Ringelblume)
- Römische Kamille
- Rotes Weinlaub (Vitis vinifera)
- Saflorblüten (Saflor)
- Stiefmütterchenkraut (Viola arvensis und Viola tricolor)
- Süßholzwurzel (Süßholz)
- Weißdornblätter mit Blüten (mehrere Weißdorn-Arten)
Literatur
- Ø. M. Andersen, K. R. Markham: Flavonoids: Chemistry, Biochemistry and Applications. CRC Press, Taylor and Francis, Boca Raton 2006, ISBN 978-0-8493-2021-7.
Einzelnachweise
- Stephen Rusznyák, Albert Szent-Györgyi: Vitamin P: Flavonols as Vitamins. In: Nature. Band 138, Nr. 3479, Juli 1936, doi:10.1038/138027a0.
- Annett Steinbach: Pseudovitamine: Mehr Schein als Sein. In: Verband für Unabhängige Gesundheitsberatung. 2006, abgerufen am 26. Dezember 2021.
- Rudolf Hänsel, Otto Sticher (Hrsg.): Pharmakognosie. Phytopharmazie. 9. Auflage. Springer Medizin Verlag, Heidelberg 2009, ISBN 978-3-642-00962-4, S. 1098–1152.
- Martin Luckner: Secondary Metabolism in Microorganisms, Plants and Animals. 3. Auflage, VEB Gustav Fischer Verlag, Jena 1990, ISBN 3-334-00322-1, S. 406–415.
- Brenda Winkel-Shirley: Flavonoid Biosynthesis. A Colorful Model for Genetics, Biochemistry, Cell Biology, and Biotechnology. In: Plant Physiology. Band 126, 2001, S. 485–493, doi:10.1104/pp.126.2.485.
- Bernhard Watzl, Gerhard Rechkemmer: Basiswissen aktualisiert: Flavonoide. In: Ernährungs-Umschau. Band 48, Nr. 12, 2001 (ernaehrungs-umschau.de).
- Hans-Walter Heldt: Pflanzenbiochemie. Spektrum Akademischer Verlag, Heidelberg 1996, ISBN 3-8274-0103-8, S. 423–437.
- Dieter Schlee: Ökologische Biochemie. 2. Auflage. Gustav Fischer Verlag, Jena 1992, ISBN 3-334-60393-8, S. 67 f.
- J. B. Harborne: Introduction to Ecological Biochemistry. Dritte Auflage. Academic Press, London 1988, ISBN 0-12-324684-9, S. 47–53.
- J. B. Harborne: Introduction to Ecological Biochemistry. Dritte Auflage. Academic Press, London 1988, ISBN 0-12-324684-9, S. 95, 175 f.
- Joseph Naghski, Michael J. Copley, James F. Couch: The antibacterial action of flavonols. In: Journal of Bacteriology. Band 54, 34 (1947).
- Dieter Schlee: Ökologische Biochemie. 2. Auflage. Gustav Fischer Verlag, Jena 1992, ISBN 3-334-60393-8, S. 271 f.
- J. R. Hanrahan, M. Chebib, G. A. Johnston: Flavonoid modulation of GABA(A) receptors. In: Br J Pharmacol. 163, Nr. 2, 2011, S. 234–245. doi:10.1111/j.1476-5381.2011.01228.x. PMID 21244373. PMC 3087128 (freier Volltext).
- Anna Vogiatzoglou, Angela A. Mulligan, Marleen A. H. Lentjes, Robert N. Luben, Jeremy P. E. Spencer: Flavonoid Intake in European Adults (18 to 64 Years). In: PLOS ONE. Band 10, Nr. 5, 26. Mai 2015, S. e0128132, doi:10.1371/journal.pone.0128132 (plos.org [abgerufen am 15. August 2017]).
- Sekundäre Pflanzenstoffe und ihre Wirkung auf die Gesundheit - Eine Aktualisierung anhand des Ernährungsberichts 2012 - DGE. (HTML) Deutsche Gesellschaft für Ernährung, Dezember 2014, abgerufen am 7. Oktober 2021.
- Sekundäre Pflanzenstoffe Tabelle - Flavonoide und Co. - Gesundheitsportal. (HTML) Öffentliches Gesundheitsportal Österreichs, 13. Dezember 2018, abgerufen am 7. Oktober 2021.
- Robert J. Williams, Jeremy P. E. Spencer, Catherine Rice-Evans: Flavonoids: antioxidants or signalling molecules? In: Free Radical Biology and Medicine. Band 36, Nr. 7, S. 838–849, doi:10.1016/j.freeradbiomed.2004.01.001 (elsevier.com [abgerufen am 15. August 2017]).
- Mit Vitaminen Krebs vorbeugen? In: Deutsche Krebsgesellschaft. 17. Mai 2018, abgerufen am 26. Dezember 2021.
- José Rueff et al.: Genetic toxicology of flavonoids: the role of metabolic conditions in the induction of reverse mutation, SOS functions and sister-chromatid exchanges. In: Mutagenesis. Band 1, Nr. 3, Mai 1986, S. 179–183, doi:10.1093/mutage/1.3.179, PMID 3331657.
- Stephanie E. Martinez, Neal M. Davies, Jonathan K. Reynolds: Toxicology and Safety of Flavonoids. In: FLAVONOID PHARMACOKINETICS. John Wiley & Sons, Inc., 2012, ISBN 978-1-118-46852-4, S. 249–280, doi:10.1002/9781118468524.ch6.
- D. Shinkov, I. Urumov, N. Doĭchinova, V. Manolova, R. Ananieva: [Immune hemolytic anemia caused by catergen]. In: Vutreshni Bolesti. Band 28, Nr. 5, 1989, S. 84–87, PMID 2618015.
- Paulo Zielinsky, Stefano Busato: Prenatal effects of maternal consumption of polyphenol-rich foods in late pregnancy upon fetal ductus arteriosus. In: Birth Defects Research Part C: Embryo Today: Reviews. Band 99, Nr. 4, 1. Dezember 2013, S. 256–274, doi:10.1002/bdrc.21051.
- P. Mladenka, L. Zatloukalová, T. Filipský, R. Hrdina: Cardiovascular effects of flavonoids are not caused only by direct antioxidant activity. In: Free Radic Biol Med. 2010, 49, S. 963–975, PMID 20542108.