Vibrio parahaemolyticus
Vibrio parahaemolyticus ist ein gramnegatives Bakterium aus der Gattung der Vibrionen. Die Zellen sind fakultativ anaerob, sie können mit und ohne Sauerstoff leben. Vibrio parahaemolyticus lebt im Meerwasser und kann bei Aufnahme in den menschlichen Verdauungstrakt zu bakterieller Gastroenteritis führen. Ein solcher Krankheitsausbruch in Japan führte 1951 zur Entdeckung des Erregers durch Fujino Tsunesaburō. Seit 1998 treten auch Erkrankungen in größerem Ausmaß in Nord- und Südamerika sowie Europa auf, als Infektionsquellen sind Fische und Meeresfrüchte von Bedeutung.
| Vibrio parahaemolyticus | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
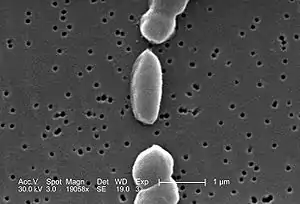
Elektronenmikroskopische Aufnahme von Vibrio parahaemolyticus | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Vibrio parahaemolyticus | ||||||||||||
| (Fujino et al. 1951) Sakazaki et al. 1963 |
Vibrio parahaemolyticus weist einen umfangreichen Bestand an Virulenzfaktoren auf, die bei der Infektion des menschlichen Wirtes eine Rolle spielen, sie sind immer noch Gegenstand der Forschung. Die Spezies umfasst sehr viele Bakterienstämme, die nach den in der Zelle enthaltenen Antigenen in Serotypen eingeteilt werden. Von den 76 bisher identifizierten Serotypen sind 12 pathogen, können also Krankheiten verursachen.
Merkmale
Erscheinungsbild
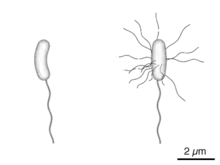
Vibrio parahaemolyticus besitzt nicht die für die meisten Vertreter der Gattung Vibrio typische Zellform eines gekrümmten Stäbchens, sondern seine Zellen sehen lediglich stäbchenförmig aus.[1] In der Gram-Färbung verhält er sich gramnegativ, wird also durch die verwendeten Farbstoffe rot angefärbt. Verursacht wird dies durch eine dünne Mureinschicht in der Zellwand. Überdauerungsformen wie Endosporen werden nicht gebildet.[2]
Er bewegt sich – ähnlich wie Vibrio cholerae – mit einer einzelnen Geißel an einem Ende des Zellleibs fort. In dieser Form – als swimmer cell („schwimmende Zelle“) bezeichnet – ist das Bakterium im natürlichen Habitat Meerwasser vorzufinden. Wenn sich die Viskosität des umgebenden Mediums erhöht, führt dies zu einer Abnahme der Geschwindigkeit, mit der sich die Geißel dreht. Als Folge bildet V. parahaemolyticus nun viele peritriche Flagellen aus und verändert sich zur sogenannten swarmer cell („schwärmende Zelle“). Diese Form bietet den Vorteil des Schwärmens über feste oder halbfeste Substrate.[3] Die meisten Stämme besitzen eine Kapsel, die der Bakterienzellwand aufgelagert ist, und werden deshalb den K-Serogruppen zugeordnet, das K steht für Kapsel-Antigen.[4]
Wachstum und Stoffwechsel
Vibrio parahaemolyticus ist fakultativ anaerob und kann sich also auch vermehren, wenn kein Sauerstoff vorhanden ist. Er ist Katalase-positiv und Oxidase-positiv, letzteres dient als Unterscheidungsmerkmal zu Vertretern der Enterobacteriaceae.[5] Die Temperatur im natürlichen Lebensraum der Küstengewässer liegt bei 10–15 °C oder darüber.[6] Eine Vermehrung in natürlichen Gewässern ist ab einem Temperaturbereich von 14–19 °C beobachtet worden, dies ist ein für die Monate April und Mai typischer Temperaturbereich. Bei niedrigeren Temperaturen lässt sich Vibrio parahaemolyticus nicht im Wasser nachweisen, sondern im Sediment.[7] Viele der untersuchten Stämme wachsen optimal bei etwas höheren Temperaturen (20–30 °C), somit gehört V. parahaemolyticus zu den mesophilen Bakterien.[8] Dies nutzt man, um ihn im Rahmen einer mikrobiologischen Untersuchung zu kultivieren. V. parahaemolyticus ist im Meerwasser beheimatet und ist daher halophil („salzliebend“). Folglich kann er in Nährmedien mit erhöhter Salzkonzentration kultiviert werden.[9] Dabei wächst er in einem Medium, das bis zu 8 % Natriumchlorid (Kochsalz) enthält und benötigt für das Wachstum auch einen Mindestgehalt an Natriumchlorid. Dieser liegt bei 2–3 % und somit deutlich höher als der Kochsalzgehalt in gängigen Nährmedien, in denen er nicht kultiviert werden kann.[4]
Wie andere Vertreter seiner Gattung betreibt V. parahaemolyticus einen chemoorganotrophen und heterotrophen Stoffwechsel, er benutzt organische Verbindungen als Energiequelle und ebenso zum Aufbau zelleigener Stoffe. Sein Stoffwechsel ähnelt dem der Vertreter der Enterobacteriaceae, er kann mehrere Substrate in einer Gärung verwerten.[2] So werden verschiedene Kohlenhydrate (z. B. Glucose, Arabinose, Mannose) und der Zuckeralkohol Mannitol fermentativ zu Säuren und anderen Produkten abgebaut. Außerdem besitzt er die Enzyme Ornithindecarboxylase (ODC) und Lysindecarboxylase (LDC), die die Abspaltung von Kohlenstoffdioxid bei den Aminosäuren Ornithin bzw. Lysin ermöglichen.[4] Daher kann auch eine „Bunte Reihe“, die zur Unterscheidung der Enterobacteriaceae verwendet wird, für die Identifizierung von V. parahaemolyticus eingesetzt werden.
Genetik
Das Genom des Stammes Vibrio parahaemolyticus RIMD 2210633 (Serovar O3:K6) wurde im Jahr 2003 vollständig sequenziert.[10] Der für die Untersuchung verwendete Bakterienstamm wurde 1996 aus einer Stuhlprobe eines Patienten mit Gastroenteritis in Osaka (Japan) isoliert. Die Genomgröße beträgt 5166 Kilobasenpaare (kb)[8] und entspricht damit in etwa der Genomgröße von Escherichia coli. Es sind 4832 Proteine annotiert.[10] Wie beim verwandten Choleraerreger verteilt sich auch das Genom von V. parahaemolyticus auf zwei zirkulären Chromosomen, was für Bakterien ungewöhnlich ist, da die meisten Bakterien nur ein einziges kovalent geschlossenes, ringförmiges Bakterienchromosom besitzen. Chromosom 1 von V. parahaemolyticus umfasst 3289 kb, während Chromosom 2 mit 1877 kb kleiner ausfällt. Bedingt durch die große Anzahl an Bakterienstämmen sind zurzeit (2014) noch mehr als 100 Genomprojekte in Arbeit, aber noch nicht abgeschlossen.[11]
Pathogenität
Vibrio parahaemolyticus wird durch die Biostoffverordnung in Verbindung mit der TRBA (Technische Regeln für Biologische Arbeitsstoffe) 466 der Risikogruppe 2 zugeordnet.[12] V. parahaemolyticus weist einen umfangreichen Bestand an Virulenzfaktoren auf, die es ihm erlauben, Menschen als Wirt zu besiedeln und Krankheiten zu verursachen. Üblicherweise erfolgt nach Aufnahme der Krankheitserreger in den Darm dort die Produktion von Toxinen durch die Bakterien.[3]
Die Pathogenität von V. parahaemolyticus beruht auf der Freisetzung eines Exotoxins, ähnlich wie dies auch bei Vibrio cholerae und dem Choleratoxin (CTX) der Fall ist. V. parahaemolyticus setzt ein thermostabiles Toxin mit hämolytischer Aktivität frei.[6] Es wird auch mit der Abkürzung TDH bezeichnet, nach dem englischen thermostable direct hemolysin („thermostabiles, direktes Hämolysin“).[13] Weiterhin findet sich noch die Bezeichnung Kanagawa-Toxin bzw. Kanagawa-Hämolysin, benannt nach dem sogenannten Kanagawa-Phänomen: 1968 wurden in der japanischen Präfektur Kanagawa Stämme von V. parahaemolyticus untersucht, die sowohl aus der Umwelt (z. B. Meerwasser) als auch von klinischen Proben isoliert wurden. Diese stammten von Patienten, die an einer durch V. parahaemolyticus hervorgerufenen Gastroenteritis erkrankt waren. Wurden die isolierten Stämme auf Blutagar mit hohem Kochsalzgehalt kultiviert, so zeigten die klinischen Isolate eine Hämolyse (eine β-Hämolyse), während dies bei den anderen Stämmen nicht der Fall war. Als Ursache für die hämolytische Aktivität wurde später das TDH erkannt.[14] Ebenfalls wird ein weiteres Toxin gebildet, das thermolabile Hämolysin (TLH).
Bei einer Infektion wirkt das Kanagawa-Toxin jedoch auch als Enterotoxin auf den menschlichen Darm. Die damit verbundenen Symptome sind die einer Gastroenteritis mit akutem Erbrechen, Durchfall und Bauchschmerz.[6] Der Vorgang auf zellularer Ebene ist noch Gegenstand der Forschung, man nimmt eine ähnliche Wirkungsweise wie beim Choleratoxin an. Durch Veränderung des Ionenflusses erfolgt ein Verlust von Ionen aus den Darmepithelzellen und damit verbunden der Entzug von Wasser.[3]
Neben dem TDH setzt V. parahaemolyticus noch ein weiteres Exotoxin frei. Es wurde bei Stämmen gefunden, die das Kanagawa-Phänomen nicht verursachen, die aber ebenfalls Gastroenteritis hervorrufen. Dieses Toxin wird mit der Abkürzung TRH bezeichnet, nach dem englischen thermostable related hemolysin („thermostabiles, verwandtes Hämolysin“).[13][15] Es ist „verwandt“ mit TDH, da beide Proteine zu mehr als 60 % gleich aufgebaut sind. Die meisten pathogenen Stämme produzieren entweder TDH oder TRH oder beide Toxine. Im Rahmen einer Untersuchung von 1990 an 214 aus klinischen Proben isolierten Stämmen konnte bei 52 % das zugehörige tdh-Gen, bei 24 % das trh-Gen und bei 11 % beide Gene nachgewiesen werden. Die Untersuchung erfolgte durch DNA-Hybridisierung mit Hilfe von Gensonden.[13] In einer 9 Jahre später erfolgten Untersuchung mit Hilfe des empfindlicheren PCR-Verfahrens (Polymerase-Kettenreaktion) an 111 Isolaten wurden bei 16 % das tdh-Gen, bei 1 % das trh-Gen und bei 38 % beide Gene nachgewiesen. Allerdings umfassten die 111 Stämme auch Isolate aus der Umwelt und von Meeresfrüchten, die nicht unbedingt als pathogene Stämme anzusehen sind.[16]
Ein weiteres Exotoxin kommt bei allen Stämmen von V. parahaemolyticus vor und wird mit der Abkürzung TLH (oder nur TL) bezeichnet, nach dem englischen thermolabile hemolysin („thermolabiles Hämolysin“). Seine Wirkungsweise ist noch nicht geklärt.[3] Die PCR-Untersuchung der 111 Isolate bestätigte das zugehörige tlh-Gen bei allen untersuchten Stämmen, unabhängig von ihrer Herkunft.[16]
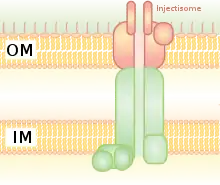
Ein wichtiger Faktor für die Pathogenität von V. parahaemolyticus liegt darin begründet, dass diese Exotoxine nicht einfach freigesetzt werden und dann mehr oder weniger zufällig in die Zellen des Wirts gelangen, sondern dass sie gezielt eingebracht werden. Grundlage hierfür ist das Typ-III-Sekretionssystem (engl. Type III secretion system; als TTSS oder T3SS abgekürzt). Es handelt sich um eine Proteinstruktur, deren Verankerungsstelle Ähnlichkeit mit der von Flagellen hat. Sie wird aber als Transportsystem zur Sekretion von bakteriellen Proteinen in die Wirtszellen verwendet. Das T3SS besteht aus 20–30 Proteinen, die Basis des Typ-III-Sekretionssystems erstreckt sich über die innere und äußere Membran der Bakterienzelle, dann folgt ein Injektionsapparat, ähnlich der Nadel einer Spritze. Er dient als Leitungsrohr zwischen der Bakterienzelle und der eukaryotischen Wirtszelle (siehe Abbildung).[3]
Vibrio parahaemolyticus verfügt über zwei verschiedene Typ-III-Sekretionssysteme, wobei das als T3SS1 bezeichnete System dem T3SS in Yersinia-Arten ähnlich ist. Die im Genom für diese Proteinstrukturen codierenden Bereiche werden als Pathogenitätsinseln (PAI) bezeichnet. Hier haben genetische Untersuchungen ergeben, dass jedes der beiden Bakterienchromosomen jeweils eine Pathogenitätsinsel aufweist und die PAI, die T3SS1 codiert, bereits in einer Urform einer Bakterien-Art vorgekommen ist, so dass Bakterien aus verschiedenen Gattungen (Vibrio und Yersinia) einen ähnlichen Mechanismus der Pathogenität aufweisen.[3] Auch andere Bakterien, die Gastroenteritis verursachen, besitzen als Virulenzfaktor ein Typ-III-Sekretionssystem. Es kommt bei Shigella- und Salmonella-Arten sowie bei den enteropathogenen Escherichia coli vor. Genetische Untersuchungen haben gezeigt, dass der näher verwandte Vibrio cholerae nicht über ein T3SS verfügt.[10]
Nachweise
Die in der Lebensmittelmikrobiologie eingesetzten Untersuchungsmethoden für Vibrio cholerae und andere Vibrio-Arten sind durch die ISO 21872[17] und in den USA durch das Bacteriological Analytical Manual (BAM) der Food and Drug Administration (FDA) – der US-amerikanischen Behörde für Lebensmittel- und Arzneimittelsicherheit – vorgeschrieben. Wie bei V. cholerae erfolgt nach der Anreicherung der Bakterien ein Ausstrich auf TCBS-Agar, hierbei erfolgt durch Vibrio parahaemolyticus jedoch keine Säurebildung, da er Saccharose nicht verwerten kann. Auf TCBS-Agar gewachsene Kolonien müssen zur Differenzierung der verschiedenen Vibrio-Arten noch weiter untersucht werden, z. B. durch biochemische Tests aus einer „Bunten Reihe“.[4] Ein darauf basierendes Schnellbestimmungssystem im Miniaturformat (Analytical Profile Index) zur Bestimmung von Bakterien aus den Familien Enterobacteriaceae und Vibrionaceae ist kommerziell verfügbar.[18] Alternativ ist die Bestätigungsanalytik mittels MALDI-TOF MS möglich.[19]
Falls notwendig, kann mit der isolierten V. parahaemolyticus-Kultur noch die Zuordnung zu den Serotypen erfolgen. Durch das gleichzeitige Auftreten von O-Antigenen und K-Antigenen ergibt sich theoretisch eine sehr große Anzahl an Serotypen, tatsächlich treten aber nur bestimmte Kombinationen (wie beispielsweise O3:K6) auf, so dass 76 Serovare bekannt sind. Die für die serologische Untersuchung benötigten Antikörper werden nur in Japan hergestellt, außerdem überdecken die K-Antigene die O-Antigene, so dass die Bestimmung der Serotypen nur an einem Referenzlabor durchgeführt wird.[4] Der prinzipielle Ablauf gleicht dem Kauffmann-White-Schema zur Klassifizierung der Salmonella Serotypen.[20]
Bei klinischen Proben wird eher auf das Vorhandensein der Virulenzfaktoren geprüft. So ist für den Nachweis des Kanagawa-Hämolysins (TDH) der Teil des Genoms, in dem die Toxinbildung codiert ist, Ziel der Untersuchung. Der Nachweis erfolgt mit Hilfe des Multiplex PCR Verfahrens, dabei ist auch die gleichzeitige Unterscheidung von anderen Enterotoxinen, die Gastroenteritis verursachen, möglich.[21] Auch für die Exotoxine TRH und TLH gibt es PCR-Verfahren, mit denen die zugehörigen trh– bzw. tlh-Gene identifiziert werden.[16]
Vorkommen und Ökologie
Vibrio parahaemolyticus ist ein aquatisches Bakterium, er kommt also im Wasser vor, hauptsächlich im Meerwasser, hier sind vor allem die Brack- und Küstengewässer von Bedeutung.[6] Dabei ist er beinahe weltweit verbreitet, in Küstengewässern von nahezu allen Temperaturbereichen. Im Gewässer von gemäßigten Klimazonen wird häufig ein jahreszeitlich bedingtes verstärktes Auftreten beobachtet – in den wärmeren Monaten. In den kälteren Monaten mit einer Wassertemperatur von 6–14 °C ist V. parahaemolyticus nicht im Wasser zu finden, sondern nur im Sediment, in dem er „überwintert“. Bei 14 °C wird er aus dem Bodenmaterial freigesetzt, angeheftet an Planktonbestandteile, und vermehrt sich dann zunehmend mit steigender Temperatur. Über das Plankton erfolgt eine Übertragung auf Fische und Krebstiere, von denen V. parahaemolyticus ebenfalls isoliert werden kann.[7]
Eine über mehrere Monate laufende Untersuchung in der Chesapeake Bay im Osten der USA zeigt, dass V. parahaemolyticus in den Wintermonaten im Gewässer nicht nachweisbar ist. Seine „Konzentration“ liegt unter der Nachweisgrenze, d. h., es sind zu wenige Zellen im Wasser vorhanden, um bei einer Keimzahlbestimmung ein Ergebnis zu erhalten. Im Temperaturbereich von 14–19 °C (ab Mitte April) ist er dann im natürlichen Gewässer nachweisbar. Deutliches Wachstum ist ab 20 °C (Anfang Juni) zu beobachten, er vermehrt sich dann zunehmend mit steigender Temperatur. Die höchste, im Rahmen der Untersuchung gemessene Wassertemperatur lag bei 31 °C (im Juli), hier wurden 340 Zellen von V. parahaemolyticus in 100 ml Wasser nachgewiesen.[7]
Im Sediment kann er sowohl in kälteren wie in wärmeren Monaten nachgewiesen werden, allerdings in den Wintermonaten in eher geringer Anzahl (weniger als 100 Zellen in 10 g Boden). Bei einer Wassertemperatur von mehr als 20 °C sind auch im Bodenmaterial mehr V. parahaemolyticus zu finden, etwa 300 Zellen/10 g Boden im Juni und bis zu 5700 Zellen/10 g Boden im Juli. Die höchsten Keimzahlen lassen sich auf und in Zooplankton nachweisen. Im Juli wurden zwischen 5,3 • 105 und 1,4 • 107 Zellen pro Gramm Plankton (Frischmasse) nachgewiesen. Die Oberfläche der Planktonbestandteile ist mit einer „Schleimschicht“ überzogen, in diesem Biofilm findet V. parahaemolyticus Stoffwechselprodukte anderer Organismen, die er selber als Nahrungsquelle nutzen kann.[7]
Durch das Wasser erfolgt auch die Übertragung auf den Menschen. Nicht oder unzureichend aufbereitetes Trinkwasser ist ein möglicher Grund für die Übertragung, genauso wie Lebensmittel, die mit kontaminiertem Wasser in Berührung gekommen sind,[22] wie Fische und Meeresfrüchte.[23] Besonders in Japan tritt V. parahaemolyticus als Verursacher von Gastroenteritis auf, was auf die Verzehrgewohnheiten zurückzuführen ist. Dort ist es üblich, Fische und Meeresfrüchte roh zu sich zu nehmen, beispielsweise als Sushi.[6] Allerdings werden Krankheitsfälle durch V. parahaemolyticus weltweit dokumentiert, in den USA vor allem im Zusammenhang mit dem Verzehr von rohen Austern.[24]
Systematik
Äußere Systematik
Neben Vibrio cholerae (Erreger der Cholera) sind die Arten V. parahaemolyticus, V. vulnificus und V. alginolyticus von medizinischer Bedeutung.[25]
Innere Systematik
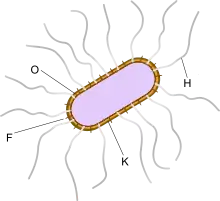
Die Spezies umfasst mehr als 200 Bakterienstämme.[26] Zu ihrer Unterscheidung erfolgt die Einteilung in Serotypen. In der Zellmorphologie von Vibrio parahaemolyticus ist eine Vielzahl von möglichen Antigenen begründet. Die Bezeichnung und Natur der Antigene erfolgt ähnlich wie bei dem Kauffmann-White-Schema: Die H-Antigene lassen sich auf die Flagellen (Geißeln) zurückführen, die O-Antigene (somatische Antigene) haben ihren Ursprung in den Lipopolysacchariden auf der Zelloberfläche und die K-Antigene in der Kapsel. F-Antigene (auf Fimbrien bzw. Pili zurückzuführen) sind bei V. parahaemolyticus nicht von Bedeutung. Alleine in seiner Kapsel wurden mehr als 70 unterschiedliche K-Antigene in verschiedenen Stämmen erkannt.[3]
Das H-Antigen ist bei allen Stämmen von V. parahaemolyticus gleich und daher für ihre Unterscheidung nicht von Bedeutung. Um die O-Antigene serologisch untersuchen zu können, müssen zuvor die K-Antigene durch eine Hitzebehandlung entfernt werden. Es existieren 12 unterschiedliche O-Serogruppen. Ein bestimmtes Antigen vom K-Typ kann in Kombination mit einem Antigen einer O-Gruppe vorliegen, durch diese Kombinationsmöglichkeiten kann es theoretisch zu sehr vielen verschiedenen Serotypen kommen, in der Praxis wurden bisher 76 Serotypen gefunden. Das Schema zur Unterscheidung der Serotypen von V. parahaemolyticus wurde 1963 von dem japanischen Mikrobiologen Riichi Sakazaki eingeführt.[20]
Pathogene Serotypen
Nicht alle Serotypen sind pathogen, bisher (Stand 2011) wurden 12 pathogene Serotypen beschrieben. In den 1990er Jahren wurden hauptsächlich drei neue Serotypen als Verursacher von Gastroenteritis identifiziert: O3:K6, O4:K68 und O1:K untypeable (auch mit UT abgekürzt, nicht zu typisieren). Seit 1996 ist O3:K6 bezogen auf klinische Proben der am häufigsten identifizierte Serotyp. Um diesen Serotyp handelt es sich auch bei dem Stamm Vibrio parahaemolyticus RIMD 2210633, dessen Genom bereits vollständig sequenziert wurde und an dem zahlreiche genetische Untersuchungen zum Verständnis der Pathogenität durchgeführt wurden. Erkrankungen durch diesen Serotyp wurden seit 1995 in Japan dokumentiert, weitere Fälle traten ein Jahr später in Indien auf. Mittlerweile treten Krankheitsfälle durch den Serotyp O3:K6 weltweit auf.[3]
Der in Indien gefundene Serotyp lässt sich nicht von dem 1995 in Japan isolierten Serotyp unterscheiden, während es schon genetische Unterschiede zu den zwischen 1982 und 1993 isolierten Stämmen des Serotyp O3:K6 gibt. Es wird davon ausgegangen, dass es sich um einen einzelnen Stamm (einen Klon) handelt, der in Indien, Japan und Südostasien seit etwa 1995 vorherrschend ist.[27] Dies wurde 2000 durch genetische Untersuchungen bestätigt.[28] Epidemiologische Daten, die seitdem erhoben werden, zeigen, dass dieser spezielle Stamm auch bei Krankheitsausbrüchen an ganz anderen Orten nachweisbar ist (siehe Abschnitt Verbreitung). Er wird daher als pandemisch bezeichnet, mit Hinweis auf das erstmalige Auftreten auch als „post-1995 pandemischer Vibrio parahaemolyticus O3:K6“ (post-1995 pandemic Vibrio parahaemolyticus O3:K6).[29] Um ihn besser mit anderen Stämmen vergleichen zu können, wurden folgende Merkmale definiert:[30]
| Stamm | Serotyp | tdh | trh | Urease | ORF8 | KP | toxRS/new |
|---|---|---|---|---|---|---|---|
| V. parahaemolyticus RIMD 2210633 | Serovar O3:K6 | + | – | – | + | + | + |
Alle Stämme des in Asien ab 1995 aufgetretenen Serotyps O3:K6 besitzen das tdh-, jedoch nicht das trh-Gen. Somit können sie das „thermostabile, direkte Hämolysin“ (TDH) produzieren, das verantwortlich für das Kanagawa-Phänomen ist, sie werden auch als Kanagawa-Phänomen-positiv (abgekürzt KP-positiv) bezeichnet. Sie produzieren nicht das TRH-Toxin und auch nicht das Enzym Urease.[27] Weiterhin wurde im Genom die toxRS-Sequenz analysiert, ein 1346 bp großer DNA-Abschnitt, der für phylogenetische Untersuchungen der Gattung Vibrio eingesetzt wird. Hier zeigt der neue Stamm eine Veränderung gegenüber Stämmen, die vor 1995 isoliert wurden, diese veränderte Sequenz wird daher als toxRS/new bezeichnet.[28] Weiterhin ergaben Untersuchungen von 2000, dass der neue Stamm ein Plasmid aufweist. Es wird als pO3K6 bezeichnet, ist 8782 bp groß und besteht aus zehn offenen Leserahmen (ORF). Das Plasmid entspricht dem Genom eines Bakteriophagen (f237), mit dem Unterschied, dass der Phage nur einzelsträngige DNA beinhaltet. ORF Nummer 8 zeichnet sich durch die Besonderheit aus, keine Homologie zu bekannten Proteinen aufzuweisen. Bei V. parahaemolyticus ist ORF8 nur in den nach 1995 isolierten Stämmen zu finden.[31]
Mehrere, an Ausbrüchen außerhalb von Asien beteiligte V. parahaemolyticus ließen sich als „post-1995 pandemischer Vibrio parahaemolyticus O3:K6“ identifizieren. Allerdings wurden nach 1997 weitere Stämme entdeckt, die genau diesen Kriterien entsprechen, aber zu anderen Serotypen (O4:K68 und O1:KUT) gehören.[28] Ein 2004 in Chile isolierter Stamm entsprach ebenfalls den Kriterien, gehörte allerdings zum Serotyp O4:K12.[30] Das führte zu der Bezeichnung „pandemischer klonaler Komplex“ (pandemic clonal complex, VpPCC), verbunden mit der Annahme, dass sich diese Serotypen direkt aus dem pandemischen Serotyp O3:K6 entwickelt haben, durch Mutation der für die O- und K-Antigene codierenden Gene.[28][32] Hingegen zeigen die 2004 in Spanien isolierten Stämme keine Zugehörigkeit zum VpPCC. Obwohl die dort gefundenen Serotypen O4:K11 und O4:KUT auch pathogen sind, unterscheiden sie sich genetisch deutlich vom neuen Serotyp O3:K6 und den anderen Vertretern.[33] Weitere pathogene Serotypen, die bei Krankheitsausbrüchen isoliert wurden, sind O1:K25, O1:K41, O1:K56, O3:K75, O4:K8 und O5:KUT.[32]
Entdeckung
Entdeckt wurde das Bakterium 1950 in Japan durch Fujino Tsunesaburō. In der Nähe der Stadt Osaka gab es einen Ausbruch einer „Lebensmittelvergiftung“ durch den Verzehr von Shirasu, einer kleinen halbgetrockneten Sardine. 272 Patienten waren von einer Gastroenteritis betroffen, 20 davon starben. Die daraufhin folgende Untersuchung des beteiligten Lebensmittels auf Toxine verlief erfolglos, so dass nun eine mikrobiologische Ursache in Betracht gezogen wurde. Fujino, Mediziner und Bakteriologe, untersuchte auf Shigellen und Salmonellen, die jedoch nicht nachweisbar waren. Daraufhin wurde das Filtrat einer Lebensmittelprobe in vivo an einem Meerschweinchen durch eine intraperitoneale Applikation getestet. Das Tier entwickelte eine Entzündung des Bauchfells (Peritonitis), bei deren weiterer Untersuchung immer noch keine Salmonellen oder Shigellen zu finden waren, aber andere gramnegative stäbchenförmige Bakterien. Es wurde versucht, diese durch Ausstrich auf Nährmedienplatten zu kultivieren – ohne Erfolg. Fujino wusste aus früheren Untersuchungen, dass manche Krankheitserreger nur in Versuchstieren zur Vermehrung gebracht werden konnten und injizierte Mäusen die unbekannten Bakterien. Nachdem die Tiere Krankheitssymptome entwickelt hatten, wurde ihr Aszites auf Blutagarplatten übertragen und bei 37 °C 10 Stunden lang inkubiert, woraufhin Kolonien erkennbar waren. Die Kolonien, die eine Hämolyse verursachten, wurden näher untersucht.
Das Bakterium war durch eine polare Geißel zur aktiven Bewegung fähig. Jene ähnelte der von Vibrio cholerae, aber ein Test mit den dafür bekannten Antiseren verlief negativ. Auch die Form des Bakteriums war anders als bei den Vibrionen, die Krümmung fehlte. Somit entschloss sich Fujino das Bakterium als Pasteurella parahaemolytica zu klassifizieren, da es viele Übereinstimmungen mit Pasteurella haemolytica zeigte. 1956 ereignete sich in Yokohama ein ähnlicher Vorfall, nur gelang es diesmal, mehr über die Eigenschaften des Erregers der Gastroenteritis in Erfahrung zu bringen. Er war halophil („salzliebend“) und ließ sich auf Nährmedien kultivieren, die einen höheren Kochsalzgehalt aufwiesen. Dies führte bei mikrobiologischen Untersuchungen zum Einsatz von Nährmedien mit Natriumchlorid. Mit diesen Nährböden ließen sich nun auch Bakterien kultivieren, die im Zusammenhang mit Gastroenteritis standen, egal ob aus klinischen Proben oder verdächtigen Lebensmitteln.
1962 wurde die Beschreibung der Gattung Vibrio ergänzt, so dass Fujino Tsunesaburō et al. die Probe der Shirasu-Lebensmittelvergiftung erneut untersuchten und nun eine Übereinstimmung mit dem Genus Vibrio feststellten. Ein Jahr später untersuchte der japanische Mikrobiologe Riichi Sakazaki die Bakterien, die 1956 in Yokohama isoliert wurden und verglich sie mit dem Isolat von Fujino. Er konnte bestätigen, dass es sich um die gleiche Art handelt und schlug den neuen Namen Vibrio parahaemolyticus vor, der 1980 in der Approved Lists im International Journal of Systematic and Evolutionary Microbiology (IJSEM) publiziert wurde (siehe Systematik der Bakterien).[1]
Etymologie
Der Gattungsname lässt sich auf vibro aus dem Lateinischen zurückführen, es bedeutet „sich schnell hin- und herbewegend“, „vibrierend“. Der Artname verweist auf die Fähigkeit des Bakteriums zur Hämolyse, darin findet sich der griechisch-lateinische Wortstamm haema für „Blut“ wieder, sowie lutikos aus dem Altgriechischen, was „etwas auflösen“ bedeutet. Die griechische Vorsilbe para heißt „neben“ und bezieht sich auf die Ähnlichkeit des ursprünglich als Pasteurella parahaemolytica bezeichneten Bakteriums zu Pasteurella haemolytica.[34]
Medizinische Bedeutung
Verbreitung
Infektionen mit Vibrio parahaemolyticus sind seit der Entdeckung des Krankheitserregers vor allem in Japan, Taiwan und Südostasien von Bedeutung.[29] Erkrankungen durch den Serotyp O3:K6 wurden dort 1995 registriert, bei Japanern, die von einer Reise aus Indonesien zurückgekehrt waren.[3] Weitere Fälle traten ein Jahr später in Indien auf, 50–80 % der in diesem Zusammenhang isolierten Stämme konnten als Serotyp O3:K6 identifiziert werden und lassen sich nicht von dem 1995 in Japan isolierten Serotyp unterscheiden (siehe Abschnitt Pathogene Serotypen). Weitere Nachweise auf anderen Kontinenten führten zu der Bezeichnung „post-1995 pandemischer Vibrio parahaemolyticus O3:K6“ (post-1995 pandemic Vibrio parahaemolyticus O3:K6).[29]
1998 gab es eine Epidemie mit 416 Patienten, hauptsächlich in Texas, neben 12 weiteren Bundesstaaten der USA. Auch hier wurde der neue Serotyp O3:K6 in Stuhlproben erkrankter Personen nachgewiesen.[35] 1998 ereignete sich noch ein weiterer Krankheitsausbruch, diesmal in Chile. Später stattfindende Untersuchungen an 20 klinischen Isolaten ergaben bei 19 Stämmen, dass es sich um den „post-1995 pandemischen Vibrio parahaemolyticus O3:K6“ handelt, ein Stamm wurde als Serotyp O1:K56 identifiziert.[30] In Spanien wurde 1999 ein Ausbruch mit 64 Fällen verzeichnet, daran war jedoch hauptsächlich der Serotyp O4:K11 beteiligt.[36] In Frankreich wurden im Zeitraum von 1997 bis 2004 mehrere Krankheitsausbrüche registriert. Von den aus diesem Zeitraum stammenden 13 klinischen Isolaten wurden fünf als neuer Serotyp O3:K6 identifiziert.[37]
2004 kam es zu einer Epidemie in Chile, es waren etwa 1500 Personen betroffen. Von 24 Rektalabstrichen von Patienten wurden V. parahaemolyticus Stämme isoliert und näher charakterisiert. 18 Stämme gehörten dem neuen Serotyp O3:K6 an, vier weitere gehörten ebenfalls dem Serotyp O3:K6 an, wichen aber in einem untersuchten Merkmal von dem „post-1995 pandemischen Vibrio parahaemolyticus O3:K6“ ab. Zwei Stämme konnten als Serotyp O4:K12 identifiziert werden.[30] Ein ebenfalls 2004 in Spanien stattfindender Ausbruch mit 80 Fällen ließ sich zum Teil auf den neuen Serotyp O3:K6 zurückführen. Außerdem wurde auch Serotyp O3:KUT nachgewiesen.[36] Im gleichen Jahr wurden 42 Fälle in Mosambik registriert, die Mehrheit der isolierten Stämme wurde ebenfalls als neuer Serotyp O3:K6 bzw. als zum VpPCC gehörenden Serotyp O4:K68 identifiziert. Damit haben die pandemischen V. parahaemolyticus Stämme auch den afrikanischen Kontinent erreicht.[32] Im Sommer 2013 gab es einen erneuten Ausbruch in den USA mit mehr als 100 Fällen.[38]
Eine Untersuchung von Wasserproben von Nordatlantik und Nordsee aus den Jahren 1958 bis 2011 legt einen Zusammenhang zwischen der Oberflächentemperatur des Meerwassers, der Vibrio-Konzentration und der Erkrankungsfälle nahe.[39]
Infektionsquellen

Der bevorzugte Infektionsweg von Vibrio parahaemolyticus ist fäkal-oral, was oftmals durch den Verzehr von rohem oder ungenügend gekochten Fisch (oft bei Makrelen, Thunfischen, Sardinen, Aalen und Gerichten wie z. B. Sushi) und Meeresfrüchten (wie Krabben, Garnelen, Hummer, Tintenfische, Muscheln – insbesondere Austern) zustande kommt.[40][41]
Es kommt vor, dass sich Personen mit offenen Wunden der Haut durch Schwimmen im warmen Meerwasser Infektionen mit V. parahaemolyticus zuziehen.[42]
Infektionskrankheiten
Das Resultat einer Infektion mit pathogenen Vibrio parahaemolyticus-Stämmen ist meist eine akute Gastroenteritis. Möglich sind allerdings auch oberflächliche Wundinfektionen oder Sepsis („Blutvergiftung“), diese sind aber selten.[3]
In Mitteleuropa kommt eine Infektion mit V. parahaemolyticus eher selten vor, Epidemien treten bevorzugt an Küstenregionen während der Sommer- und Herbstzeit auf, wenn die höheren Wassertemperaturen das Bakterienwachstum begünstigen. Nach einer Inkubationszeit von 8 bis 24 Stunden erfolgt eine wässrige Diarrhoe in Kombination mit Bauchschmerz, Übelkeit, Erbrechen und gelegentlichem Fieber. Die Symptome verschwinden für gewöhnlich nach 60–72 Stunden, können aber in Extremfällen, wie etwa bei immunschwachen Patienten, bis zu 10 Tagen bestehen bleiben.[40][41] Auch Todesfälle kommen vor.[6]
Therapie
Da die Infektion üblicherweise selbstlimitierend ist, wird von einer medikamentösen Therapie oft abgesehen. In schweren Fällen wird Elektrolyt- und Flüssigkeitsersatz über Infusionen gewährleistet. Als Antibiotikum der Wahl im Notfall eignet sich Doxycyclin oder Ciprofloxacin.[40]
Lebensmittelmikrobiologische Bedeutung
Die vom Robert Koch-Institut herausgegebene Gesundheitsberichterstattung des Bundes erwähnt zwar Vibrio parahaemolyticus als Auslöser für lebensmittelbedingte Krankheiten. Gleichzeitig wird aber betont, dass Infektionen durch V. cholerae und V. parahaemolyticus in Deutschland sehr selten sind und meistens auf Auslandsreisen zurückzuführen sind. Fisch und andere Meerestiere kommen als Infektionsquellen in Frage, dies ist jedoch allenfalls bei importierten Lebensmitteln von Bedeutung.[43] Da Fische und Meeresfrüchte mögliche Infektionsquellen sind, empfiehlt die Deutsche Gesellschaft für Hygiene und Mikrobiologie (DGHM e. V.) bei Seefisch aus wärmeren Regionen die Untersuchung auf Vibrionen. Falls pathogene Arten nachgewiesen werden, sind weitere Untersuchungen zum Toxinbildungsvermögen notwendig,[44] da der Nachweis von V. parahaemolyticus an sich noch kein Risiko darstellt, weil in der Umwelt apathogene Stämme vorherrschen.[41]
In den USA ist V. parahaemolyticus die Hauptursache für durch Bakterien verursachte Diarrhoe nach dem Verzehr von Meeresfrüchten. 1997 und 1998 gab es mehrere Ausbrüche, die sich auf den Verzehr von rohen Austern zurückführen ließen.[24][35][45] Gleiches gilt für den Krankheitsausbruch in Spanien von 1999[33] und in den USA von 2013, wobei dort auch roh verzehrte Muscheln beteiligt waren.[38] Die Tiere filtern ihre Nahrung aus dem Wasser heraus, dabei reichern sich die im Wasser vorhandenen Bakterien in den Austern oder Muscheln an. In den warmen Sommermonaten sind bis zu 100 % der Tiere mit V. parahaemolyticus kontaminiert.[3] Neben dem Verzehr roher Austern gibt es aber auch im Zusammenhang mit Krabben, Garnelen und Hummer sporadisch Krankheitsausbrüche. Da diese Meeresfrüchte in den USA üblicherweise gekocht gegessen werden, muss eine falsche Hygiene-Praxis die Ursache sein.[4] Ähnliches gilt für den Krankheitsausbruch von 2004 in Spanien, bei dem gekochte Krabben als Infektionsquelle ausfindig gemacht wurden.[36] Unterbrechung der Kühlkette, unzureichendes Erhitzen oder nachträgliche Kontamination kommen hier in Frage.[4]
Wenn die Gesamtheit aller verzehrten Nahrungsmittel erfasst wird, nimmt in Deutschland – wie insgesamt in der Europäischen Union – die Campylobacter-Enteritis den Spitzenplatz unter den registrierten, lebensmittelbedingten Erkrankungen ein, gefolgt von der Salmonellose.[46] In den USA nimmt die durch Noroviren verursachte Gastroenteritis den Spitzenplatz ein, gefolgt von der Salmonellose.[47] Davon unterscheidet sich die Lage in Japan beträchtlich. Infektionen durch V. parahaemolyticus sind dort die Hauptursache für lebensmittelbedingte Erkrankungen, 20–30 % der Fälle sind auf sie zurückzuführen.[3]
Obwohl im Alltagssprachgebrauch oft der Begriff „Lebensmittelvergiftung“ verwendet wird, trifft diese Bezeichnung nicht für V. parahaemolyticus zu. Bei einer Nahrungsmittelvergiftung (Intoxikation) enthalten die Lebensmittel bereits vor dem Verzehr die von den Mikroorganismen gebildeten Toxine und es ist nicht erforderlich, dass sich die Mikroorganismen im menschlichen Körper vermehren. Die durch V. parahaemolyticus verursachte Gastroenteritis ist eine Lebensmittelinfektion, der Mensch als Wirtsorganismus wird durch die pathogenen, im Nahrungsmittel enthaltenen Mikroorganismen infiziert.[48] Daher sollte man zur Prophylaxe auf rohe oder unzureichend gegarte der als Infektionsquellen bekannten Lebensmittel verzichten. Wenn sie hingegen ausreichend erhitzt werden, so werden die darin enthaltenen V. parahaemolyticus abgetötet.[6][42]
Die CDC (Centers for Disease Control and Prevention, die Gesundheitsbehörde in den USA) schätzen, dass es dort etwa 4500 Fälle pro Jahr gibt. Um mehr gesicherte Daten zu erhalten, ist 2007 eine Meldepflicht für Infektionen mit V. parahaemolyticus und anderen Vibrio-Arten eingeführt worden.[42] Für die Europäische Union wurde 2001 im Auftrag der Europäischen Kommission eine Stellungnahme des zuständigen wissenschaftlichen Komitees herausgegeben. Danach ist für die EU das Risiko für Infektionen durch V. parahaemolyticus als eher gering einzuschätzen, gleichwohl wird eine ungenügende Datenlage genannt. Die Ausweitung des internationalen Handels mit Fischen und Meeresfrüchten und eine Veränderung der Verzehrsgewohnheiten kann jedoch einen Anstieg der Infektionen in der EU verursachen.[41] Basierend auf dieser Stellungnahme wird der Krankheitserreger nicht vom Netz für die epidemiologische Überwachung und die Kontrolle übertragbarer Krankheiten in der EU erfasst und fällt damit nicht unter eine Meldepflicht.[36] Dies wird u. a. von französischen Wissenschaftlern des Institut Pasteur bemängelt.[37] Auch eine mikrobiologische Überwachung der Aquakulturen, beispielsweise von Austern, auf V. parahaemolyticus ist nicht veranlasst worden.[49] Allerdings wird an einem Impfstoff für die Fischzucht geforscht, der oral verabreicht werden kann.[50] Neben den gesundheitlichen Auswirkungen ist ein Krankheitsausbruch auch mit wirtschaftlichen Folgen verbunden, da die Zucht- oder Fanggebiete von Austern und anderen Meeresfrüchten geschlossen werden, wie dies beispielsweise in Chile und den USA erfolgte.[30][38]
Quellen
Literatur
- Christopher A. Broberg, Thomas J. Calder, Kim Orth: Vibrio parahaemolyticus cell biology and pathogenicity determinants. In: Microbes and infection / Institut Pasteur. Band 13, Nr. 12–13, November 2011, S. 992–1001, doi:10.1016/j.micinf.2011.06.013, PMC 3384537 (freier Volltext).
- European Commission (Hrsg.): Opinion of the Scientific Committee on Veterinary Measures Relating to Public Health on Vibrio vulnificus and Vibrio parahaemolyticus (in raw and undercooked seafood). 20. September 2001, S. 20–36 (PDF, 252 kB [abgerufen am 16. Januar 2014]).
- Herbert Hof, Rüdiger Dörries: Duale Reihe: Medizinische Mikrobiologie. 3. Auflage. Thieme Verlag, Stuttgart 2005, ISBN 978-3-13-125313-2, S. 400–404.
Einzelnachweise
- S. Shinoda: Sixty years from the discovery of Vibrio parahaemolyticus and some recollections. In: Biocontrol science. Band 16, Nummer 4, Dezember 2011, S. 129–137, ISSN 1342-4815. PMID 22190435. (Review).
- Hans G. Schlegel, Christiane Zaborosch: Allgemeine Mikrobiologie. 7. Auflage. Thieme Verlag, Stuttgart/New York 1992, ISBN 3-13-444607-3, S. 117.
- C. A. Broberg, T. J. Calder, K. Orth: Vibrio parahaemolyticus cell biology and pathogenicity determinants. In: Microbes and infection / Institut Pasteur. Band 13, Nummer 12–13, November 2011, S. 992–1001, ISSN 1769-714X. doi:10.1016/j.micinf.2011.06.013. PMID 21782964. PMC 3384537 (freier Volltext). (Review).
- Charles A. Kaysner, Angelo DePaola, Jr.: Bacteriological Analytical Manual, Chapter 9: Vibrio. In: Website der Food and Drug Administration (FDA). Mai 2004, abgerufen am 29. Dezember 2013.
- Michael T. Madigan, John M. Martinko, Jack Parker: Brock Mikrobiologie. Deutsche Übersetzung herausgegeben von Werner Goebel, 1. Auflage. Spektrum Akademischer Verlag GmbH, Heidelberg/Berlin 2000, ISBN 978-3-8274-0566-1, S. 536–537.
- Herbert Hof, Rüdiger Dörries: Duale Reihe: Medizinische Mikrobiologie. 3. Auflage. Thieme Verlag, Stuttgart 2005, ISBN 978-3-13-125313-2, S. 400–404.
- T. Kaneko, R. R. Colwell: Ecology of Vibrio parahaemolyticus in Chesapeake Bay. In: Journal of bacteriology. Band 113, Nummer 1, Januar 1973, S. 24–32, ISSN 0021-9193. PMID 4567138. PMC 251597 (freier Volltext).
- Vibrio parahaemolyticus RIMD 2210633 (Serovar O3:K6). In: Webseite Genomes Online Database (GOLD). Abgerufen am 12. August 2013.
- Katalog der Mikroorganismen. In: Webseite des Leibniz Institut DSMZ – Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH. Abgerufen am 12. August 2013.
- K. Makino, K. Oshima u. a.: Genome sequence of Vibrio parahaemolyticus: a pathogenic mechanism distinct from that of V cholerae. In: Lancet. Band 361, Nummer 9359, März 2003, S. 743–749, ISSN 0140-6736. doi:10.1016/S0140-6736(03)12659-1. PMID 12620739.
- Vibrio parahaemolyticus. In: Webseite Genome des National Center for Biotechnology Information (NCBI). Abgerufen am 4. Januar 2014.
- TRBA 466: Einstufung von Prokaryonten (Bacteria und Archaea) in Risikogruppen. In: Webseite der Bundesanstalt für Arbeitsschutz und Arbeitsmedizin (BAuA). 4. Mai 2012, S. 245, abgerufen am 9. März 2013.
- H. Shirai, H. Ito u. a.: Molecular epidemiologic evidence for association of thermostable direct hemolysin (TDH) and TDH-related hemolysin of Vibrio parahaemolyticus with gastroenteritis. In: Infection and immunity. Band 58, Nummer 11, November 1990, S. 3568–3573, ISSN 0019-9567. PMID 2228229. PMC 313699 (freier Volltext).
- S. W. Joseph, R. R. Colwell, J. B. Kaper: Vibrio parahaemolyticus and related halophilic Vibrios. In: Critical reviews in microbiology. Band 10, Nummer 1, 1982, S. 77–124, ISSN 1040-841X. doi:10.3109/10408418209113506. PMID 6756788. (Review).
- T. Honda, Y. X. Ni, T. Miwatani: Purification and characterization of a hemolysin produced by a clinical isolate of Kanagawa phenomenon-negative Vibrio parahaemolyticus and related to the thermostable direct hemolysin. In: Infection and immunity. Band 56, Nummer 4, April 1988, S. 961–965, ISSN 0019-9567. PMID 3126151. PMC 259398 (freier Volltext).
- A. K. Bej, D. P. Patterson u. a.: Detection of total and hemolysin-producing Vibrio parahaemolyticus in shellfish using multiplex PCR amplification of tl, tdh and trh. In: Journal of microbiological methods. Band 36, Nummer 3, Juni 1999, S. 215–225, ISSN 0167-7012. PMID 10379807.
- Rapid testing solutions for the detection of Vibrio cholerae auf der Webseite der Merck KGaA. (Nicht mehr online verfügbar.) Ehemals im Original; abgerufen am 14. August 2013. (Seite nicht mehr abrufbar, Suche in Webarchiven) Info: Der Link wurde automatisch als defekt markiert. Bitte prüfe den Link gemäß Anleitung und entferne dann diesen Hinweis.
- ID 32 biochemische Identifizierung (rapid ID 32 E); Vibrionaceae, Enterobacteriaceae. (Nicht mehr online verfügbar.) In: Webseite der bioMérieux Deutschland GmbH. Archiviert vom Original am 5. Januar 2014; abgerufen am 12. August 2013.
- Tracy H. Hazen, Robert J. Martinez, Yanfeng Chen, Patricia C. Lafon, Nancy M. Garrett: Rapid Identification of Vibrio parahaemolyticus by Whole-Cell Matrix-Assisted Laser Desorption Ionization-Time of Flight Mass Spectrometry. In: Applied and Environmental Microbiology. Band 75, Nr. 21, 1. November 2009, ISSN 0099-2240, S. 6745–6756, doi:10.1128/aem.01171-09, PMID 19749061.
- R. Sakazaki, S. Iwanami, H. Fukumi: Studies on the enteropathogenic, facultatively halophilic bacteria, Vibrio parahaemolyticus. I. Morphological, cultural and biochemical properties and its taxonomic position. In: Japanese journal of medical science & biology. Band 16, August 1963, S. 161–188, ISSN 0021-5112. PMID 14071901.
- L. J. Coupland, I. McElarney u. a.: Simultaneous detection of viral and bacterial enteric pathogens using the Seeplex® Diarrhea ACE detection system. In: Epidemiology and infection. [elektronische Veröffentlichung vor dem Druck] Dezember 2012, ISSN 1469-4409. doi:10.1017/S0950268812002622. PMID 23211606.
- Michael T. Madigan, John M. Martinko, Jack Parker: Brock Mikrobiologie. Deutsche Übersetzung herausgegeben von Werner Goebel, 1. Auflage. Spektrum Akademischer Verlag GmbH, Heidelberg/Berlin 2000, ISBN 978-3-8274-0566-1, S. 1095–1099.
- Renata Albuquerque Costa, Rayza Lima Araújo, Regine Helena Silva Fernandes Vieira: Enzymatic activity of vibrios isolated from the hemolymph of cultured Litopenaeus vannamei shrimp. In: Journal für Verbraucherschutz und Lebensmittelsicherheit. Band 8, Nummer 4, Dezember 2013, S. 307–311, ISSN 1661-5751. doi:10.1007/s00003-013-0841-0.
- Autor unbekannt: Outbreak of Vibrio parahaemolyticus infections associated with eating raw oysters–Pacific Northwest, 1997. In: MMWR. Morbidity and mortality weekly report. Herausgeber: Centers for Disease Control and Prevention (CDC). Band 47, Nummer 22, Juni 1998, S. 457–462, ISSN 0149-2195. PMID 9639367.
- Steckbriefe seltener und importierter Infektionskrankheiten. (Nicht mehr online verfügbar.) In: Website des Robert Koch-Instituts (RKI). S. 61, archiviert vom Original am 30. Dezember 2013; abgerufen am 4. März 2013.
- Taxonomy Browser Vibrio parahaemolyticus. In: Webseite des National Center for Biotechnology Information (NCBI). Abgerufen am 4. Januar 2014.
- J. Okuda, M. Ishibashi u. a.: Emergence of a unique O3:K6 clone of Vibrio parahaemolyticus in Calcutta, India, and isolation of strains from the same clonal group from Southeast Asian travelers arriving in Japan. In: Journal of clinical microbiology. Band 35, Nummer 12, Dezember 1997, S. 3150–3155, ISSN 0095-1137. PMID 9399511. PMC 230139 (freier Volltext).
- C. Matsumoto, J. Okuda u. a.: Pandemic spread of an O3:K6 clone of Vibrio parahaemolyticus and emergence of related strains evidenced by arbitrarily primed PCR and toxRS sequence analyses. In: Journal of clinical microbiology. Band 38, Nummer 2, Februar 2000, S. 578–585, ISSN 0095-1137. PMID 10655349. PMC 86152 (freier Volltext).
- C. C. Hurley, A. Quirke, F. J. Reen, E. F. Boyd: Four genomic islands that mark post-1995 pandemic Vibrio parahaemolyticus isolates. In: BMC genomics. Band 7, 2006, S. 104, ISSN 1471-2164. doi:10.1186/1471-2164-7-104. PMID 16672049. PMC 1464126 (freier Volltext).
- N. González-Escalona, V. Cachicas u. a.: Vibrio parahaemolyticus diarrhea, Chile, 1998 and 2004. In: Emerging infectious diseases. Band 11, Nummer 1, Januar 2005, S. 129–131, ISSN 1080-6040. doi:10.3201/eid1101.040762. PMID 15705337. PMC 3294363 (freier Volltext).
- H. Nasu, T. Iida u. a.: A filamentous phage associated with recent pandemic Vibrio parahaemolyticus O3:K6 strains. In: Journal of clinical microbiology. Band 38, Nummer 6, Juni 2000, S. 2156–2161, ISSN 0095-1137. PMID 10834969. PMC 86752 (freier Volltext).
- M. Ansaruzzaman, M. Lucas u. a.: Pandemic serovars (O3:K6 and O4:K68) of Vibrio parahaemolyticus associated with diarrhea in Mozambique: spread of the pandemic into the African continent. In: Journal of clinical microbiology. Band 43, Nummer 6, Juni 2005, S. 2559–2562, ISSN 0095-1137. doi:10.1128/JCM.43.6.2559-2562.2005. PMID 15956363. PMC 1151933 (freier Volltext).
- J. Martinez-Urtaza, A. Lozano-Leon u. a.: Characterization of pathogenic Vibrio parahaemolyticus isolates from clinical sources in Spain and comparison with Asian and North American pandemic isolates. In: Journal of clinical microbiology. Band 42, Nummer 10, Oktober 2004, S. 4672–4678, ISSN 0095-1137. doi:10.1128/JCM.42.10.4672-4678.2004. PMID 15472326. PMC 522348 (freier Volltext).
- Jean Euzéby, Aidan C. Parte: Genus Vibrio. (Nicht mehr online verfügbar.) In: List of Prokaryotic names with Standing in Nomenclature (LPSN). Archiviert vom Original am 4. November 2013; abgerufen am 12. August 2013.
- N. A. Daniels, B. Ray u. a.: Emergence of a new Vibrio parahaemolyticus serotype in raw oysters: A prevention quandary. In: JAMA : the journal of the American Medical Association. Band 284, Nummer 12, September 2000, S. 1541–1545, ISSN 0098-7484. PMID 11000648.
- J. Martinez-Urtaza, L. Simental u. a.: Pandemic Vibrio parahaemolyticus O3:K6, Europe. In: Emerging Infectious Diseases. Band 11, Nummer 8, August 2005, S. 1319–1320, ISSN 1080-6040. doi:10.3201/eid1108.050322.
- M.-L. Quilici, A. Robert-Pillot, J. Picart, J.-M. Fournier: Pandemic Vibrio parahaemolyticus O3:K6 spread, France. In: Emerging Infectious Diseases. Band 11, Nummer 7, Juli 2005, S. 1148–1149, ISSN 1080-6040. doi:10.3201/eid1107.041008.
- Increase in Vibrio parahaemolyticus illnesses associated with consumption of shellfish from several Atlantic coast harvest areas, United States, 2013. In: Website der CDC (Centers for Disease Control and Prevention). 21. Oktober 2013, abgerufen am 14. Januar 2014.
- Hanno Charisius: Atlantik-Mikroben, Süddeutsche Zeitung vom 10. August 2016, S. 16.
- Helmut Tschäpe, Rolf Reissbrodt, Rita Prager: Aeromonas spp. und Vibrio spp. In: Birgid Neumeister, Heinrich K. Geiss, Rüdiger W. Braun, Peter Kimmig (Hrsg.): Mikrobiologische Diagnostik: Bakteriologie – Mykologie – Virologie – Parasitologie. 2. Auflage. Thieme Verlag, Stuttgart 2009, ISBN 978-3-13-743602-7, S. 457–460.
- European Commission (Hrsg.): Opinion of the Scientific Committee on Veterinary Measures Relating to Public Health on Vibrio vulnificus and Vibrio parahaemolyticus (in raw and undercooked seafood). 20. September 2001, S. 20–36 (PDF, 252 kB [abgerufen am 16. Januar 2014]).
- Vibrio parahaemolyticus (in Englisch). In: Website der CDC (Centers for Disease Control and Prevention). 21. Oktober 2013, abgerufen am 29. Dezember 2013.
- Lebensmittelbedingte Erkrankungen (Heft 6) – Gesundheitsberichterstattung des Bundes. (Nicht mehr online verfügbar.) In: Website des Robert Koch-Instituts (RKI). 1. April 2002, archiviert vom Original am 15. Juni 2013; abgerufen am 11. August 2013.
- Fachgruppe Lebensmittelmikrobiologie und -hygiene, Arbeitsgruppe Mikrobiologische Richt- und Warnwerte der DGHM e. V.: Mikrobiologische Richt- und Warnwerte zur Beurteilung von Lebensmitteln (Stand Mai 2012), Kapitel 21 Richt- und Warnwerte für Seefische. (Nicht mehr online verfügbar.) In: Website der Deutschen Gesellschaft für Hygiene und Mikrobiologie (DGHM). Archiviert vom Original am 11. Februar 2013; abgerufen am 24. März 2013.
- Autor unbekannt: Outbreak of Vibrio parahaemolyticus infection associated with eating raw oysters and clams harvested from Long Island Sound–Connecticut, New Jersey, and New York, 1998. In: MMWR. Morbidity and mortality weekly report. Herausgeber: Centers for Disease Control and Prevention (CDC). Band 48, Nummer 3, Januar 1999, S. 48–51, ISSN 0149-2195. PMID 9935142.
- ECDC: Epidemiologischer Jahresreport 2012 mit Daten für 2010 und 2011 (in Englisch). (PDF; 10,0 MB) In: Webseite des Europäischen Zentrums für die Prävention und die Kontrolle von Krankheiten (ECDC). S. 4, 65–67, 102–106, abgerufen am 20. November 2013.
- CDC Estimates of Foodborne Illness in the United States, 2011. In: Website der CDC (Centers for Disease Control and Prevention). 21. Juni 2013, abgerufen am 29. Dezember 2013.
- Michael T. Madigan, John M. Martinko, Jack Parker: Brock Mikrobiologie. Deutsche Übersetzung herausgegeben von Werner Goebel, 1. Auflage. Spektrum Akademischer Verlag GmbH, Heidelberg/Berlin 2000, ISBN 978-3-8274-0566-1, S. 1104–1105.
- Richtlinie 2006/88/EG des Rates vom 24. Oktober 2006 mit Gesundheits- und Hygienevorschriften für Tiere in Aquakultur und Aquakulturerzeugnisse und zur Verhütung und Bekämpfung bestimmter Wassertierkrankheiten, abgerufen am 18. Januar 2014
- L. Li, S. L. Lin, L. Deng, Z. G. Liu: Potential use of chitosan nanoparticles for oral delivery of DNA vaccine in black seabream Acanthopagrus schlegelii Bleeker to protect from Vibrio parahaemolyticus. In: Journal of fish diseases. Band 36, Nummer 12, Dezember 2013, S. 987–995, ISSN 1365-2761. doi:10.1111/jfd.12032. PMID 24093149.
Weblinks
- Forschungsprojekt VibrioNet (englisch)
- Catharina Lüdeke: Vibrio parahämolyticus in Meeresfrüchten: Was bedingt seine Virulenz?, 16. Mai 2013, Food & Health Academy (SoSe 13), Uni Hamburg Lecture2Go
- Bundesinstitut für Risikobewertung (BfR): Fragen und Antworten zu Vibrionen