Exotoxin
Exotoxine (auch Ektotoxine; von altgriechisch ἔξω éxo bzw. ἐκτός ektós, beide „außen, außerhalb“, und -toxin) sind von Bakterien abgesonderte Giftstoffe, gegen die der Wirtskörper Gegengifte (Antitoxine) bilden kann. Hier „verlässt“ das Gift also das Bakterium (im Gegensatz zum Endotoxin).[1][2]
Exotoxine sind meist Proteine und daher nicht thermostabil, das heißt nicht hitzebeständig.
Sie können in drei Klassen eingeteilt werden:
- membranschädigende Toxine
- AB-Toxine (haben vielerlei Funktion)
- Superantigentoxine
Membranschädigende Exotoxine
Manche haben katalytische Eigenschaften, wie zum Beispiel das Alphatoxin von Clostridium perfringens, andere dagegen nicht, zum Beispiel das Alphatoxin von Staphylococcus aureus. Das Alphatoxin von Clostridium perfringens ist eine Lipase, die die Zellmembran destabilisiert, indem es die dortigen Phospholipide zerschneidet. Das Alphatoxin von Staphylococcus aureus hingegen bildet ein Polymer auf der Oberfläche der Zielzelle, welches die Membran der Zelle perforiert und somit als porenbildendes Toxin wirkt. Die Membran von Makrophagen und Leukozyten wird durch das von Staphylokokken, insbesondere Staphylococcus aureus, gebildete Leukozidin, einem Exotoxin, geschädigt.[3]
AB-Toxine
Sie bestehen im einfachsten Fall aus einem A-Teil, welcher die katalytische Aktivität hat, und einem B-Teil, welcher die spezifische Bindung an die Zielzelle vermittelt. Es gibt jedoch zahlreiche AB-Toxine, die mehrere B-Untereinheiten besitzen (zum Beispiel Pertussistoxin, Choleratoxin, Diphtherietoxin).
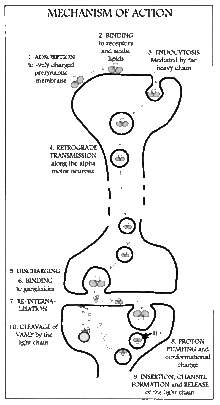
Die Aufnahme der Toxine in die Zelle geschieht durch rezeptorvermittelte Endocytose (englisch receptor mediated endocytosis, RME). Dabei bindet der B-Teil an einen spezifischen Rezeptor auf der Zielzelle, worauf diese das Toxin durch Endocytose aufnimmt. Das Toxin befindet sich dann in einem Endosom, welches üblicherweise während seiner Reifung angesäuert wird. Diese Ansäuerung löst dann die Ausschleusung des A-Teiles aus dem Endosom ins Cytoplasma aus. Damit kann der A-Teil seine Wirkung entfalten.
Tetanus und Botulismus
Ausgelöst werden diese beiden Krankheiten durch Neurotoxine, die von Clostridium tetani beziehungsweise Clostridium botulinum erzeugt werden. Die Neurotoxine gehören zu den AB-Toxinen und entfalten ihre Wirkung an Neuronen. Diese Toxine gehören zu den wirksamsten bekannten Toxinen. Die tödliche Dosis liegt schon bei wenigen Nanogramm pro Kilogramm.
Beide Toxine sind Endopeptidasen. Sie zerstören Proteine, die für die Verschmelzung von synaptischen Vesikeln mit der Membran der Neuronen wichtig sind. Dadurch können die Neurotransmitter nicht mehr in die Intersynapse abgegeben werden. Im Fall von Botulismus wird die Ausschüttung von Acetylcholin (bei Tetanus Glycin) verhindert, was zu Erschlaffung der Muskelfasern führt (bei Tetanus dauerhafte Muskelkontraktion).
AB-Toxine, die mit G-Proteinen wechselwirken
Eine andere Klasse von AB-Toxinen wirkt auf G-Proteine. Auch diese Toxine sind hochwirksam. Nachdem das Toxin über RME aufgenommen wurde, katalysiert der A-Teil die Übertragung eines ADP-Ribosylrestes von NAD+ auf das G-Protein, wodurch letzteres modifiziert wird und die GTPase hemmt. Der ADP-Ribosylrest wird an ganz bestimmte Aminosäuren auf dem G-Protein gehängt, etwa an einen Arginin-Rest des stimulierenden Gα-Proteins im Falle von Choleratoxin, oder an einen Cystein-Rest des inhibitorischen Gα-Proteins im Falle von Pertussistoxin.
Die Inaktivierung von G-Proteinen kann gravierende Folgen für die Zelle haben, je nachdem welches G-Protein ADP-ribosyliert wird. Beispiele sind das Choleratoxin und das Pertussistoxin, die den cAMP-Spiegel der Zelle erhöhen. Dies geschieht im Fall von Cholera an den Darmzellen, was eine schwere Durchfallerkrankung zur Folge hat. Das Pertussistoxin (aus Bordetella pertussis) wirkt auf die Epithelzellen der Lunge und wahrscheinlich auf Neuronen, was dann zu den für Keuchhusten typischen Symptomen führt. Zusätzlich wirkt das Toxin auch auf die Makrophagen und behindert dadurch die Immunantwort.
Diphtherie
Im Falle des Diphtherietoxins (aus Corynebacterium diphtheriae) wird der Elongationsfaktor 2 (EF2) durch Übertragung eines ADP-Ribosylrestes auf Diphtamid (ein modifizierter Histidin-Rest) inaktiviert. EF2 ist aber für die Proteinsynthese und damit für das Leben der Zelle unbedingt nötig.
Superantigentoxine (Superantigene)
Diese Art von Exotoxin wirkt durch eine Aktivierung des Immunsystems.[4] Ausschlaggebend für die Symptome ist hier die Reaktion des Immunsystems auf das Toxin – nicht die Wirkung des Toxins selbst.
Superantigene vermitteln direkten Kontakt von antigenpräsentierenden Zellen (APC) mit T-Zellen. Im Normalfall müssen Antigene durch APCs aufgenommen und prozessiert werden, bevor sie dann einigen wenigen T-Zellen über MHC–TCR-Kontakt (T-Zell-Rezeptor) gezeigt werden. Da Superantigene jedoch selbständig Kontakt zwischen TCR und MHC herstellen, bedeutet dies eine Hyperstimulierung der T-Zellen. Superantigene binden an den variablen Teil der β-Kette. Somit gibt es keine Spezifität mehr für Epitope. Dabei werden dann 20 bis 25 % (im Normalfall 0,01 %) aller T-Zellen im Körper stimuliert, die eine starke Entzündungsreaktion im ganzen Körper auslösen. Symptome wie hohes Fieber, Blutdruckabfall und Hautausschlag können auftreten. Schlimmstenfalls kommt es zum Toxischen Schock mit schweren Schädigungen der Organsysteme bis hin zum Multiorganversagen. Ursache sind meist die Toxine von Staphylococcus aureus, seltener Streptokokken.
Einzelnachweise
- S. Spanò, J. E. Galán: A novel pathway for exotoxin delivery by an intracellular pathogen. In: Current Opinion in Microbiology. Band 11, Nummer 1, Februar 2008, S. 15–20, doi:10.1016/j.mib.2007.12.002. PMID 18243772. PMC 2323430 (freier Volltext).
- M. R. Popoff: Bacterial exotoxins. In: Contributions to microbiology. Band 12, 2005, S. 28–54, doi:10.1159/000081688. PMID 15496775.
- Pschyrembel Klinisches Wörterbuch. De Gruyter.
- M. Kotb: Bacterial pyrogenic exotoxins as superantigens. In: Clinical microbiology reviews. Band 8, Nummer 3, Juli 1995, S. 411–426, PMID 7553574. PMC 174633 (freier Volltext).
Weblinks
- SIB: Viral exotoxin, auf ViralZone