Pyruvatdehydrogenase E1
Pyruvatdehydrogenase E1 (PDHE1) ist der Name für die Untereinheit E1 des Pyruvatdehydrogenase-Enzymkomplexes. PDHE1 katalysiert die Übertragung eines Acetylrests auf das an die Untereinheit E2 gebundene Lipoyllysin, wobei ein Molekül Kohlenstoffdioxid frei wird. E1 selbst besteht aus zwei α- und zwei β-Untereinheiten. Von α gibt es beim Menschen eine zweite Isoform, die speziell in den Hoden exprimiert wird.
| Pyruvatdehydrogenase E1 | ||
|---|---|---|
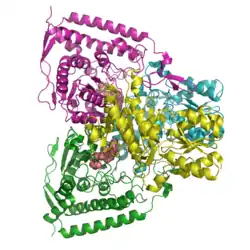 | ||
| Bändermodell des Tetramer nach PDB 1NI4 | ||
| Masse/Länge Primärstruktur | 1380 = 2*361+2*329 Aminosäuren | |
| Sekundär- bis Quartärstruktur | 2α+2β | |
| Kofaktor | Thiamindiphosphat | |
| Bezeichner | ||
| Gen-Name(n) | PDHA1, PDHA2, PDHB | |
| Enzymklassifikation | ||
| EC, Kategorie | 1.2.4.1, Oxidoreduktase | |
| Substrat | Pyruvat + Lipoyllysin-PDHE2 | |
| Produkte | S-Acetyldihydrolipoyllysin -PDHE2 + CO2 | |
| Vorkommen | ||
| Übergeordnetes Taxon | Lebewesen | |
Mutationen in den Genen, die für α und β kodieren (in α allein sind 80 bekannt), können PDHE1-Mangel bis hin zum Leigh-Syndrom und Laktatazidose verursachen.[1][2][3]
Katalysierte Reaktion
Die Decarboxylierung von Pyruvat findet am Thiamin als katalytischem Zentrum statt, welches eine Atombindung mit Pyruvat bildet, so dass Hydroxy-Ethyliden-Thiamin-Pyrophosphat unter Abspaltung von CO2 entsteht.
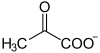 +
+ 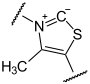 →
→ 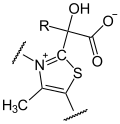 →
→
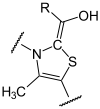 + CO2 (R=CH3)
+ CO2 (R=CH3)
Dieser Hydroxy-Ethyliden-Rest (syn. Acetaldehyd) des TPP wird von der α-Liponsäure übernommen (Oxidation). Sie ist an die Lipoat-Trans-Acetylase-Untereinheit kovalent gebunden. Es entsteht S-Acetyl-Hydrolip(oat/onamid).
 +
+ 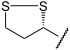 →
→  +
+ 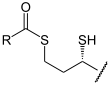 (R=CH3)
(R=CH3)
Es scheint, dass die zwei Thiamin-Moleküle im Tetramer nicht gleichzeitig die genannte Reaktionssequenz durchlaufen. In einer Kristallstudie wurde eine damit zusammenhängende Bewegung des Tetramers festgestellt.[4]
Die hodenspezifische Isoform des Enzyms spielt nach einer Studie an Hamstern eine Rolle bei der Kapazitation.[5]
Regulation
PDHE1 wird durch Phosphorylierung der α-Einheit inaktiviert bzw. durch Dephosphorylierung aktiviert. Das entsprechende Enzym ist die PDH-Kinase (EC 2.7.11.2), welches selbst ein Teil der PDH ist (= Autophosphorylierung). Erhöhte Aktivität kann bereits durch erhöhte Muskelarbeit ausgelöst werden, wobei eine Abhängigkeit der PDH-Phosphatase von der mitochondrialen Ca2+-Konzentration diskutiert wird.[6] Eine Hemmung durch Sepsis konnte bei Ratten gezeigt werden.[1][7][8]
Einzelnachweise
- UniProt P08559
- Cameron JM, Levandovskiy V, Mackay N, Tein I, Robinson BH: Deficiency of pyruvate dehydrogenase caused by novel and known mutations in the E1alpha subunit. In: Am. J. Med. Genet. A. 131, Nr. 1, November 2004, S. 59–66. doi:10.1002/ajmg.a.30287. PMID 15384102.
- Han Z, Gorbatyuk M, Thomas J, Lewin AS, Srivastava A, Stacpoole PW: Down-regulation of expression of rat pyruvate dehydrogenase E1alpha gene by self-complementary adeno-associated virus-mediated small interfering RNA delivery. In: Mitochondrion. 7, Nr. 4, Juli 2007, S. 253–9. doi:10.1016/j.mito.2007.02.003. PMID 17392036. PMC 1973157 (freier Volltext).
- Ciszak EM, Korotchkina LG, Dominiak PM, Sidhu S, Patel MS: Structural basis for flip-flop action of thiamin pyrophosphate-dependent enzymes revealed by human pyruvate dehydrogenase. In: J. Biol. Chem.. 278, Nr. 23, Juni 2003, S. 21240–6. doi:10.1074/jbc.M300339200. PMID 12651851.
- Kumar V, Rangaraj N, Shivaji S: Activity of pyruvate dehydrogenase A (PDHA) in hamster spermatozoa correlates positively with hyperactivation and is associated with sperm capacitation. In: Biol. Reprod.. 75, Nr. 5, November 2006, S. 767–77. doi:10.1095/biolreprod.106.053587. PMID 16855207.
- Rassow J et al. 2008. Biochemie. 2. Auflage, Stuttgart: Thieme Verlag, 109.
- Stellingwerff T, Watt MJ, Heigenhauser GJ, Spriet LL: Effects of reduced free fatty acid availability on skeletal muscle PDH activation during aerobic exercise. Pyruvate dehydrogenase. In: Am. J. Physiol. Endocrinol. Metab.. 284, Nr. 3, März 2003, S. E589–96. doi:10.1152/ajpendo.00418.2002. PMID 12556353.
- Vary TC: Sepsis-induced alterations in pyruvate dehydrogenase complex activity in rat skeletal muscle: effects on plasma lactate. In: Shock. 6, Nr. 2, August 1996, S. 89–94. PMID 8856841.