Retinal
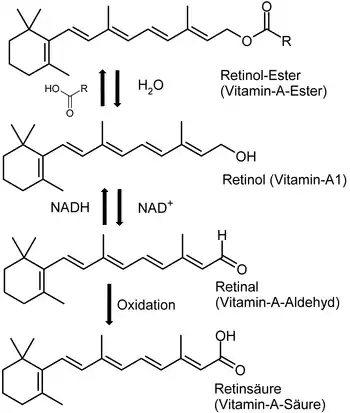
Retinal gehört zu den Carotinoiden und stellt mit anderen verwandten Verbindungen das Vitamin A dar. Es ist der Aldehyd des Retinols, wird daher auch Vitamin-A-Aldehyd genannt.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
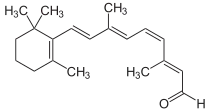 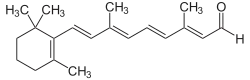 | |||||||||||||||||||
| 11-cis-Retinal (oben), all-trans-Retinal (unten) | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Retinal | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C20H28O | ||||||||||||||||||
| Kurzbeschreibung |
orangerote Kristalle[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 284,44 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Biologische Funktion

Retinal ist das Chromophor zahlreicher lichtempfindlicher Proteine, der Opsine. Es ist kovalent als Imin an einen Lysinrest gebunden und bildet dann Rhodopsin. In bakteriellen und tierischen Rhodopsinen liegt diese Bindestelle an der siebten Transmembranhelix.[4]
In den Stäbchen der Netzhaut ist Retinal im Rhodopsin oder Sehpurpur gebunden und liegt in der Konfiguration als 11-cis-Retinal vor. Von den Stäbchen absorbiertes Licht führt zu einer Streckung des Retinalmoleküls (11-cis-Retinal wird zu all-trans-Retinal), wodurch eine signalverstärkende Signalkaskade ausgelöst wird, die über eine Hyperpolarisation der Rezeptorzelle, bei ausreichendem Lichteinfall, zur Anregung des Sehnervs führt.
Eine geringfügige Hypovitaminose äußert sich in verminderter Nachtsicht. Stärkerer Mangel führt zu einem schnelleren Ermüden der Augen, Nachtblindheit sowie einer Verhornung der Sehzellen des Auges.
Sehvorgang
Zwei isomere Formen des Retinals sind beim Sehvorgang wichtig: das 11-cis-Retinal sowie das all-trans-Retinal. 11-cis-Retinal ist der lichtempfindliche Bestandteil des Rhodopsin-Moleküls, das in den Stäbchen des Auges (siehe Retina) der für das farbneutrale Sehen entscheidende lichtempfindliche Chromophor ist. Durch Absorption von Licht wird das 11-cis-Retinal in die all-trans-Konfiguration überführt,[5] in der es sich von der Proteinkomponente des Rhodopsins, dem Skotopsin, trennt.
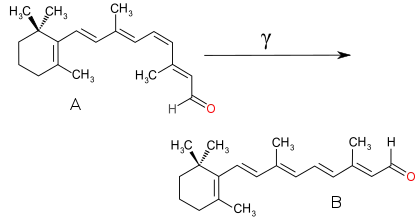
Dies löst eine Signaltransduktionskaskade aus, durch die das Lichtsignal auf dem Umweg über die Aufnahme durch das Retinal und den Zerfall des Rhodopsins in ein elektrochemisches Signal umgewandelt wird, das Rezeptorpotential der Stäbchenzelle. Das entstandene all-trans-Retinal dagegen wird anschließend, sofern kein weiteres Licht einfällt, durch ein Enzym, die sogen. Retinal-Isomerase, wieder in die cis-Form überführt,[5] in der es sich mit der verbliebenen Proteinkomponente zu einem neuen, „empfangsbereiten“ Rhodopsin-Molekül vereinigen kann.
Die Bedeutung des Retinals für das Sehvermögen ist auch der Grund, warum im Volksmund die Aussage verbreitet ist, Karotten seien gut für die Augen. Das β-Carotin in vielen gelb und rötlich gefärbten Gemüsearten wird für die Bildung von Retinal benötigt. all-trans-Retinal ist der Aldehyd des Vitamin A1 (Retinol) und steht somit mit ihm in enger struktureller Beziehung.
Andere isomere Formen des Retinals sind bekannt, besitzen aber weder in der Natur noch in der Technik nennenswerte Bedeutung.
Weblinks
Einzelnachweise
- Eintrag zu RETINAL in der CosIng-Datenbank der EU-Kommission, abgerufen am 20. Mai 2021.
- Eintrag zu Retinal. In: Römpp Online. Georg Thieme Verlag, abgerufen am 22. Dezember 2014.
- Datenblatt all trans-Retinal bei Sigma-Aldrich, abgerufen am 22. April 2011 (PDF).
- O. P. Ernst, D. T. Lodowski, M. Elstner, P. Hegemann, L. S. Brown, H. Kandori: Microbial and animal rhodopsins: structures, functions, and molecular mechanisms. In: Chemical Reviews. Band 114, Nummer 1, Januar 2014, S. 126–163, doi:10.1021/cr4003769, PMID 24364740, PMC 3979449 (freier Volltext) (Review).
- Siegfried Hauptmann: Organische Chemie. 2. Auflage. Deutscher Verlag für Grundstoffindustrie, Leipzig 1988, ISBN 3-342-00280-8, S. 774–775.
