Ceramide
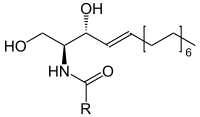
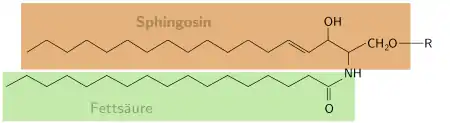
Als Ceramide bezeichnet man eine zu den Lipiden zählende Untergruppe der Sphingolipide. Sie bestehen aus einem Sphingosinmolekül, das durch eine Amidbindung an eine Fettsäure gebunden ist.
Allgemeines
Ceramide kommen zusammen mit anderen Hautbestandteilen im Menschen unter anderem in der Hornschicht (Stratum corneum) vor. Sie bilden dort aufgrund ihrer amphiphilen Struktur Doppellipidschichten und damit eine natürliche Barriere, die die Haut vor dem Austrocknen schützt und das Eindringen von Fremdstoffen verhindert. Bei einer Störung des Gleichgewichts dieser Stoffe kommt es zu trockener Haut oder zu krankhaften Hauterscheinungen wie Dermatosen, atopischer Dermatitis (Neurodermitis) und Schuppenflechte (Psoriasis).
Neben der Barrierefunktion im Stratum Corneum besitzen Ceramide aber auch im restlichen Organismus vielseitige Aufgaben bei der Zelldifferenzierung, Signaltransduktion, Apoptose usw.
Klassen
Die natürlichen Ceramide werden in Klassen unterteilt, die mit römischen Ziffern gekennzeichnet sind und sich in dem chromatographischen Laufverhalten der Ceramide unterscheiden. Besondere Bedeutung hat neben Ceramid III[1] auch das Ceramid I, das ein wichtiger Bestandteil der Bilayer des Stratum corneums ist. Eine neuere und mittlerweile üblichere Nomenklatur richtet sich nach der Struktur des Ceramids und basiert auf einem Buchstabensystem:[2]
| Hydroxylierung der amidierten Fettsäure | Sphingoidbase | |
|---|---|---|
| N – Nicht hydroxyliert | S – Sphingosin | |
| Cer | A – Alpha-Hydroxyfettsäure | P – Phytosphingosin |
| O – Omega-Hydroxyfettsäure | H – 6-Hydroxysphingosin | |
Struktur
Es gibt verschiedene Möglichkeiten der Kettenstruktur, welche unter anderem mittels Röntgenkristallographie bestimmt werden können. Die drei bekanntesten Strukturen beziehen sich auf den Einschlusswinkel α zwischen den beiden Ketten. Dazu zählen die parallele Kettenanordnung mit α = 0°, eine gewinkelte Anordnung mit 0° < α < 180° und der gestreckten Form mit α = 180°. Die jeweils vorkommenden Spezies sind maßgeblich von der Kopfstruktur des Ceramides abhängig und tragen maßgeblich zum Verhalten des Ceramides in Mischsystemen bei. Das heißt, welche lamellaren Zwischenabstände in Doppelschichtsystemen vorherrschen und ob die Ceramidklasse Gel-Phasen, inverse hexagonale Strukturen und Ähnliches ausbildet.[3]
Biosynthese
Die Biosynthese der Ceramide findet beim Menschen im endoplasmatischen Retikulum ausgehend von der Aminosäure Serin und Palmitoyl-CoA statt. Serin und der Thioester Palmitoyl-CoA werden in einer enzymatischen, PALP-katalysierten Reaktion zu 3-Dehydro-Sphingamin verbunden, welches unter NADPH+H+-Verbrauch zu Sphingamin weiterreagiert. Dieses wird entweder zu Sphingosin oder zum Dehydroceramid umgesetzt. Beide Zwischenprodukte reagieren abschließend zum Ceramid. Die Doppelbindung wird in beiden, parallel ablaufenden, Zwischenschritten durch eine Desaturase eingeführt.[4][5]
Linolsäure
Ceramid I ist eine Verbindung, die sich strukturell als ein Ester der Linolsäure darstellt. Bei unzureichender Aufnahme dieser essentiellen Fettsäure kann nicht genügend Ceramid I gebildet werden, wodurch es zu trockener, schuppiger Haut und zu Barrierestörungen kommt.
Biologische Wirkungen
Ceramid gilt als ein zentrales Molekül im Sphingolipid-Stoffwechsel, es moduliert die Aktivität von entsprechenden Enzymen. Zu den Folgen dieser modulierten Enzymaktivität gehören die Hemmung des Zellwachstums, die Induktion der Apoptose, die Förderung der Zelldifferenzierung, der Zellalterung aber auch von entzündlichen Reaktionen.[6] Die physiologische Feinabstimmung und Regulation von Ceramid und seinen Gegenspielern, etwa des Sphingosin-1-phosphats (SPP), ist wahrscheinlich von großer Bedeutung für Gewebshomöostase.[7]
Wirkung von Antidepressiva auf Ceramide
Derzeit wird untersucht, ob ein Zusammenhang zwischen der Einnahme von verschiedenen Antidepressiva, u. a. sogenannten selektiven Wiederaufnahmehemmern, und der physiologischen Ceramid-Produktion in Nervenzellen existiert. Nach siebenjähriger Forschung in der Universität Erlangen-Nürnberg sei man zur Erkenntnis gekommen, dass o. g. Gruppe von Antidepressiva die Bildung von Ceramiden hemmen, die selbst hemmend auf die Bildung neuer Nervenzellen wirken. Durch die dadurch verstärkte Bildung neuer Nervenzellen trügen Antidepressiva zu einer wissenschaftlich bisher unbeachteten aber entscheidenden Verbesserung der Stimmung von Patienten bei.[8]
Verwendung
Ceramide werden in Form kosmetischer Präparate bei trockener Haut und zur Haarpflege eingesetzt. In der Medizin dienen sie der Prävention (Vorbeugung) von Hautstörungen und der medizinischen Hautpflege bei Hautkrankheiten wie atopischer Dermatitis (Neurodermitis) und Schuppenflechte (Psoriasis).
Einzelnachweise
- S. Raudenkolb, W. Hübner u. a.: Polymorphism of ceramide 3. Part 1: an investigation focused on the head group of N-octadecanoylphytosphingosine. In: Chemistry and physics of lipids. Band 123, Nummer 1, März 2003, S. 9–17, PMID 12637161.
- S. Motta, M. Monti u. a.: Ceramide composition of the psoriatic scale. In: Biochimica et Biophysica Acta. Band 1182, Nummer 2, September 1993, S. 147–151, PMID 8357845.
- S. Raudenkolb: Untersuchungen zur strukturellen und physikochemischen Charakterisierung von Stratum corneum Lipiden und deren Mischsysteme. (PDF; 7,3 MB) Dissertation, Math.-Nat.-Tech. Fakultät der Martin-Luther-Universität Halle-Wittenberg, 2002, S. 19.
- Rassow, Hauser, Netzker, Deutzmann: Biochemie, 3. Auflage, Thieme-Verlagsgruppe, ISBN 978-3-13-125353-8, S. 337
- Karlson, Doenecke, Koolman, Fuchs, Gerok: Karlsons Biochemie und Pathobiochemie. 15. überarb. u. neugestaltete Auflage. Thieme, Stuttgart 2005, ISBN 3-13-357815-4, S. 303.
- M. E. Venable, J. Y. Lee u. a.: Role of ceramide in cellular senescence. In: The Journal of biological chemistry. Band 270, Nummer 51, Dezember 1995, S. 30701–30708, PMID 8530509.
- Gerit Goltz: Charakterisierung von Ceramidase-Inhibitoren an der humanen Keratinozyten-Zellinie HaCaT. Dissertation, Freie Universität Berlin, 2002, S. 4.
- Antidepressiva haben überraschende Wirkung. In: welt.de. 12. Juli 2013, abgerufen am 29. September 2015.