Phosphatidylethanolamine
Phosphatidylethanolamine (kurz PE, auch Kephaline) zählen zu den Lipiden, genauer zu den Phosphoglyceriden. Sie sind eines der wichtigsten am Aufbau von Biomembranen beteiligten Phospholipide. Gemeinsames Strukturelement ist Glycerin, bei dem zwei der drei Hydroxygruppen mit je einer Fettsäure, die dritte mit einem Monoalkylphosphat verestert sind. Das Ende des Alkylrestes trägt weiterhin eine Aminogruppe.
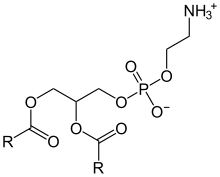
Die freie Hydroxygruppe der Phosphatgruppe liegt unter physiologischen Bedingungen deprotoniert vor, die Aminogruppe ist protoniert. Die Reste R stehen für die Kohlenwasserstoffketten der Fettsäuren.
Phosphatidylethanolamin wird – wie auch Phosphatidylcholin – im Kennedy-Stoffwechselweg erzeugt.[1]
Funktionen
In Zellen
Phosphatidylethanolamine sind in allen lebenden Zellen vorhanden, wobei diese 25 % von allen Phospholipiden darstellen. Im menschlichen Körper werden diese vor allem in Nervengewebe gefunden wie in der weißen Substanz des Gehirns, Nerven und im Rückenmark, wobei diese dort 45 % aller Phospholipiden ausmachen.[2]
Phosphatidylethanolamine spielen auch eine Rolle in der Membranfusion und auch in der Entfernung des kontraktilen Rings der Zytokinese während der Zellteilung.[3] Außerdem geht man davon aus, dass diese auch die Membrankrümmung regulieren.
Im Gegensatz zu Lecithine sind Phosphatidyläthanolamine auch viel dickflüssiger, was einen starken Einfluss auf den Schmelzpunkt hat.
Im Menschen
Im Menschen spielt die Metabolisierung von Phosphatidylethanolamine mit großer Wahrscheinlichkeit eine wichtige Rolle für das Herz. Wenn der Blutfluss in das Herz gestört wird, findet eine asymmetrische Ausgabe von Phosphatidylethanolaminen statt. Außerdem spielen Phosphatidylethanolamine eine Rolle bei der Sekretion des Lipoproteins in der Leber.[4] Phosphatidylethanolamine beeinflussen auch die Blutgerinnung, indem diese den Wert von Thrombinen erhöhen.[5]
In Bakterien
Wobei Phosphatidylcholine eines der wichtigsten Phospholipide der Tiere sind, sind Phosphatidylethanolamine einer der von Bakterien. Eines der Hauptfunktionen bei Bakterien ist hierbei die Äußerung von negativen Ladungen durch das ionische Membran Phospholipid.
Weblinks
- William W. Christie: Phosphatidylethanolamine and related lipids: structure, occurrence, biochemistry and analysis. (PDF; 168 kB) In: Lipid Library. AOCS, 1. Juli 2014, abgerufen am 22. April 2017 (englisch).
Einzelnachweise
- F. Gibellini, T. K. Smith: The Kennedy pathway–De novo synthesis of phosphatidylethanolamine and phosphatidylcholine. In: IUBMB life. Band 62, Nummer 6, Juni 2010, S. 414–428, doi:10.1002/iub.337. PMID 20503434.
- Jean E. Vance, Guergana Tasseva: Formation and function of phosphatidylserine and phosphatidylethanolamine in mammalian cells. In: Biochimica et Biophysica Acta (BBA) - Molecular and Cell Biology of Lipids (= Phospholipids and phospholipid metabolism). Band 1831, Nr. 3, 1. März 2013, ISSN 1388-1981, S. 543–554, doi:10.1016/j.bbalip.2012.08.016 (sciencedirect.com [abgerufen am 28. Mai 2020]).
- Kazuo Emoto, Toshihide Kobayashi, Akiko Yamaji, Hiroyuki Aizawa, Ichiro Yahara: Redistribution of phosphatidylethanolamine at the cleavage furrow of dividing cells during cytokinesis. In: Proceedings of the National Academy of Sciences. Band 93, Nr. 23, 12. November 1996, ISSN 0027-8424, S. 12867–12872, doi:10.1073/pnas.93.23.12867, PMID 8917511 (pnas.org [abgerufen am 28. Mai 2020]).
- Jean E. Vance: Thematic Review Series: Glycerolipids. Phosphatidylserine and phosphatidylethanolamine in mammalian cells: two metabolically related aminophospholipids. In: Journal of Lipid Research. Band 49, Nr. 7, 1. Juli 2008, ISSN 0022-2275, S. 1377–1387, doi:10.1194/jlr.R700020-JLR200, PMID 18204094 (jlr.org [abgerufen am 28. Mai 2020]).
- Rinku Majumder, Xiaoe Liang, Mary Ann Quinn-Allen, William H. Kane, Barry R. Lentz: Modulation of Prothrombinase Assembly and Activity by Phosphatidylethanolamine. In: Journal of Biological Chemistry. Band 286, Nr. 41, 14. Oktober 2011, ISSN 0021-9258, S. 35535–35542, doi:10.1074/jbc.M111.260141, PMID 21859710 (jbc.org [abgerufen am 28. Mai 2020]).