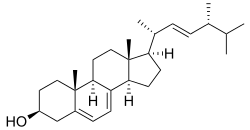
Ergosterin
Ergosterin, auch Ergosterol genannt, ist ein biochemisch wichtiger Naturstoff aus der Gruppe der Sterine (Sterole), genauer der pilzlichen Mycosterine. Es kommt in der Zellmembran von Pilzen und Mykoplasmen vor.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Ergosterin | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C28H44O | |||||||||||||||||||||
| Kurzbeschreibung |
weißes, kristallines Pulver[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 396,65 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt | ||||||||||||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser[2] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Bedeutung in Pilzen
Ergosterin ist ein Sterin, das in Pilzen vorkommt und nach Mutterkorn benannt ist, dem gemeinsamen Namen von Mitgliedern der Pilzgattung Claviceps, von der Ergosterin zuerst isoliert wurde. Ergosterin ist ein Bestandteil von Hefe und Zellmembranen anderer Pilze und erfüllt viele der Funktionen, die Cholesterin in tierischen Zellen erfüllt.[5]
Ziel für Antimykotika
Da Ergosterin in den Zellmembranen von Pilzen vorhanden ist, in denen von Tieren jedoch fehlt, ist es ein wichtiges Ziel für Medikamente. Ergosterin ist auch in den Zellmembranen einiger Protisten, wie z. B. den Trypanosomatida vorhanden.[6]
Amphotericin B, ein Antimykotikum, bindet physikalisch an Ergosterin innerhalb der Membran und bildet so eine polare Pore in den Pilzmembranen. Dies führt dazu, dass Ionen (vor allem Kalium und Protonen) und andere Moleküle austreten, was zum Tod der Zelle führt.[7] Amphotericin B ist in den meisten Fällen durch sicherere Mittel ersetzt worden, wird aber trotz seiner Nebenwirkungen immer noch bei lebensbedrohlichen Pilz- oder Protozoeninfektionen eingesetzt.
Amorolfin, Fluconazol, Miconazol, Itraconazol, Clotrimazol und Myclobutanil wirken auf eine andere Weise, indem sie die Synthese von Ergosterin aus Lanosterin hemmen.[8] Ergosterin ist ein kleineres Molekül als Lanosterin. Es wird synthetisiert, indem zwei Moleküle Farnesylpyrophosphat, ein 15 Kohlenstoffatome langes Terpenoid, zu Lanosterin mit 30 Kohlenstoffatomen kombiniert werden. Dann werden zwei Methylgruppen entfernt, wodurch Ergosterin entsteht. Die Antimykotika der Klasse der Triazole hemmen das Enzym, das diese Demethylierung im Biosyntheseweg zwischen Lanosterin und Ergosterin durchführt, was zu Membrandefekten der Pilzzelle führt..[8]
Biosynthese
Ergosterin ist eine Vorstufe (Provitamin) des Vitamin D2 (Ergocalciferol), in das es photochemisch durch UV-Strahlung (zum Beispiel Sonnenlicht) umgewandelt werden kann. Dieser Zusammenhang wurde 1927 vom Göttinger Chemiker Adolf Windaus entdeckt (Nobelpreis für Chemie 1928) und in den Folgejahren eingehend untersucht; die Strukturformel konnte 1934 aufgeklärt werden.
Eine im Jahr 2009 veröffentlichte Untersuchung[9] deutet darauf hin, dass der Ergosteringehalt im Hausstaub als Schnellmethode für die Detektion einer Schimmelpilzbelastung in Innenräumen verwendet werden kann.
Einzelnachweise
- Eintrag zu ERGOSTEROL in der CosIng-Datenbank der EU-Kommission, abgerufen am 2. April 2020.
- Datenblatt Ergosterin bei Acros, abgerufen am 21. Februar 2010.
- Datenblatt Ergosterin bei AlfaAesar, abgerufen am 21. Februar 2010 (PDF) (JavaScript erforderlich).
- Datenblatt Ergosterol bei Sigma-Aldrich, abgerufen am 14. August 2014 (PDF).
- J. D. Weete,M. Abril, M. Blackwell: Phylogenetic distribution of fungal sterols. In: PLOS ONE. Band 5, Nr. 5, 2010, S. e10899. doi:10.1371/journal.pone.0010899. PMID 20526375. PMC 2878339 (freier Volltext).
- C. W. Roberts, R. McLeod, D. W. Rice, M. Ginger, M. L. Chance, L. J. Goad: Fatty acid and sterol metabolism: potential antimicrobial targets in apicomplexan and trypanosomatid parasitic protozoa. In: Molecular and Biochemical Parasitology. Band 126, Nr. 2, Februar 2003, S. 129–42. doi:10.1016/S0166-6851(02)00280-3. PMID 12615312.
- D. Ellis: Amphotericin B: spectrum and resistance. In: The Journal of Antimicrobial Chemotherapy. Band 49, Supplement 1, Februar 2002, S. 7–10. doi:10.1093/jac/49.suppl_1.7. PMID 11801575.
- Q. Z. Lv, L. Yan, Y. Y. Jiang: The synthesis, regulation, and functions of sterols in Candida albicans: Well-known but still lots to learn. In: Virulence. Band 7, Nr. 6, August 2016, S. 649–59. doi:10.1080/21505594.2016.1188236. PMID 27221657. PMC 4991322 (freier Volltext).
- Ilka Toepfer, Werner Butte: Chemische Indikatoren für Schimmelpilze im Hausstaub. In: Gefahrstoffe – Reinhaltung Luft. 2009, Band 69, Nr. 3, S. 91–95, ISSN 0949-8036.