Systembiologie
Die Systembiologie (Synonym: Systeomik, englisch systems biology, integrative biology oder predictive biology)[1] ist ein Zweig der Biowissenschaften, der versucht, biologische Organismen in ihrer Gesamtheit zu verstehen.
Das Ziel ist, ein integriertes Bild aller regulatorischen Prozesse über alle Ebenen vom Genom über das Proteom zu den Organellen bis hin zum Verhalten und zur Biomechanik des Gesamtorganismus zu bekommen. Wesentliche Methoden zu diesem Zweck stammen aus der Systemtheorie und ihren Teilgebieten. Da aber die mathematisch-analytische Seite der Systembiologie nicht perfekt ist, kommen als Forschungsmethoden häufig Computersimulationen und Heuristiken zum Einsatz.
Die Systembiologie führt die Zeit als wichtigen Faktor wieder in die Molekularbiologie ein. Diese vermied bisher eher Überlegungen über den exakten zeitlichen Ablauf von Reaktionen; ganz im Gegensatz zur Biochemie. Die Systembiologie kehrt zur biochemischen Sichtweise der Welt zurück, macht sich Gedanken über Prozesse und wie diese sich im Laufe der Zeit verändern, jedoch mit einer radikalen Erweiterung der Skala. In der Systembiologie werden tausende Reaktanten beobachtet, wodurch Systembiologie in einer deutlich dynamischeren Sichtweise der Biologie resultiert als die der klassischen Molekularbiologie oder Genetik.
Definitionen
- Systembiologie untersucht nicht einzelne Gene oder Proteine zu einem bestimmten Zeitpunkt, wie das die letzten 30 Jahre erfolgreich praktiziert wurde. Sie untersucht das Verhalten und das Verhältnis aller Elemente in einem bestimmten biologischen System, während es funktioniert.[2]
- Um Biologie auf einer systemischen Ebene zu verstehen, müssen die Struktur und die Dynamik der zellulären Funktionen sowie der Funktionen des Organismus und nicht die Eigenschaften isolierter Teile einer Zelle oder eines Organismus untersucht werden.[3]
- Systembiologie versucht, das Verhalten eines biologischen Prozesses, welcher Störungen ausgesetzt wurde, quantitativ vorherzusagen, so dass dieses quantitative Verfahren seine Stärke auf expliziter Einbeziehung der am Prozess beteiligten Komponenten, ihrer Interaktionen und realistischer Werte ihrer Konzentrationen, Aufenthaltsorte und Zustände begründet.[4][5]
- Eine Disziplin am Schnittpunkt zwischen Biologie, Mathematik und Physik welche experimentelle und rechnerbetonte Ansätze vereint, um biologische Prozesse in Zellen, Geweben und Organismen zu verstehen.[6]
- Die Systembiologie zielt darauf ab, zu einem umfassenden quantitativen Verständnis der dynamischen Interaktionen zwischen den Bausteinen und Komponenten eines biologischen Systems zu gelangen, um das Verhalten des Systems als Ganzes zu verstehen und Vorhersagen zu ermöglichen. Zur Erreichung dieses Ziels werden mathematische Konzepte auf biologische Systeme angewandt. Von zentraler Bedeutung ist hierbei ein interaktiver Prozess zwischen Laborexperiment und Modellierung im Computer.
Geschichte
- Das Konzept integrativer Studien biologischer Systeme ist nicht neu. Ein biologisches Teilgebiet, in welchem Systemanalyse bereits seit mehreren Jahrzehnten betrieben wird, ist die Ökologie. Die berühmte Lotka-Volterra-Gleichung von 1931 kann bereits als systemischer Ansatz gewertet werden.[7]
- Als Vorläufer der Systembiologie kann die Allgemeine Systemtheorie von Ludwig von Bertalanffy angesehen werden.
- Die Bedeutung der Systembiologie wurde 1948 von Norbert Wiener erkannt.[8]
- Als Pioniere der Systembiologie gelten die britischen Neurophysiologen und Nobelpreisträger Alan Lloyd Hodgkin und Andrew Fielding Huxley, die 1952 mit dem mathematischen Modell einer Nervenzelle die Grundlagen für die mathematische Simulation von Lebensprozessen auf Basis von Differenzialgleichungen legten.[9]

- 1960 erregte Denis Noble mit der Publikation seiner Doktorarbeit in der Zeitschrift Nature Aufsehen; er präsentierte darin das erste mathematische Modell eines schlagenden Herzens, mit dem neue Medikamente und Defibrillationsgeräte am Computer getestet werden können.[10]
- Der Begriff Systembiologie ist seit den 60er Jahren in Gebrauch; ursprünglich in Verbindung mit dynamischen Interaktionen, mathematischer Modellierung und Simulation biologischer Signalwege.[11]
- 1970 beschrieb Jacques Monod, der an regulatorischen Proteinen forschte, insbesondere an allosterischen Enzymen, die Kybernetik bzw. feedback-regulierten Mechanismen auf molekularem Level.[12]
- Der Durchbruch für die Systembiologie kam um die Jahrtausendwende durch die Entwicklung von Hochdurchsatztechnologien zur Messung von Genexpression, Proteinexpression und Protein-Protein Interaktion auf molekularem Level und dem Abschluss des Humangenomprojekts und zahlreicher anderer Genomprojekte. Die Flut der dabei erhaltenen Daten für etwa drei Milliarden Basenpaare und über eine Million Proteine pro Zelle macht es unmöglich, alle theoretisch denkbaren und interessierenden Experimente im Labor durchzuführen. Deshalb ist die Modellierung am Computer zur Voraussetzung für die Auswahl der erfolgversprechendsten Ansätze geworden.
Die verbreitete Nutzung des Internets war eine Grundvoraussetzung für den Durchbruch der Systembiologie, da erst damit die gemeinsame Nutzung riesiger Datenmengen in internationaler Zusammenarbeit ermöglicht wurde.
Den aktuellen Stand der Wissenschaft kann man in spezialisierten Fachzeitschriften, wie Molecular Systems Biology, sowie auf zahlreichen internationalen Kongressen wie z. B. der ICSB verfolgen.
Methodische Ansätze
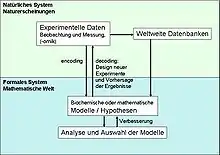
Ein systembiologischer Ansatz umfasst sich wiederholende Zyklen von Experimenten und hypothesengetriebener Modellierung:
- Eine vollständige Charakterisierung der wesentlichen Bestandteile eines Organismus, wie seine Moleküle und deren Interaktion und wie diese Interaktionen die Funktion der Zelle regulieren.
- Analyse der Reaktionen eines Organismus auf Störungen, wie Deletion oder Überexpression von Genen, Änderung der Wachstumsbedingungen oder Stimulation mit Hormonen.
- Eine zeitliche und räumliche Charakterisierung der Zellen, z. B. deren Kompartimentierung, Vesikulartransport und Dynamik der unterschiedlichen Komponenten.
- Anschließend werden die gewonnenen Informationen in mathematische Modelle übersetzt, um das gewonnene Wissen zu testen und Hypothesen zu formulieren und gegebenenfalls das Modell anhand der experimentell gewonnenen Erkenntnisse zu verbessern.
Anhand dieser mathematischen Modelle kann das Verhalten eines Systems unter bestimmten Bedingungen vorhergesagt werden und letztendlich neue Strategien entwickelt werden, um Zellen zu manipulieren und zu kontrollieren, was letztendlich zu Entwicklung neuer Medikamente führen kann.
Grundsätzlich unterscheidet man
- Top-down-Ansatz: In den Forschungszweigen der '-omik', wie Genomik, Proteomik, Toponomik, Transkriptomik, Metabolomik, Glycomik, Interaktomik, Intergenomik und Fluxomik, erwies sich der Top-down-Ansatz als die vorherrschende Methode der Wahl. Der Top-down-Ansatz beginnt mit der „Vogelperspektive“, d. h., es werden zuerst experimentelle Daten mit Hochdurchsatzmethoden erzeugt und gesammelt, und anschließend versucht man in diesen Daten biologische Mechanismen zu entdecken und zu charakterisieren. Das Hauptziel des Top-down-Ansatzes ist es, neue molekulare Mechanismen durch Analyse experimenteller Daten und Formulierung von Hypothesen, welche wiederum durch Experimente überprüft werden, zu entdecken.
- Bottom-up-Ansatz: Der Bottom-up-Ansatz ermittelt die Eigenschaften eines bereits charakterisierten Subsystems, indem die Interaktionen einer jeden Komponente beschrieben werden. Diese mathematischen Modelle werden anschließend verwendet, um das Verhalten des jeweiligen Systems vorherzusagen. Das Ziel dieses zweiten Ansatzes ist die Kombination der verschiedenen Stoffwechselwege zu einem Modell des ganzen Systems mit dem Endziel der synthetischen Biologie. Bottom-up-Ansätze benötigen:
- Detaillierte Informationen über die kinetischen und physikalisch chemischen Eigenschaften der einzelnen beteiligten Komponenten.
- Detaillierte Daten über die Reaktion des Systems auf externe Reize.
- Detaillierte Computermodelle, um Hypothesen zu testen, das Modell zu verbessern und Vorhersagen machen zu können.
- Entwicklung von Werkzeugen zur Darstellung und Analyse der erzeugten Modelle.[13]
Gegenwärtig diskutiert man in der Wissenschaftsphilosophie inwiefern man die Philosophie der Physik auf diejenige der Systembiologie übertragen kann. Offensichtlich handelt es sich beim Forschungsfeld der Systembiologie um eine Erweiterung der klassischen Molekularbiologie mit mathematischen Methoden. Da die mathematische Modellbildung in der Systembiologie eine ähnlich große Rolle spielt wie in der Physik dachte man anfangs man könne die der Physik zugrunde liegende Epistemologie auf die Systembiologie übertragen. Jedoch fehlt es der Systembiologie an universalen Theorien wie der allgemeinen Relativitätstheorie oder den Maxwellschen Grundgleichungen der Elektrodynamik. Es scheint deswegen nötig zu sein, eine eigene Philosophie der Systembiologie zu entwickeln.
Mathematik und Modellierung
Die Basis beider Ansätze sind Differenzialgleichungen, die die Veränderung von biologischen Phänomenen zu einem bestimmten Zeitpunkt beschreiben. So ändert sich z. B. das Membranpotenzial einer Nervenzelle nach dem Hodgkin-Huxley-Modell u. a. als Funktion der Ionenströme von Kalium und Natrium:
- .
Beispiele für Systembiologie
- Prinzipien bakterieller Signalnetzwerke:
Biochemische Netzwerke in Zellen müssen in einer chaotischen Umgebung mit nicht perfekten Komponenten zuverlässig funktionieren. Markus Kollman und Kollegen[14] konnten 2005 durch Kombination von Experimenten und Modellierung am Computer zeigen, dass Escherichia coli das kleinste, ausreichend robuste chemotaktische System hat, welches eine präzise chemotaktische Antwort des Organismus erlaubt, während die Kosten für den Organismus minimiert sind.
- Verteilung der Haarfollikel:
Die gleichmäßige Verteilung der Haarfollikel hat Wissenschaftler schon lange fasziniert. Sick und Kollegen[15] konnten mittels eines reaction-diffusion-Modells zeigen, dass das Protein WNK und sein Inhibitor DKK die Dichte der Haarfollikel erhöhen können und dass noch weitere Signaltransduktionswege am Verteilungsmuster der Haarfollikel beteiligt sind.
Der JAK-STAT-Signalweg ist an vielen Signalwegen von an der Zelloberfläche liegenden Rezeptoren, wie z. B. dem für Epo, beteiligt. Swameye I. und Kollegen[16] konnten anhand mathematischer Modellierung des JAK-STAT-Signalwegs zeigen, dass das STAT5-Protein, welches experimentellen Messungen nicht direkt zugänglich war, periodisch vom Zellkern zum Zytoplasma und zurück transportiert wird. Das dabei im Zuge der Aktivierung von STAT5 die beiden Isoformen STAT5A und STAT5B randomisiert Homo- und Heterodimere bilden und diese nach deren Translokation unterschiedliche Retentionszeiten im Zellkern haben, konnte später ebenfalls in einem systembiologischen Ansatz mithilfe von mathematischer Modellierung von Böhm M. E. und Kollegen gezeigt werden.[17]
Förderprojekte
National
Die Systembiologie und ihre Methodenentwicklung wird nachhaltig durch die EU im Rahmen des 6. und 7. Rahmenprogramms gefördert. Das Bundesministerium für Bildung und Forschung (BMBF) fördert die Systembiologie bereits seit 2004 im Rahmen des Forschungsprojekts HepatoSys (Kompetenznetz Systembiologie des Hepatozyten).
Seit Januar 2007 fördert das BMBF die deutsche Systembiologie mit dem Förderprogramm „Biotechnologie – Chancen nutzen und gestalten“ FORSYS (Forschungseinheiten der Systembiologie-FORSYS) mit vier Zentren für Systembiologie. Die vier FORSYS-Zentren befinden sich in Freiburg im Breisgau (FRISYS – Freiburg Initiative for Systems Biology, Sprecher: Wolfgang R. Hess), Heidelberg (VIROQUANT – Systems Biology of Virus-Cell Interactions), Potsdam (GoFORSYS) und Magdeburg (in Zusammenarbeit mit dem Max-Planck-Institut für Dynamik komplexer technischer Systeme). FORSYS ist als „Leuchtturm der deutschen Systembiologie“ konzipiert und wird mit dem Programm „Partner der Forschungseinheiten Systembiologie – FORSYS-Partner“ weiter ausgebaut. Ein weiterer Großverbund von Forschungsprojekten wird seit 2007 durch die Helmholtz-Gemeinschaft gefördert. Die „Helmholtz-Allianz Systembiologie“ beschäftigt sich vor allem mit der Erforschung von Ursachen komplexer Erkrankungen. An ihm sind die Helmholtz Zentren DKFZ, FZJ, HZI, GSF, MDC und UFZ beteiligt. Neben Wissenschaftlern aus der Helmholtz-Gemeinschaft werden eine Vielzahl von externen Kooperationspartnern gefördert.
Transnational
SysMO („Systembiologie an Mikroorganismen“ oder „Systems Biology of Microorganisms“) ist eine transnationale Initiative zur Forschungsförderung, die vom Bundesministerium für Bildung und Forschung gemeinsam mit dem Bundesministerium für Bildung, Wissenschaft und Kultur in Österreich, der Niederländischen Organisation für wissenschaftliche Forschung, dem Wissenschaftsrat von Norwegen, dem Ministerium für Bildung und Wissenschaft in Spanien und dem Wissenschaftsrat für Biotechnologie und biologische Forschung in Großbritannien getragen wird.[18] Das Ziel von SysMO ist die Etablierung einer Systembiologie einzelliger Mikroorganismen. Aus Österreich sind 2, aus Deutschland 29, aus Norwegen 7, aus Spanien 9, aus den Niederlanden 15, aus Großbritannien 22, aus Tschechien 1, aus Frankreich 2 und aus der Schweiz 4 Gruppen Teil der SysMO Initiative.
Kritik
Der Nobelpreisträger und Biologe Sydney Brenner charakterisierte das Fachgebiet in einem Paper als „low input, high throughput, no output science.“[19]
Siehe auch
- Stöchiometrische Matrix
- biochemische Zyklen
- biomedizinische Kybernetik
- Biologische Kybernetik
- Neuroinformatik
- Computational Neuroscience
- Grid-Computing
- Netzwerktheorie
- Netzwerkinferenz
- -omik,
- Partielle Differentialgleichung
- Petri-Netz
- Proteomik
- Regelung
- SBML (Systems Biology Markup Language)
- Synthetische Biologie
- Theoretische Biologie
- Bioinformatik
- Physiologie
- Bioökonomie
Literatur
Deutsch
- Wolfgang Wiechert: Systembiologie – Eine interdisziplinäre Herausforderung. Schöningh, Paderborn 2004, ISBN 3-506-72876-8.
- Andreas Kremling: Kompendium Systembiologie – Mathematische Modellierung und Modellanalyse. Vieweg + Teubner, 2011, ISBN 978-3-8348-1907-9.
- Detlef Weinich: Systembiologie – Dynamik und Wechselbeziehungen als Forschungsgegenstand. Wurzeln und Bedeutung des Netzwerkdenkens im neueren Wissenschaftsverständnis. In: Würzburger medizinhistorische Mitteilungen. 21, 2002, S. 473–489.
Englisch
- H. Kitano: Systems Biology: a brief overview. In: Science. 295, 2002, S. 1662–1664.
- Edda Klipp, Wolfram Liebermeister, Christoph Wierling, Axel Kowald: Systems Biology - A Textbook. 2. Auflage. Wiley 2016, ISBN 978-3-527-33636-4.
- Athel Cornish-Bowden: Putting the Systems Back into Systems Biology. In: Perspectives in Biology and Medicine. Volume 49, Nr. 4, Autumn 2006, S. 475–489.
- Systems biology: The reincarnation of systems theory applied in biology?
- A. Spivey: Systems biology: the big picture. In: Environ Health Perspect. 112(16), Nov 2004, S. A938–A943 PMID 15598608
- K. Aggarwal, K. H. Lee: Functional genomics and proteomics as a foundation for systems biology. In: Brief Funct Genomic Proteomic. 2(3), Oct 2003, S. 175–184.
- O. Wolkenhauer, U. Klingmüller: Systems Biology: From a Buzzword to a Life Sciences Approach. In: BIOforum Europe. 04/2004, Git Verlag, Darmstadt, S. 22–23.
- Stefan Schuster, Roland Eils, Klaus Prank: 5th International Conference on Systems Biology, Heidelberg, October 9–13, 2004. (ICSB 2004; PDF; 66 kB) In: Biosystems. Volume 83, Nr. 2–3, February-March 2006, S. 71–74.
- Uri Alon: An Introduction to Systems Biology: Design Principles of Biological Circuits. Chapman & Hall/CRC, 2006, ISBN 1-58488-642-0.
- Bernhard O. Palsson: Systems Biology: Properties of Reconstructed Networks. Cambridge University Press, 2006, ISBN 0-521-85903-4.
- A.K. Konopka: Systems Biology: Principles, Methods, and Concepts . CRC, 2006, ISBN 0-8247-2520-4.
- Isidore Rigoutsos (Editor), Gregory Stephanopoulos (Hrsg.): Systems Biology: Volume I: Genomics. Oxford University Press, 2006, ISBN 0-19-530081-5.
- Isidore Rigoutsos, Gregory Stephanopoulos (Hrsg.): Systems Biology: Volume II: Networks, Models, and Applications. Oxford University Press, 2006, ISBN 0-19-530080-7.
- Edda Klipp, Ralf Herwig, Axel Kowald, Christoph Wierling, Hans Lehrach: Systems Biology in Practice: Concepts, Implementation and Application. Wiley-VCH, 2005, ISBN 3-527-31078-9.
- Hiroaki Kitano: Foundations of Systems Biology. The MIT Press, 2001, ISBN 0-262-11266-3.
- Zoltan Szallasi, Jörg Stelling, Vipul Periwal: System Modeling in Cellular Biology: From Concepts to Nuts and Bolts. The MIT Press, 2006, ISBN 0-262-19548-8.
- Fred Boogerd, Frank J. Bruggeman, Jan-Hendrik S. Hofmeyr, H.V. Westerhoff: Systems Biology: Philosophical Foundations. Elsevier Science, 2007, ISBN 978-0-444-52085-2.
- Andres Kriete, Roland Eils: Computational Systems Biology. Academic Press, 2005, ISBN 0-12-088786-X.
- Darren J. Wilkinson: Stochastic Modelling for Systems Biology. Chapman & Hall/CRC, 2006, ISBN 1-58488-540-8.
- Kunihiko Kaneko: Life: An Introduction to Complex Systems Biology. Springer, 2006, ISBN 3-540-32666-9.
- Andriani Daskalaki (Hrsg.): Handbook of Research on Systems Biology Applications in Medicine. Medical Information Science Reference, 2008, ISBN 978-1-60566-076-9.
- Encyclopedia of Systems Biology. Springer, 2013, ISBN 978-1-4419-9864-4.
Weblinks
Einzelnachweise
- Stefan Schuster, Roland Eils, Klaus Prank: 5th International Conference on Systems Biology (ICSB 2004), Heidelberg, October 9–13, 2004. In: Biosystems. Volume 83, Nr. 2–3, February-March 2006, S. 71–74.
- T. Ideker, T. Galitski, L. Hood: A new approach to decoding life: Systems Biology. In: Annu. Rev. Genomics Hum. Genet. 2, S. 343.
- H. Kitano: Computational systems biology. In: Nature. 420, 2002, S. 206.
- J. Anderson: The National Institute of General Medical Sciences at NIH. 2003.
- T. Ideker, L. R. Winslow, D. A. Lauffenburger: Bioengineering and systems biology. In: Ann Biomed Eng. 34(2), Feb 2006, S. 257–264.
- The National Institute of General Medical Sciences at NIH: National Centers for Systems Biology. 2007.
- V. Volterra: Leçon sur la théorie mathématique de la lutte pour la vie. Gauthier-Villars, Paris 1931.
- Norbert Wiener: Cybernetics or Control and Communication in the Animal and the Machine. The MIT Press, Cambridge, MA 1961.
- A. L. Hodgkin, A. F. Huxley: A quantitative description of membrane current and its application to conduction and excitation in nerve. In: J Physiol. 117, 1952, S. 500–544. PMID 12991237.
- D. Noble: Cardiac action and pacemaker potentials based on the Hodgkin-Huxley equations. In: Nature. 188, 1960, S. 495–497.
- O. Wolkenhauer, U. Klingmüller: Systems Biology: From a Buzzword to a Life Sciences Approach. In: BIOforum Europe. 04/2004, Git Verlag, Darmstadt, S. 22–23.
- J. Monod: Le hasard et la nécessitté. Seuil, Paris 1970.
- F. J. Bruggemann, H. V. Westerhoff: The nature of systems biology. In: Trends in Microbiology. Vol. 15 No. 1.
- M. Kollmann, K. Bartholome, L. Lovdok, J. Timmer, V. Sourjik: Design principles of a bacterial signalling network. In: Nature. 438, 2005, S. 504–507.
- S. Sick, S. Reinker, J. Timmer, T. Schlake: WNT and DKK determine hair follicle spacing through a reaction-diffusion mechanism. In: Science. 314, 2006, S. 1447–1450.
- I. Swameye, T. G. Müller, J. Timmer, O. Sandra, U. Klingmüller: Identification of nucleocytoplasmic cycling as a remote sensor in cellular signaling by data-based modeling. In: Proc. Natl. Acad. Sci. 100, 2003, S. 1028–1033.
- M. E. Böhm, L. Adlung, M. Schilling, S. Roth, U. Klingmüller, W. D. Lehmann: Identification of Isoform-Specific Dynamics in Phosphorylation-Dependent STAT5 Dimerization by Quantitative Mass Spectrometry and Mathematical Modeling. In: J Proteome Res. 13, 2014, S. 5685–5569. PMID 25333863
- Bekanntmachung des BMBF
- Errol C. Friedberg: Sydney Brenner. In: Nature Reviews Molecular Cell Biology. 9, 2008, S. 8–9, doi:10.1038/nrm2320.