Tetrahydropyran
Tetrahydropyran ist eine heterocyclische, sauerstoffhaltige, chemische Verbindung aus der Gruppe der cyclischen Ether. Es ist eine farblose, hygroskopische Flüssigkeit. Sie ist leichtentzündlich und bildet am Licht in Gegenwart von Luft explosive Peroxide. Deshalb wird sie meist mit Stabilisatorzusätzen versehen.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| zwei unterschiedliche Darstellungsweisen von Tetrahydropyran | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Tetrahydropyran | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C5H10O | |||||||||||||||||||||
| Kurzbeschreibung |
farblose, hygroskopische Flüssigkeit[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 86,13 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||||||||
| Dichte |
0,88 g·cm−3[1] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
88 °C[1] | |||||||||||||||||||||
| Dampfdruck |
95,3 hPa (25 °C)[1] | |||||||||||||||||||||
| Löslichkeit |
mäßig in Wasser (80 g·l−1 bei 20 °C)[1] | |||||||||||||||||||||
| Brechungsindex |
1,421[2] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||||||||
Vorkommen
Der Tetrahydropyranring bildet recht häufig die Grundstruktur in Naturstoffen. So kommt er in Kohlenhydraten, wie zum Beispiel Rohrzucker, Traubenzucker und Galactose vor und wird dort als Pyranoseform bezeichnet. Der sehr kompliziert gebaute Naturstoff Maitotoxin, ein starker Giftstoff, der von marinen Algen produziert wird, enthält 28 Tetrahydropyranringe im Molekülgerüst.
Gewinnung und Darstellung
Eine Standardmethode zur Synthese von Tetrahydropyran ist die Hydrierung von Dihydropyran mit Raney-Nickel als Katalysator.
Eine weitere Möglichkeit besteht in der Dehydratisierung von 1,5-Diolen, welche auch als cyclisierende, intramolekulare Kondensationsreaktion aufgefasst werden kann.[3]
Eigenschaften
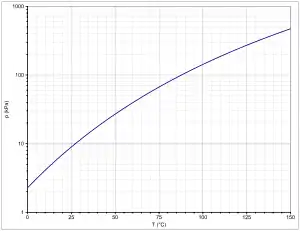
Seine Dämpfe sind dreimal so schwer wie Luft. Der Tetrahydropyranring bildet im Raum keine planare Struktur, sondern meist eine Sesselform aus.[4] Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in kPa, T in °C) mit A = 5,85520, B = 1131,93 und C = 205,83.[5]
Die Verbindung zeigt mit einem Wassergehalt von 39,5 Mol% ein bei 75 °C siedendes Azeotrop.[6] Die Mischbarkeit mit Wasser ist begrenzt. Mit steigender Temperatur sinkt die Löslichkeit von Tetrahydropyran in Wasser bzw. steigt die Löslichkeit von Wasser in Tetrahydropyran.[7]
Löslichkeiten zwischen Tetrahydropyran und Wasser[7] Temperatur °C 0 9,4 19,9 31,0 39,6 50,5 60,7 71,3 81,3 Tetrahydropyran in Wasser in Ma-% 12,90 10,03 8,57 6,88 6,04 5,16 4,62 4,50 4,29 Wasser in Tetrahydropyran in Ma-% 2,08 2,35 2,50 2,63 2,99 3,20 3,64 3,98 4,21
Verwendung
Tetrahydropyran wird gelegentlich als Lösungsmittel bei Grignard-Reaktionen verwendet. Es bildet weiterhin die Basis für viele abgeleitete Verbindungen (z. B. Tetrahydropyran-2,6-dion und Tetrahydropyran-2,4-diole).
Als Schutzgruppe
Bei organischen Synthesen wird die 2-Tetrahydropyranylgruppe als Schutzgruppe für Alkohole und Thiole benutzt. Dazu wird das Substrat mit Dihydropyran zum basenstabilen Tetrahydropyranylether umgesetzt.
Sicherheitshinweise
Bei Kontakt von Tetrahydropyran mit Luft bilden sich Peroxide und explosive Dämpfe.
Siehe auch
- Tetrahydrofuran (THF)
- Pyrane
Literatur
- Paul A. Clarke, Soraia Santos: Strategies for the Formation of Tetrahydropyran Rings in the Synthesis of Natural Products. In: European Journal of Organic Chemistry. 2006, S. 2045, doi:10.1002/ejoc.200500964.
- Voigt, Tobias: Prins-Cyclisierung an fester Phase – Kombinatorische Synthese einer Tetrahydropyran-Bibliothek. Dissertation, Universität Dortmund, 2006.
Einzelnachweise
- Eintrag zu Tetrahydropyran in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2020. (JavaScript erforderlich)
- CRC Handbook of Tables for Organic Compound Identification, Third Edition, 1984, ISBN 0-8493-0303-6.
- Theophil Eicher, Siegfried Hauptmann, Andreas Speicher: The chemistry of heterocycles : structure, reactions, synthesis and applications. 3rd, completely rev. and enlarged ed Auflage. Wiley-VCH, Weinheim 2012, ISBN 978-3-527-66987-5, S. 51 (eingeschränkte Vorschau in der Google-Buchsuche).
- Hubert Koebernick: Darstellung und konformationsanalyse von 2.4-diamino-pyranosen. 1975, OCLC 74320162, S. 18 (eingeschränkte Vorschau in der Google-Buchsuche).
- S. Rodríguez, H. Artigas, C. Lafuente, A. M. Mainar, F. M. Royo: Isobaric vapour–liquid equilibrium of binary mixtures of some cyclic ethers with chlorocyclohexane at 40.0 and 101.3 kPa, in: Thermochim. Acta, 2000, 362, S. 153–160 (doi:10.1016/S0040-6031(00)00580-3).
- J. Gmehling, J. Menke, J. Krafczyk, K. Fischer: Azeotropic Data, VCH, Weinheim 1994, ISBN 3-527-28671-3, S. 936.
- R. M. Stephenson: Mutual Solubilities: Water-Ketones, Water-Ethers, and Water-Gasoline-Alcohols in J. Chem. Eng. Data 37 (1992) 80–95, doi:10.1021/je00005a024.

