1,8-Cineol
1,8-Cineol gehört zu den bicyclischen Epoxy-Monoterpenen, genauer den Limonenoxiden. Die organische Verbindung liegt bei Raumtemperatur als farblose Flüssigkeit vor. Es findet Anwendung bei Atemwegserkrankungen wie Bronchitiden bzw. Erkältungskrankheiten der Atemwege, aber auch bei chronischen und entzündlichen Atemwegserkrankungen sowie Asthma und Heuschnupfen.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
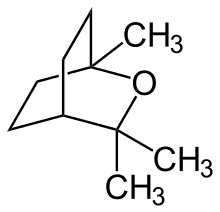 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 1,8-Cineol | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C10H18O | ||||||||||||||||||
| Kurzbeschreibung |
farblose bis gelbliche, campherartig riechende Flüssigkeit[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Arzneistoffangaben | |||||||||||||||||||
| ATC-Code |
R05CA13 | ||||||||||||||||||
| Wirkstoffklasse | |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 154,24 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte |
0,93 g·cm−3[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
174–177 °C[2] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
schlecht in Wasser (3,25 g·l−1 bei 21 °C)[2] | ||||||||||||||||||
| Brechungsindex |
1,4586 (20 °C)[4] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Vorkommen
1,8-Cineol kommt in größeren Mengen in Eukalyptus (Eukalyptusöl enthält ungefähr 85 Prozent Cineol), Arznei-Engelwurz (Angelica archangelica),[5] Rosmarin (Rosmarinus officinalis),[5] Salbei (Salvia officinalis ),[5] Thai-Ingwer (Alpinia galanga),[5], Majoran (Origanum majorana),[5] und Lorbeer vor. In geringeren Mengen ist es in Wermutkraut,[6] Minzen (Acinos suaveolens,[5] Mentha spicata[5]), Krause Minze,[7] Cannabis, Thymian (Thymus vulgaris),[5] Estragon (Artemisia dracunculus),[5] Baldrian (Valeriana officinalis),[5] Rosskastanien (Aesculus hippocastanum),[5] Kubeben-Pfeffer (Piper cubeba),[5] Muskatnuss (Myristica fragrans),[5] Basilikum (Ocimum basilicum),[5] und im Teebaum vorhanden.
 Basilikum
Basilikum.jpg.webp) Rosmarin
Rosmarin Eukalyptus
Eukalyptus Engelwurz
Engelwurz Lorbeer
Lorbeer Baldrian
Baldrian Salbei
Salbei Rosskastanie
Rosskastanie Majoran
Majoran
Biosynthese
Für die Biosynthese von 1,8-Cineol in der Pflanze ist das Dimethylallylpyrophosphat (DMAPP) als Starter notwendig, das mit dem isomeren Isopentenylpyrophosphat, das aus dem Pyruvat-Glycerinaldehydphosphat-Weg („Rohmer-Weg“) stammt, in einer Kopf-zu-Schwanz-Reaktion kondensiert.[8]
Gewinnung
Cineol kann in großen Mengen durch fraktionierte Destillation von Eukalyptusöl gewonnen werden. Bei einer Reinheit von 99,6 bis 99,8 Prozent spricht man von technischem Cineol.
Eigenschaften
1,8-Cineol riecht frisch und campherartig. Es ist mit Ether, Ethanol und Chloroform in jedem Verhältnis mischbar. Der Flammpunkt liegt bei 49 °C.[2]
Analytik
Zur zuverlässigen qualitativen und quantitativen Bestimmung des 1,8-Cineols eignet sich die Kopplung der Kapillargaschromatographie mit der Massenspektrometrie nach angemessener Probenvorbereitung des Untersuchungsmaterials.[9][10] Diese analytische Verfahrensweise eignet sich auch, um Eukalyptusöle unterschiedlicher Spezies zu unterscheiden.[11]
Verwendung
1,8-Cineol wird einerseits bei Atemwegserkrankungen des Menschen,[12] vorwiegend aber in der Veterinärmedizin verwendet. Andererseits kommt es als Aromastoff in der Parfümindustrie zum Einsatz. In der Zahnmedizin wird es bei der Revision von Wurzelfüllungen verwendet.
Pharmakologische Wirkungen
1,8-Cineol wirkt beim Menschen in der Lunge und den Nebenhöhlen schleimlösend und bakterizid. Außerdem hemmt es bestimmte Neurotransmitter, die für die Verengung der Bronchien verantwortlich sind. Bei Asthmatikern kann unter ärztlicher Kontrolle durch Gabe von reinem Cineol die Lungenfunktion verbessert werden.[13][14] Cineol stellt jedoch nur in Ausnahmefällen eine Alternative zu Corticosteroiden dar, die als Inhalation örtlich und nebenwirkungsarm angewandt werden können. Auch bei der chronisch-obstruktiven Lungenerkrankung COPD kann reines Cineol als Zusatzmedikation zur Standardtherapie unter Umständen die Lungenfunktion verbessern und auf diese Weise Exazerbationen reduzieren.[15]
Von 1,8-Cineol sind als Nebenwirkungen leichte Stuhlverflüssigung und eventuell leichte Übelkeit bekannt. Beides tritt nur bei oraler Einnahme auf. Weiterhin wurden – vor allem bei Kindern – auch allergische Reaktionen[16] beschrieben. Die Einnahme erfolgt durch orale Zufuhr von Kapseln, die sich erst im Dünndarm auflösen, durch Inhalation oder durch Zubereitung entsprechender den Wirkstoff enthaltender Pflanzen als Aufguss.
Handelsnamen
Soledum (D), Sinolpan Forte (D), Cineol (D)
GeloMyrtol (D), Rowachol (D, A), Rowatinex (D, A), Transpulmin (D)[13][17]
Weblinks
- Mehr zu Cineol: Anwendung als Heilpflanze
Einzelnachweise
- Eintrag zu EUCALYPTOL in der CosIng-Datenbank der EU-Kommission, abgerufen am 25. Februar 2020.
- Datenblatt 1,8-Cineol (PDF) bei Merck, abgerufen am 25. Mai 2011.
- Eintrag zu 1,8-Cineol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 10. Januar 2017. (JavaScript erforderlich)
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-256.
- 1,8-CINEOL (engl., PDF) In: Dr. Duke's Phytochemical and Ethnobotanical Database, Hrsg. U.S. Department of Agriculture, abgerufen am 11. Juli 2021.
- Otto Vostrowsky, Thorolf Brosche, Helmut Ihm, Robert Zintl, Karl Knobloch: Über die Komponenten des ätherischen Öls aus Artemisia absinthium L.. In: Zeitschrift für Naturforschung C. 36, 1981, S. 369–377 (PDF, freier Volltext).
- Massimo Maffei, Arnaldo Codignola, Maurizio Fieschi: Essential oil fromMentha spicata L. (spearmint) cultivated in Italy. In: Flavour and Fragrance Journal. Band 1, Nr. 3, Juni 1986, S. 105–109, doi:10.1002/ffj.2730010303.
- M. Rohmer: The discovery of a mevalonate-independent pathway for isoprenoid biosynthesis in bacteria, algae and higher plants. In: Nat Prod Rep. 16, 1999, S. 565–574.
- N. H. El-Soud, M. Deabes, L. A. El-Kassem, M. Khalil: Chemical Composition and Antifungal Activity of Ocimum basilicum L. Essential Oil. In: Open Access Maced J Med Sci. 3(3), 15. Sep 2015, S. 374–379. PMID 27275253
- A. F. Blank, L. C. Camêlo, F. Arrigoni-Blank Mde, J. B. Pinheiro, T. M. Andrade, S. Niculau Edos, P. B. Alves: Chemical Diversity in Lippia alba (Mill.) N. E. Brown Germplasm. In: ScientificWorldJournal. 2015, S. 321924. PMID 26075292
- P. C. Buenoa, M. G. Junior, J. K. Bastos: A GC-FID validated method for the quality control of Eucalyptus globulus raw material and its pharmaceutical products, and gc-ms fingerprinting of 12 Eucalyptus species. In: Nat Prod Commun. 9(12), Dez 2014, S. 1787–1790. PMID 25632486
- K. Sebei, F. Sakouhi, W. Herchi, M. L. Khouja, S. Boukhchina: Chemical composition and antibacterial activities of seven Eucalyptus species essential oils leaves. In: Biol Res. 48, 19. Jan 2015, S. 7. PMID 25654423
- Rote Liste online, Stand: Oktober 2009.
- U. R. Juergens, U. Dethlefsen, G. Steinkamp, A. Gillissen, R. Repges, H. Vetter: Anti-inflammatory activity of 1.8-cineol (eucalyptol) in bronchial asthma: a double-blind placebo-controlled trial. In: Respir Med. 97(3), Mar 2003, S. 250–256. PMID 12645832
- H. Worth u. a.: Concomitant therapy with Cineole (Eucalyptole) reduces exacerbations in COPD: A placebo-controlled double-blind trial. In: Respir Res. 10(1), 2009, S. 69.
- Peter Altmeyer, Martina Bacharach-Buhles: Springer-Enzyklopädie Dermatologie, Allergologie, Umweltmedizin. Springer 2002, ISBN 978-3-540-41361-5, S. 302. eingeschränkte Vorschau in der Google-Buchsuche.
- AGES-PharmMed, Stand: Oktober 2009.