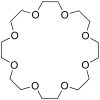
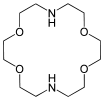
Kronenether
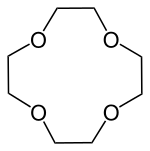
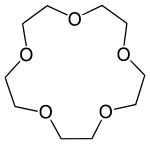
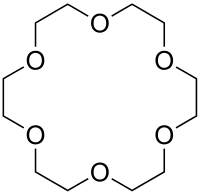
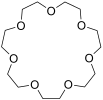
Kronenether sind cyclische Ether, deren schematischer Aufbau in der Abfolge von Ethylenoxyeinheiten (–CH2–CH2–O–) an eine Krone erinnert. Sie wurden von Charles Pedersen, einem Chemiker bei DuPont, entdeckt (Pedersen 1967). Für diese Entdeckung erhielt er 1987 zusammen mit Jean-Marie Lehn und Donald J. Cram den Nobelpreis für Chemie.
Aufbau
Kronenether mit m Ringgliedern und n Heteroatomen werden wie folgt bezeichnet: [m]Krone-n.
Die Namen zusätzlicher Substituenten werden wie im unten stehenden Fall des Dicyclohexano[18]Krone-6 als Präfixe vorangestellt. Eine präzisere IUPAC-Nomenklatur existiert, ist aber wesentlich komplexer.
Bedeutung
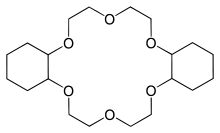
Neben dem ästhetischen Reiz der Strukturen ist deren Fähigkeit zur Komplexierung von Kationen unter Bildung sogenannter Coronate von großem Interesse. Die Komplexierung wird im Falle von Metallkationen durch die attraktive Wechselwirkung der negativ polarisierten Sauerstoffe (oder anderer Heteroatome, wie Stickstoff oder Schwefel) mit den Kationen erreicht. Im Falle von Ammoniumionen werden Wasserstoffbrücken zu den Protonen ausgebildet. Übereinstimmungen mit den Strukturen und Bindungseigenschaften von z. B. Valinomycin oder Nonactin sind frappierend. Diese Eigenschaft macht Kronenether zu einem wichtigen Bindeglied zwischen der Organischen Chemie, der Anorganischen Chemie und der Biochemie. Die Weite der Öffnung wird durch die Anzahl der Untereinheiten bestimmt. Bei guter Übereinstimmung von Innendurchmesser und Kationenradius lässt sich eine bemerkenswerte Selektivität erreichen. So bindet Dicyclohexano[18]Krone-6 Kaliumionen rund hundertmal besser als Natriumionen.
Chemische Eigenschaften
Aufgrund der ausgewogenen Hydrophilie–Hydrophobie-Balance sind Kronenether sowohl in den meisten organischen Lösemitteln als auch in Wasser löslich. Darauf beruht ihre Fähigkeit, ionische, hydrophile Verbindungen in organische Phasen zu überführen. So wird Kaliumpermanganat bei Zugabe von [18]Krone-6 in Benzol mit violetter Farbe löslich. Mit solchen und anderen Kronenether-vermittelten Reaktionen gelingen ansonsten kaum mögliche Reaktionen (Lehn 1975; Liotta 1974). Mit chiralen Kronenethern lassen sich fast 100 % Enantiomerenüberschuss bei Michael-Reaktionen erzielen (Cram 1981). Neben der Synthese sind Kronenether auch in der analytischen Chemie von Bedeutung (Kolthoff 1979). Von besonderer Bedeutung ist die Verwendung für ionenselektive Elektroden (Koryta 1980). Nachdem das Kation im Kryptat (Komplex) festgelegt wurde, steigt die Aktivität des ungebundenen Anions, welches stark nucleophil wird. Aus diesem Grund erhält man bei Zugabe von Kronenether bei der Hydrolyse von Estern mit Kalilauge stark beschleunigte Ergebnisse.[4]
Synthese
Kronenether werden durch intramolekulare Ethersynthese nach Alexander William Williamson, der so genannten Williamson'schen Ethersynthese, hergestellt.[5] Zur Unterdrückung intermolekularer Verknüpfungen ist das Arbeiten in stark verdünnter Lösung notwendig.
Kryptanden
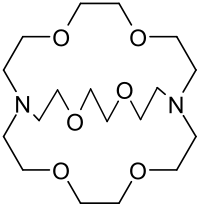
Durch Überbrückung der Öffnung erhält man sogenannte Kryptanden (so bezeichnet von Lehn, 1978), die speziell mit Alkali- und Erdalkalimetallionen noch stärkere und selektivere Komplexe (die Kryptate) bilden als unüberbrückte Kronenether.[6] Dabei dienen zwei Stickstoffatome als „Brückenköpfe“ für die aus Ethylenoxyeinheiten (–CH2–CH2–O–) aufgebauten Brücken. Für die vereinfachte Nomenklatur wird die Anzahl der Sauerstoffatome in der ersten, zweiten und dritten Brücke durch Punkte voneinander getrennt vor dem Wort „Kryptand“ in eckiger Klammer vorangestellt: im gezeigten Beispiel [2.2.2]Kryptand. Wie Kronenether sind auch Kryptanden in Wasser und vielen organischen Lösungsmitteln gut löslich.
Die Kryptandensynthese gestaltet sich wesentlich schwieriger und teurer als die normale Kronenethersynthese.
Literatur
- C. Pedersen: J. Am. Chem. Soc. 1967, 89, 7017.
- C.L. Liotta, H.P. Harris, J. Am. Chem. Soc. 1974, 96, 2250.
- D.J. Cram, Chem. Comm. 1981, 625.
- I.M. Kolthoff, Anal. Chem. 1979, 51, 1R.
- J. Koryta: Ion-Selective Electrodes. Wiley, 1980.
- J.-M. Lehn, B. Dietrich, Tetrahedron. Lett. 1973, 1225; doi:10.1016/S0040-4039(01)95803-4.
- J.-M. Lehn, Acc. Chem. Res. 1978, 11, 49; doi:10.1021/ar50122a001.
- Übersicht: Fritz Vögtle: Supramolekulare Chemie. Teubner Studienbücher, 1989, S. 39ff., ISBN 3519035022.
Weblinks
- Informationen der Nobelstiftung zur Preisverleihung 1987 an Charles Pedersen, Jean-Marie Lehn und Donald J. Cram (englisch)
Einzelnachweise
- Externe Identifikatoren von bzw. Datenbank-Links zu [21]Krone-7: CAS-Nummer: 33089-36-0, EG-Nummer: 251-373-3, ECHA-InfoCard: 100.046.689, PubChem: 93160, Wikidata: Q55176433.
- Externe Identifikatoren von bzw. Datenbank-Links zu [24]Krone-8: CAS-Nummer: 33089-37-1, EG-Nummer: 251-374-9, ECHA-InfoCard: 100.046.690, PubChem: 10893545, ChemSpider: 9068808, Wikidata: Q82934081.
- Externe Identifikatoren von bzw. Datenbank-Links zu Diaza-[18]Krone-6: CAS-Nummer: 23978-55-4, EG-Nummer: 245-965-0, ECHA-InfoCard: 100.041.772, PubChem: 72805, ChemSpider: 65641, Wikidata: Q72507855.
- Beyer, Walter; Lehrbuch der Organischen Chemie; 2004; Vol. 24, S. 324.
- Vögtle, Fritz: Supramolekulare Chemie, Stuttgart 1989, S. 336.
- Dietrich, B. "Cryptands" in Comprehensive Supramolecular Chemistry; Gokel, G. W. Ed; Elsevier: Oxford, 1996; Vol. 1, S. 153–211. ISBN 0080406106.