Soman
Soman ist ein als chemischer Kampfstoff einsetzbares Nervengift. Von den drei in Deutschland entwickelten Nervenkampfstoffen Soman, Sarin und Tabun ist Soman die giftigste und persistenteste Verbindung. Das in der NATO verwendete Kürzel für Soman ist „GD“.
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
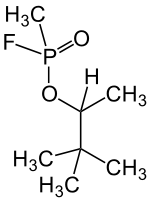 | ||||||||||
| Mischung von vier Stereoisomeren (hier dargestellt ist eine vereinfachte Strukturformel ohne Stereochemie) | ||||||||||
| Allgemeines | ||||||||||
| Name | Soman | |||||||||
| Andere Namen |
| |||||||||
| Summenformel | C7H16FO2P | |||||||||
| Kurzbeschreibung |
farblose bis gelbbraune Flüssigkeit[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 182,18 g·mol−1 | |||||||||
| Aggregatzustand |
flüssig | |||||||||
| Dichte |
1,02 g·cm−3[2] | |||||||||
| Schmelzpunkt | ||||||||||
| Siedepunkt |
167 °C[2] | |||||||||
| Dampfdruck | ||||||||||
| Löslichkeit |
wenig in Wasser (21 g·l−1 bei 20 °C)[3] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Toxikologische Daten | ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Soman ist der 1,2,2-Trimethylpropylester der Methylfluorphosphonsäure und mit Sarin verwandt. Er unterscheidet sich von Sarin dadurch, dass eine Methylgruppe (–CH3) im Sarin durch eine tert-Butylgruppe (–C(CH3)3) ersetzt wurde. Das unter Standardbedingungen flüssige und campherartig riechende Soman ist wenig in Wasser löslich[3] und stabil gegenüber Sonnenlicht; an der Luft hydrolysiert es langsam.
Geschichte
Soman wurde im Frühjahr 1944 vom nobelpreisprämierten österreichisch-deutschen Chemiker Richard Kuhn und seinem Mitarbeiter Konrad Henkel synthetisiert.[5] Bis zum Ende des Zweiten Weltkriegs wurden nur geringe Mengen für Testzwecke produziert, die anschließend in die Sowjetunion gebracht wurden.
Während des Kalten Krieges wurde Soman in der Sowjetunion in großen Mengen hergestellt. Der Kampfstoff hatte bei den sowjetischen Streitkräften die Codebezeichnung „R-55“. Wie viele andere Kampfstoffe wurde auch Soman nach Mischen mit einem organischen Polymer als verdickter Kampfstoff gelagert bzw. munitioniert; auf diese Weise sollte bei einem Einsatz die hohe Toxizität mit einer langen Sesshaftigkeit verbunden werden. Bei Raumtemperatur ist dieses verdickte Soman, das in der Sowjetunion als „VR-55“ bezeichnet wurde, von honigartiger Konsistenz. VR-55 hat eine weitaus größere Persistenz sowie eine erhöhte Giftwirkung über die Haut als unverdicktes Soman. In der Literatur findet sich fälschlicherweise auch die Bezeichnung „GV“ („V“ für engl. viscous, „zäh, viskos“) – der eigentliche Nervenkampfstoff GV beruht jedoch auf einem anderen Wirkstoff.
Schutzmaßnahmen
Nervenkampfstoffe sind bereits in kleinsten Mengen tödlich. Angriffsfläche ist der gesamte Körper. Deshalb bieten auch nur ein Ganzkörper-Schutzanzug und eine Schutzmaske mit Atemfilter ausreichenden Schutz. Vor einem Kampfstoffeinsatz können Oxim-Tabletten oder Carbamate wie Pyridostigmin oder Physostigmin eingenommen werden.[6][7] Obidoximchlorid wirkt nur innerhalb weniger Minuten nach dem Auftreten der ersten Vergiftungssymptome, da bei Soman im Vergleich zu anderen Kampfstoffen eine sehr schnelle Alterung des Enzymkomplexes auftritt. Die verspätete Verabreichung von Obidoxim kann sogar zur Verschlechterung der Symptomatik führen. Eine Monotherapie mit Atropin ist dann vorzuziehen.
Für die Dekontamination können unter anderem Oxidationsmittel (z. B. Chlorkalk oder Calciumhypochlorit), alkalische Lösungen und nichtwässrige Medien, zum Beispiel Aminoalkoholate, verwendet werden, da Nervenkampfstoffe zum einen empfindlich gegenüber Oxidationsmitteln sind und zum anderen ihre Hydrolyse im basischen Milieu beschleunigt abläuft.[3] Bei empfindlichen Oberflächen kann zum Beispiel Natriumcarbonatlösung verwendet werden, die jedoch naturgemäß langsamer wirkt.
In einem Versuch mit Ratten führte eine ketogene Diät zu einer verminderten Letalität. Nach kumulativer Verabreichung von 627 µg/kg Soman überlebten 90 % der Ratten unter einer ketogenen Diät im Vergleich zu 55 % der Ratten unter einer Standarddiät. Erstere wiesen außerdem weniger Leistungsdefizite auf und zeigten weniger Beispiele für untaugliches Verhalten im Gegensatz zu Gruppen von Ratten, denen andere Diätformen verabreicht wurden.[8]
Symptome
- Leichte Vergiftung: Kopfschmerzen, Atemnot, starke Schweißausbrüche, starke Sehstörungen verbunden mit Augenschmerzen, vermehrte Produktion von Nasensekret, Tränenflüssigkeit und Speichel.
- Mittelschwere Vergiftung: starke Kopfschmerzen, Übelkeit, Erbrechen, Durchfall, Augenschmerzen, Krämpfe mit Bewusstseinsstörungen.
- Schwere Vergiftung: Krämpfe der Skelettmuskulatur bis Krampfanfall, Erbrechen, starke Atemnot, Angstzustände, Verwirrtheit.
Der Tod tritt durch Atemlähmung ein.
Strukturformel, Stereoisomere
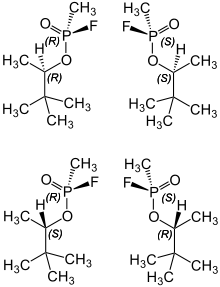
Soman enthält zwei Stereozentren, eines am Phosphoratom und eines am ersten Kohlenstoffatom des Trimethylpropylesters. Folglich gibt es vier Stereoisomere. Soman ist also ein Gemisch aus vier verschiedenen Isomeren mit unterschiedlicher physiologischer Wirkung. In der Literatur werden die Isomere üblicherweise wie folgt bezeichnet: C(+)P(+)-Soman, C(−)P(−)-Soman, C(+)P(−)-Soman und C(−)P(+)-Soman, wobei C(−) der S-Konfiguration am chiralen Kohlenstoffatom entspricht und P(−) der S-Konfiguration am Phosphoratom.
Das aus racemischem Pinakolylalkohol hergestellte C(±)P(±)-Soman ist ein Isomerengemisch, das aus den beiden Isomerenpaaren
[C(+)P(+)-Soman / C(−)P(−)-Soman] und [C(+)P(−)-Soman / C(−)P(+)-Soman] im Verhältnis 45:55 besteht (mit jeweils gleicher Menge an Enantiomeren). Die einzelnen Stereoisomere unterscheiden sich stark in ihrer Toxizität. In der Tabelle sind toxikologische Daten der einzelnen Soman-Isomere und von weiteren Nervengasen zum Vergleich angegeben.
Toxizität von Soman-Isomeren und weiteren Nervengasen:[9]
| Substanz bzw. Isomer | LD50 (Maus, µg/kg) |
|---|---|
| C(±)P(±)-Soman [PRSCRS-Soman] | 156 (s.c.) |
| C(−)P(−)-Soman [PSCS-Soman] | 38 (s.c.) |
| C(+)P(−)-Soman [PSCR-Soman] | 99 (s.c.) |
| C(−)P(+)-Soman [PRCS-Soman] | >2000 (s.c.) |
| C(+)P(+)-Soman [PRCR-Soman] | >5000 (s.c.) |
| (±)-Sarin [(RS)-Sarin] | 83 (i.v.) |
| (−)-Sarin [(S)-Sarin] | 41 (i.v.) |
| (+)-Sarin [(R)-Sarin] | nicht verfügbar |
| (±)-Tabun [(RS)-Tabun] | 208 (i.v.) |
| (−)-Tabun [(S)-Tabun] | 119 (i.v.) |
| (+)-Tabun [(R)-Tabun] | 837 (i.v.) |
| (±)-VX [(RS)-VX] | 20,1 (i.v.) |
| (−)-VX [(S)-VX] | 12,6 (i.v) |
| (+)-VX [(R)-VX] | 165 (i.v.) |
Analytik
Die zuverlässige Identifizierung von Soman gelingt durch adäquate Probenvorbereitung und anschließende Gaschromatographie in Kopplung mit der Massenspektrometrie.[10] Zum sicheren Nachweis der Exposition gegenüber Soman können sowohl Urin- als auch Blutproben verwendet werden. In der Regel werden daraus die Metaboliten wie z. B. die Alkyl-Methylphosphonsäuren mit geeigneter Probenvorbereitung isoliert und gegebenenfalls für die GC-MS-Analyse derivatisiert.[11] Zum längerfristigen Nachweis der Exposition gegenüber Soman eignet sich nach neueren Publikationen besonders die Untersuchung von Finger- oder Fußnägeln[12] und Haaren.[13]
Internationale Kontrollen
Soman wird als Chemikalie der „Liste 1“[14] im internationalen Abrüstungsvertrag CWÜ von der hierfür zuständigen UN-Behörde, der Organisation für das Verbot chemischer Waffen (OPCW) mit Sitz in Den Haag, kontrolliert. Die Herstellung oder der Besitz sind verboten; ausgenommen sind Arbeiten, die ausschließlich dem Schutz vor diesen Substanzen oder der Forschung dienen. In Deutschland muss jeder nicht-staatliche Umgang mit Soman vom Bundesamt für Wirtschaft und Ausfuhrkontrolle (BAFA) genehmigt und der OPCW gemeldet werden.[15]
Einzelnachweise
- Eintrag zu Soman. In: Römpp Online. Georg Thieme Verlag, abgerufen am 1. Juni 2014.
- Eintrag zu Soman in der GESTIS-Stoffdatenbank des IFA, abgerufen am 27. Dezember 2019. (JavaScript erforderlich)
- Charles Edward Stewart: Weapons of mass casualties and terrorism response handbook. Jones & Bartlett Learning, 2006, ISBN 0-7637-2425-4, S. 23.
- Günter Hommel: Handbuch der gefährlichen Güter. Band 6 Springer Berlin Heidelberg, 2012, ISBN 978-3-642-25051-4, S. 2283.
- Florian Schmaltz: Kampfstoff-Forschung im Nationalsozialismus: Zur Kooperation von Kaiser-Wilhelm-Instituten, Militär und Industrie. Wallstein Verlag, 2005, ISBN 3-89244-880-9, S. 490 (eingeschränkte Vorschau in der Google-Buchsuche).
- Saskia Eckert: Entwicklung eines dynamischen Modells zum Studium der Schutzeffekte reversibler Acetylcholinesterase-Hemmstoffe vor der irreversiblen Hemmung durch hochtoxische Organophosphate (PDF; 1,24 MB), Dissertation an der Universität München, 2006, S. 1.
- L. Szinicz und S. I. Baskin: Chemische und biologische Kampfstoffe. In: Lehrbuch der Toxikologie. 2. Auflage, W. V. mbH, Stuttgart 2004, ISBN 978-3-8047-1777-0, S. 865–895.
- J. L. Langston, T. M. Myers: Diet composition modifies the toxicity of repeated soman exposure in rats. Neurotoxicology, 2011, 32: 907–915, PMID 21641933.
- H. P. Benschop, L. P. A. De Jong: Nerve agent stereoisomers: analysis, isolation and toxicology. In: Acc. Chem. Res. Band 21, Nr. 10, 1988, S. 368–374, doi:10.1021/ar00154a003.
- A. K. Singh, R. J. Zeleznikar Jr, L. R. Drewes: Analysis of soman and sarin in blood utilizing a sensitive gas chromatography-mass spectrometry method.In: J. Chromatogr. 324(1), 1985, 163–172, PMID 2989304.
- D. D. Richardson, J. A. Caruso: Derivatization of organophosphorus nerve agent degradation products for gas chromatography with ICPMS and TOF-MS detection.In: Anal. Bioanal. Chem. 388(4): 2007, 809–823, PMID 17356819.
- A. S. Appel, B. A. Logue: Analysis of nerve agent metabolites from nail clippings by liquid chromatography tandem mass spectrometry. In: J. Chromatogr. B. Analyt Technol Biomed Life Sci. 1031: 2016, 116-22, PMID 27474780.
- A. S. Appel, J. H. McDonough, J. D. McMonagle, B. A. Logue: Analysis of Nerve Agent Metabolites from Hair for Long-Term Verification of Nerve Agent Exposure. In: Anal. Chem. 88(12): 2016, 6523-30, PMID 27161086.
- Bundesamt für Wirtschaft und Ausfuhrkontrolle (BAFA): Chemikalien der Liste 1, abgerufen am 5. Februar 2018.
- Bundesamt für Wirtschaft und Ausfuhrkontrolle (BAFA): Chemiewaffenübereinkommen, abgerufen am 5. Februar 2018.
