Sarin
Sarin ist ein chemischer Kampfstoff aus der Gruppe der Phosphonsäureester. Die systematische Bezeichnung lautet Methylfluorphosphonsäureisopropylester. Der Trivialname Sarin wurde 1943 eingeführt. Sarin war die zweite in einer Reihe von insgesamt vier Organophosphorverbindungen mit Potential als chemischer Kampfstoff, die in den 1930er und 1940er Jahren bei den I.G. Farben synthetisiert wurden. Die anderen waren Tabun (1936), Soman (1944) und Cyclosarin (1949).
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
-Sarin.svg.png.webp) | |||||||||||||
| 1:1-Gemisch (Racemat) der Enantiomere (hier: vereinfachte Strukturformel ohne Stereochemie) | |||||||||||||
| Allgemeines | |||||||||||||
| Name |
| ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | C4H10FO2P | ||||||||||||
| Kurzbeschreibung |
farblose bis gelbbraune, geruchlose Flüssigkeit[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 140,09 g·mol−1 | ||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||
| Dichte |
1,09 g·cm−3[1] | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Siedepunkt |
147,3 °C unter teilweiser Zersetzung[2] | ||||||||||||
| Dampfdruck | |||||||||||||
| Löslichkeit | |||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Toxikologische Daten | |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Geschichte
Von der Insektizidforschung zur Chemischen Waffe
Sarin wurde wie auch Tabun (1936) im Zuge der Insektizidforschung 1939 von einer Forschungsgruppe um den Chemiker Gerhard Schrader (I.G. Farben in Leverkusen) entdeckt.[10]
1934 bekam Gerhard Schrader den Auftrag, importunabhängige Pflanzenschutzmittel zu entwickeln. Aufgrund der bereits bekannten stark toxischen aliphatischen Fluorcarbonverbindungen (Fluorcarbonsäuren und Derivate, Fluoralkohole) zog damals das bis dahin wenig beachtete Element Fluor die Aufmerksamkeit auf sich. Ab 1934 begann die systematische Untersuchung von organischen Säurefluoriden auf ihre Eignung als Schädlingsbekämpfungsmittel (zuerst Sulfonsäurefluoride, später Fluoride organischer Phosphorsäuren). Eine der ersten untersuchten Substanzen war das bereits 1932 von Davies und Dick in England synthetisierte Methansulfonsäurefluorid. Diese hochgiftige Verbindung wurde aber bald wieder verworfen, da sie von Getreide und Lebensmitteln stark absorbiert wird und diese für längere Zeit vergiftet. Neben Methansulfonsäurefluorid wurden auch Aminosulfonsäurefluoride wie Dimethylaminosulfonsäurefluorid untersucht, das eine schwächere insektizide Wirkung besitzt.
Zur gleichen Zeit beschäftigte sich Schrader außerdem auch mit Weichmachern auf Basis organischer Phosphorverbindungen. Die synthetisierten Substanzen (Ester und Amide der Phosphorsäure) wurden zusätzlich von Hans Kükenthal auch auf eine mögliche insektizide Wirkung getestet. Zahlreiche Substanzen erwiesen sich dabei unerwartet als äußerst wirksam. Man nahm daraufhin die systematische Untersuchung organischer Phosphorverbindungen in Angriff. In Analogie zu Methansulfonsäurefluorid und den Aminosulfonsäurefluoriden wurden dabei auch Methanphosphonsäure(ester)fluoride und Aminophosphorsäure(ester)fluoride untersucht. Von den anfangs hergestellten Verbindungen erwies sich das Dimethylaminophosphorsäuredifluorid (als P-Analogon zum Dimethylaminosulfonsäurefluorid) als nur schwach insektizid wirksam. Das Dimethylaminophosphorsäureethylesterfluorid (Fluor-Tabun) zeigte dagegen eine sehr starke Wirkung. Ersatz des Fluoratoms gegen einen Cyanorest führte 1936 zum noch weitaus toxischeren Dimethylaminophosphorsäureethylestercyanid (Tabun, Trilon 83, T 83). Tabun war die erste Verbindung der sogenannten „Trilone“, das aufgrund seiner unerwartet großen Giftigkeit damals in Fachkreisen beachtliches Interesse weckte und dem Heereswaffenamt gemeldet wurde.
Als P-Analoga zum Methansulfonsäurefluorid wurden überdies auch Methanphosphonsäure(ester)fluoride hergestellt. 1938 synthetisierte Schrader unter der Versuchsnummer 113 das Methanphosphonsäureethylesterfluorid.[10] Systematische Strukturabwandlungen führten dann im Jahr 1939 zur Synthese des noch weitaus toxischeren Methanphosphonsäureisopropylesterfluorids (T 144, Trilon 144, später T 46, Trilon 46, Sarin). Sarin erwies sich als außerordentlich starkes Gift, das in seiner Warmblütertoxizität alle bis dahin hergestellten Verbindungen übertraf und 3–4 mal giftiger als Tabun war. Diese Verbindung wurde ebenfalls dem Heereswaffenamt gemeldet. Das Methanphosphonsäureisopropylesterfluorid erhielt den Decknamen Sarin, der aus Buchstaben der Namen der an der Entdeckung und großtechnischen Entwicklung beteiligten Personen gebildet wurde: Schrader, Ambros, Ritter und von der Linde (dem Leiter des „Heeresgasschutzlaboratoriums“ in der Spandauer Zitadelle, wo die Entwicklung vor sich ging). In der älteren Literatur findet sich – ohne Quellenangabe – die falsche Behauptung, anstelle des Chemikers Gerhard Ritter (Reichsamt für Wirtschaftsausbau) sei Oberst Rüdiger von der Gasschutzabteilung (Wa Prüf 9) im Heereswaffenamt einer der Namensgeber gewesen.[11] Dies wurde in der neueren Forschung korrigiert.[12]
Die systematischen Strukturabwandlungen führten 1944 zur Synthese von Methanphosphonsäurepinacolylesterfluorid (Soman), dessen Toxizität die des Sarins noch einmal um das etwa dreifache übertraf. Im Gegensatz zu Tabun und Sarin wurde Soman nicht von Gerhard Schrader, sondern von dem Nobelpreisträger Richard Kuhn und seinem Mitarbeiter Konrad Henkel entwickelt. Soman war ein Produkt der Chemiewaffenforschung; Tabun und Sarin waren keine rein militärchemischen Entwicklungen.
Der gewählte Sammelname „Trilone“ soll zur Irreführung gedient haben, da unter dieser Bezeichnung auch Textil- und Färbehilfsmittel im Handel waren. Dies waren Trilon A (auf Basis der Natriumsalze der Nitrilotriessigsäure) und Trilon B (auf Basis der Natriumsalze der Ethylendiamintetraessigsäure). Auch nach dem Krieg wurde die Forschung auf diesem Gebiet fortgesetzt. 1949 wurde Methanphosphonsäurecyclohexylesterfluorid (Cyclosarin) hergestellt.
Sarin besitzt eine hohe strukturelle Ähnlichkeit mit den Pflanzenschutzmitteln Parathion (E605) und Malathion und auch mit den Kampfstoffen Tabun, Soman und VX. Im Juli 1944 wurden 30 Tonnen Sarin in deutschen Testfabriken hergestellt; diese kamen aber nie zum Kampfeinsatz. Zwei große Anlagen für die Massenfabrikation waren am Ende des Zweiten Weltkrieges in Deutschland in Bau. Neben der Anlage in Dyhernfurth, die hauptsächlich der Tabun-Herstellung diente, wurde 1943 beschlossen, ein neues Werk in Falkenhagen zu errichten (Bunker Falkenhagen). Der Grund war, dass Sarin zwar schwieriger herzustellen war als Tabun, aber als chemische Waffe besser war (es war toxischer und volatiler).[13] Die Vorräte in der Produktionsstätte Dyhernfurth in Schlesien fielen bei Kriegsende im Jahr 1945 der Roten Armee in die Hände. Diese hatte schon 1943 durch Spionage von Sarin erfahren und synthetisierte es noch während des Krieges in Kasan unter Leitung von Alexander Arbusow.[14]
Nach dem Zweiten Weltkrieg
Während des Kalten Krieges lagerten in den Vereinigten Staaten und der Sowjetunion große Mengen an Sarin. Großbritannien gab 2003[15] zu, dass bei Experimenten mit Sarin an Menschen in ihrem Giftgaslabor in Porton Down in Wiltshire 1953 ein Soldat der Royal Air Force gestorben war.[16]
Während der Diktatur unter Augusto Pinochet produzierte der Chemiker Eugenio Berríos für den chilenischen Geheimdienst DINA Sarin, das anschließend auch gegen Oppositionelle eingesetzt wurde.[17]
Der Irak setzte 1988 möglicherweise Sarin gegen seine kurdische Minderheit ein (Giftgasangriff auf Halabdscha). Dabei starben in Halabdscha bis zu 5000 Kurden.
Bei zwei terroristischen Anschlägen der sogenannten Aum-Sekte (jap. Ōmu Shinrikyō), 1994 in Matsumoto und 1995 in Tokio, wurde ebenfalls Sarin verwendet. 20 Menschen wurden dabei getötet und mehr als 6.000 verletzt.
Im Syrischen Bürgerkrieg wurde Sarin mehrfach eingesetzt. Erstmals konnte Sarin als Todesursache bei einer am 29. April 2013 bei Sarakeb verstorbenen Frau materiell nachgewiesen werden.[18]
Sarin wurde auch am 21. August 2013 bei den Giftgasangriffen von Ghuta eingesetzt.[19] Bei einem Angriff auf Chan Schaichun wurde am 4. April 2017 gegen 6:30 Uhr ebenfalls Sarin eingesetzt, so die Organisation für das Verbot chemischer Waffen (OPCW) in ihrem Bericht von 29. Juni 2017.[20] Die Verwendung von Sarin und Chlorgas in Ltamenah am 24. und 25. März 2017 bestätigte die OPCW im Juni 2018.[21]
Eigenschaften
Reines Sarin ist eine farblose, nahezu geruchlose, relativ flüchtige Flüssigkeit. Mit Wasser ist es in jedem Verhältnis mischbar. In Wasser zersetzt sich Sarin abhängig vom pH-Wert: Bei pH 7 beträgt die Halbwertszeit der Hydrolyse des Esters etwa 100 bis 150 Stunden; in saurer Lösung erfolgt die Zersetzung derselben Menge schon in zwei, in alkalischer Lösung in einer Stunde.[22] Technisches Sarin kann teilweise durch Verunreinigungen gelblich bis bräunlich gefärbt sein und einen schwach fruchtartigen Geruch aufweisen. In hochreiner Form ist es dagegen fast geruchlos. Je nach Reinheit wird der Geruch als schwacher typischer „Estergeruch“ beschrieben, der an stark verdünnten Essigsäureethylester erinnern soll. In Testreihen konnte es geruchlich ab Konzentration im Bereich von etwa 1,5 mg/m3 wahrgenommen werden, wobei der Geruch in dieser Konzentration von den Testpersonen jedoch nicht definiert werden konnte. Die Testpersonen gaben außerdem an, dass eine geruchliche Wiedererkennung unwahrscheinlich ist. Zum Vergleich: Soman soll bei gleicher Konzentration einen stärkeren Geruch besitzen, der individuell als kampferartig, muffig-dumpf, würzig oder auch fruchtig beschrieben wurde.
Toxizität
In zahlreichen Humanstudien mit subletalen Dosen Sarin wurde dessen Wirkung auf Menschen unter den verschiedensten Bedingungen detailliert untersucht. Unfälle beim Umgang mit Sarin zeigten, dass insbesondere das Einatmen von hohen Sarinkonzentrationen außerordentlich gefährlich ist und innerhalb von wenigen Sekunden zu Bewusstlosigkeit und Krämpfen führen kann, denen bereits ein bis zwei Minuten später Atemstillstand folgt. Bei geringeren Konzentrationen entwickeln sich Vergiftungssymptome dagegen deutlich langsamer.
Bei oraler Applikation führt eine Menge von 0,022 mg/kg (1,65 mg bei einer 75 kg schweren Person) zu milden Vergiftungssymptomen, bei einer Menge von 0,028 mg/kg (2,1 mg bei einer 75 kg schweren Person) sind die Vergiftungssymptome moderat. Die tödliche Dosis Sarin bei oraler Applikation wurde mit Hilfe der erhaltenen Ergebnisse auf 0,14 mg/kg (10,5 mg bei einer 75 kg schweren Person) extrapoliert.[23] Damit ist Sarin etwa 15 mal giftiger als DFP.
Erste Symptome treten 20–60 Minuten (im Durchschnitt 40 Minuten) nach der oralen Applikation auf. Bei geringeren Mengen Sarin (maximal bis etwa 1,6 mg) halten die milden Symptome von 10 Minuten bis zu 6 Stunden an (durchschnittlich etwa 1 Stunde). Die durch größere Mengen Sarin hervorgerufenen moderaten Symptome klingen erst im Zeitverlauf von 5–24 Stunden ab. Bei intravenöser Applikation treten die Vergiftungssymptome bereits im Verlauf von 1–2 Minuten auf.
Wirkungsweise
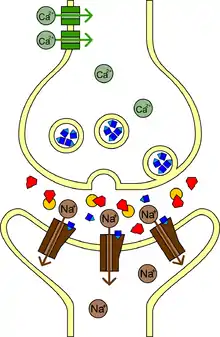
Sarin, Acetylcholinesterase, Acetylcholin
Nervenkampfstoffe wie Sarin sind bereits in sehr kleinen Mengen tödlich. Angriffsfläche ist dabei der gesamte Körper, wobei die Aufnahme insbesondere über die Augen, Haut und Atmungsorgane erfolgt; Letztere machen hierbei den Hauptanteil aus, da Sarin leicht flüchtig ist. Schutz gegen das Eindringen von Sarin in den Körper bietet daher nur ein Ganzkörper-Schutzanzug mit Atemschutzmaske.
Die Giftwirkung des Sarins beruht auf einem Eingriff in die Erregungsübertragung der Nervenbahnen: eine Erregung wird zwischen zwei Nervenzellen durch einen Neurotransmitter übertragen, der über den synaptischen Spalt von der „Senderzelle“ (Präsynaptische Endigung) zu den Rezeptoren der „Empfängerzelle“ (Postsynaptische Region) gelangt und damit die Erregung an letztere weiterleitet. Häufig handelt es sich bei dem Neurotransmitter um Acetylcholin. Unmittelbar nach seiner Freisetzung in den synaptischen Spalt wird das Acetylcholin durch das Enzym Acetylcholinesterase zersetzt, womit die Erregung beendet wird und die Empfängerzelle für die nächste Erregungsübertragung zur Verfügung steht.
Sarin blockiert die Acetylcholinesterase in allen Synapsen des parasympathischen vegetativen Nervensystems, in den acetylcholinvermittelten Synapsen des Sympathikus sowie an den neuromuskulären bzw. motorischen Endplatten. Dadurch steigt der Acetylcholinspiegel im synaptischen Spalt und es kommt zu einer Dauererregung aller betroffenen Nervensysteme.
Je nach Stärke der Vergiftung kommt es dabei zu folgenden Symptomen: Nasenlaufen, Sehstörungen, Pupillenverengung, Augenschmerzen, Atemnot, Speichelfluss, Muskelzucken, Krämpfe, Schweißausbrüche, Erbrechen, unkontrollierbarer Stuhlabgang, Bewusstlosigkeit, zentrale und periphere Atemlähmung und Tod. Die Wirkung am Auge tritt dabei schon bei geringeren Konzentrationen ein als die Wirkung im Atemtrakt, so dass Akkommodationsstörungen und eine Engstellung der Pupillen bereits bei Konzentrationen und Expositionszeiten zu beobachten sind, bei denen die übrigen Vergiftungszeichen noch nicht bemerkbar sind.
Da sich das Sarin wie auch andere Cholinesteraseinhibitoren nicht oder nur sehr langsam wieder von dem blockierten Enzym lösen lässt, ist die Behandlung von Vergiftungen mit derartigen Kampfstoffen außerordentlich schwierig.
Ähnliche Wirkungen wie die des Sarins zeigen sich auch bei den chemisch verwandten Kampfstoffen Tabun, Soman und VX sowie bei Vergiftungen mit verschiedenen Insektiziden wie Parathion (E605), wobei Sarin etwa 1000-fach wirksamer und damit toxischer ist als E605.[24] Der britische Kampfstoffforscher Saunders wies seinerzeit darauf hin, dass die Abspaltung des Fluoratoms zur Abnahme der Toxizität von Sarin führt. Nach Saunders ist die dehydrofluorierte Isopropylmethylphosphonsäure (IMPA) eine „nichttoxische Säure“.[25] Dies unterstreichen auch Analysen der bekannten Sarin-Abbauprodukte IMPA, Methylphosphonsäure (MPA), Diisopropylmethylphosphonsäure (DIMP), Fluorid und Methylphosphonyldifluorid. IMPA, MPA und DIMP weisen in Kurz- und Langzeitstudien eine geringe Toxizität auf.[26]
Schutzmaßnahmen und Dekontamination
Zu allgemeinen Schutzmaßnahmen, Anzeichen des Einsatzes chemischer Kampfmittel wie unter anderem auch einer Sarin-Exposition sowie zur Dekontamination liegen umfangreiche frei zugängliche Informationen vor.[27]
Vor einem Kampfstoffeinsatz können Oxim-Tabletten oder Carbamate wie Pyridostigmin oder Physostigmin eingenommen werden.[24][28] Bei einer Vergiftung spritzt man Atropin (vergl. Hyoscyamin, Gift der Tollkirsche), ein Parasympatholytikum, das die Wirkung des Überangebotes von Acetylcholin an den Rezeptoren aufheben soll. Im Verlauf der wochenlangen Nachbehandlung kann man versuchen, mit einem Oxim die Acetylcholinesterase zu regenerieren. Im deutschsprachigen Raum wird Obidoxim bevorzugt, im anglo-amerikanischen Sprachraum wählt man eher Pralidoxim.
Für die Dekontamination können – da Nervenkampfstoffe zum einen empfindlich gegenüber Oxidationsmitteln sind, zum anderen im basischen Milieu leicht hydrolysiert werden – sowohl Oxidationsmittel wie Chlorkalk oder Calciumhypochlorit verwendet werden, als auch alkalische Lösungen, aber auch nichtwässrige Medien wie zum Beispiel Ethanolamin.[29] Bei empfindlichen Oberflächen kann man auch Natriumcarbonatlösung einsetzen, die jedoch naturgemäß langsamer wirkt.
Eine weitere Möglichkeit zur Dekontamination besteht in der Verwendung geeigneter Enzyme, die eine schnelle Hydrolyse dieses und anderer Kampfstoffe der G-Reihe herbeiführen. Eines dieser Enzyme ist DFPase (Diisopropylfluorphosphatase, EC 3.1.8.2),[30] ein Enzym des Gemeinen Kalmars Loligo vulgaris. Der natürliche Nutzen des Enzyms ist bislang unbekannt. So sind 105 µg Sarin innerhalb von 20 Minuten in situ vollständig hydrolysiert.
Struktur und Herstellung
Sarin besitzt ein Stereozentrum am Phosphoratom, es gibt also zwei Enantiomere, eines hat (R)-Konfiguration, das andere ist (S)-konfiguriert. Die hier beschriebenen Herstellungsverfahren liefern ein racemisches Sarin, also ein 1:1-Gemisch aus dem (R)-Methylfluorphosphonsäure-isopropylester und dem (S)-Methylfluorphosphonsäure-isopropylester.
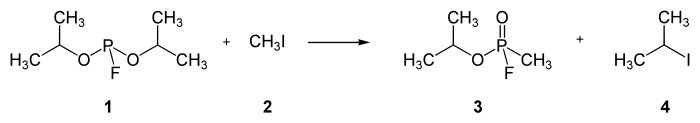
Durch Einwirken von Methyliodid (2) wird aus dem Phosphorigsäureester (1) (Diisopropylfluorphosphit) in einer Phosphonatsynthese der Methylfluorphosphonsäure-isopropylester Sarin (3) (+ 2-Iodpropan (4)) hergestellt:
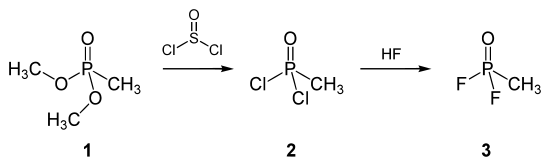
Die amerikanische Methode, Sarin herzustellen, beruht auf der Verwendung von Dimethylmethylphosphonat (1). Dieses wird mit Thionylchlorid zu Methylphosphonsäuredichlorid (2) umgesetzt, welches nach Fluorierung mittels Flusssäure zu Methylphosphonsäuredifluorid (3) reagiert:
Das Methylphosphonsäuredifluorid kann schließlich durch Hinzufügen von Isopropanol zu Sarin umgesetzt werden:
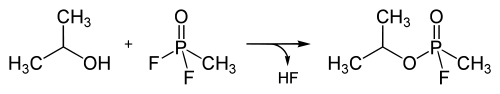
Beim Einsatz in Binärkampfstoff-Geschossen wird die obige letzte Reaktion genutzt, indem Methylphosphonsäuredifluorid und Isopropanol nach dem Abschuss der Granaten – unter Zuhilfenahme eines Reaktionsbeschleunigers – zu Sarin reagieren; dabei bildet sich nach 10 Sekunden mit 70 % Ausbeute das Endprodukt.[31]
Stereochemie
-Sarin.svg.png.webp)
-Sarin.svg.png.webp)
Die optischen Isomere von Sarin wurden ausgehend von enantiomerenreinem O-Isopropyl-methylphosphonthiolsäure-Natriumsalz [ MeP(O)(SNa)(OiPr) ] und Picrylfluorid (2,4,6-Trinitrofluorbenzen) in Methylacetat (Aceton als Lösungsmittel ist weniger günstig, da sich hier geringe, destillativ schwer abtrennbare Mengen Diacetonalkohol bilden) erhalten.[32] Optisch aktives Sarin ist in reiner Form instabil und racemisiert bei Raumtemperatur innerhalb von 20 Stunden vollständig. Fluoridionen (z. B. in Form von Ammoniumfluorid) katalysieren die Racemisierung sehr stark. Auch in wässriger gepufferter Lösung (pH 4,5) erfolgt schnelle Racemisierung. Dagegen sind verdünnte Lösungen von Sarin (0,1–0,14 mol/l) in trockenem Isopropanol, Aceton oder Methylacetat über mehrere Wochen stabil.[32]
Die optischen Isomere unterscheiden sich stark in ihrer Toxizität. Das hauptsächlich wirksame Enantiomer ist (−)-Sarin, das rund zweimal toxischer als (±)-Sarin ist, während (+)-Sarin schnell enzymatisch durch die Sarinase abgebaut wird. In der Tabelle sind die toxikologischen Daten der beiden Enantiomeren [(S)-Sarin sowie (R)-Sarin] sowie des Racemats [1:1-Gemisch aus (S)-Sarin und (R)-Sarin] angegeben und zum Vergleich dazu entsprechende Werte von Tabun und VX unter analogen Bedingungen.
Toxizität von Sarin, Tabun und VX bei Mäusen unter intravenöser Applikation:[33]
| Substanz bzw. Isomer | LD50 (Maus, µg/kg, i.v.) |
|---|---|
| (±)-Sarin [(RS)-Sarin] | 83 |
| (−)-Sarin [(S)-Sarin] | 41 |
| (+)-Sarin [(R)-Sarin] | nicht verfügbar |
| (±)-Tabun [(RS)-Tabun] | 208 |
| (−)-Tabun [(S)-Tabun] | 119 |
| (+)-Tabun [(R)-Tabun] | 837 |
| (±)-VX [(RS)-VX] | 20,1 |
| (−)-VX [(S)-VX] | 12,6 |
| (+)-VX [(R)-VX] | 165 |
Cyano-Sarin (Methanphosphonsäureisopropylestercyanid)
Im Gegensatz zu den Amidophosphorsäureesterfluoriden, z. B. Fluor-Tabun (Dimethylaminophosphorsäureethylesterfluorid), bei dem formal ein Austausch des Fluor-Atoms gegen einen Cyano-Rest zu Tabun führt und die Toxizität auf das etwa 3-4 fache steigt, ist bei Methanphosphonsäureesterfluoriden vom Typ Sarin ein entgegengesetzter Effekt zu beobachten: Methanphosphonsäureisopropylestercyanid (Cyano-Sarin, Methylcyanphosphonsäureisopropylester) hat eine signifikant geringere Toxizität als Sarin. So umfangreiche Sicherheitsvorkehrungen wie beim Umgang mit Sarin sind bei Cyano-Sarin nicht mehr notwendig.[34] Ursache für die geringere Toxizität dürfte unter anderem die zu hohe Reaktivität sein (bei AChE-Hemmern gibt es einen Zusammenhang zwischen Toxizität und Reaktivität). Während Tabun relativ stabil gegenüber Hydrolyse ist, ist die P-CN-Bindung bei Methanphosphonsäurealkylestercyaniden labil, in Wasser kommt es sehr schnell zur Hydrolyse unter Bildung von Methanphosphonsäureisopropylester und Cyanwasserstoff. Eine akut toxische Wirkung von größeren Mengen Cyano-Sarin dürfte damit vermutlich eher auf die gebildete Blausäure zurückzuführen sein.
Bei Estern vom Typ DFP (Diisopropylfluorphosphat) sind die Cyanide ebenfalls relativ ungiftig, die Azide hingegen wie auch die Fluoride potente Cholinesterasehemmer.
Analytik
Die zuverlässige Identifizierung der Substanz gelingt durch geeignete Probenvorbereitung und anschließende Gaschromatographie bzw. Hochleistungsflüssigkeitschromatographie in Kopplung mit der Massenspektrometrie.[35] Zum sicheren Nachweis der Exposition gegenüber Sarin können sowohl Urin- als auch Blutproben verwendet werden.[36] In der Regel werden daraus die Metaboliten wie z. B. die Alkyl-Methylphosphonsäuren mit adäquater Probenvorbereitung isoliert und gegebenenfalls für die GC-MS-Analyse derivatisiert.[37][38]
Vernichtung
Die sichere und zuverlässige Vernichtung von chemischen Kampfstoffen wie Sarin und ähnlichen ist an teure und aufwendige Verfahren gebunden. Die wesentlichen Methoden wenden hydrolytische und/oder katalytische Verfahren, meist bei hohen Temperaturen und unter dem Einsatz starker Oxidationsmittel wie z. B. Wasserstoffperoxid an.[39][40]
Internationale Kontrollen
Sarin wird als Chemikalie der Liste 1[41] im internationalen Abrüstungsvertrag CWÜ von der hierfür zuständigen Behörde, der Organisation für das Verbot chemischer Waffen (OPCW) mit Sitz in Den Haag, kontrolliert. Die Herstellung oder der Besitz sind verboten; ausgenommen sind Arbeiten, die ausschließlich dem Schutz vor diesen Substanzen oder der Forschung dienen. In Deutschland muss jeder nicht-staatliche Umgang mit Sarin vom Bundesamt für Wirtschaft und Ausfuhrkontrolle (BAFA) genehmigt und der OPCW gemeldet werden.[42]
Siehe auch
Weblinks
- Factsheet Sarin (LABOR SPIEZ) (PDF; 65 kB)
Einzelnachweise
- Eintrag zu Sarin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 27. Dezember 2019. (JavaScript erforderlich)
- Brockhaus ABC Chemie, VEB F. A. Brockhaus Verlag Leipzig 1965, S. 1230.
- S. Franke: Entwicklung der chemischen Kriegführung, Chemie der Kampfstoffe. 2. Auflage. Militärverlag der DDR, Berlin 1977 (Lehrbuch der Militärchemie. Band 1).
- G. Hommel: Handbuch der gefährlichen Güter. Transport- und Gefahrenklassen. Band 6 Springer, Berlin Heidelberg 2012, ISBN 978-3-642-25051-4 (Merkblatt 2282 und 2002).
- Eintrag zu Sarin in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM)
- R. H. Rengstorff: Accidental exposure to sarin: vision effects. In: Archives of Toxicology. 56, Nr. 3, 1985, S. 201–203 (doi:10.1007/BF00333427).
- Science Journal. Vol. 155, Issue 3760, 1967, S. 299–303, doi:10.1126/science.155.3760.299.
- Das Deutsche Gesundheitswesen. Vol. 15, 1960, S. 2179.
- British Journal of Pharmacology. Vol. 39(4), 1970, S. 822, doi:10.1111/j.1476-5381.1970.tb09909.x.
- K. Lohs: Synthetische Gifte. Vierte, überarbeitete und ergänzte Auflage. Militärverlag der Deutschen Demokratischen Republik, Leipzig 1974.
- R. Harris, J. Paxman: Eine höhere Form des Tötens. Die geheime Geschichte der B- und C-Waffen. Econ, Düsseldorf 1983, ISBN 978-3-430-14052-2, S. 75.
- Zutreffend ist dagegen die Benennung nach G. Ritter, einem im Reichsamt für Wirtschaftsausbau für die Chemiewaffenproduktion im Rahmen des Vierjahresplans zuständigen Chemikers. Vergl. dazu den Bericht von G. Schrader: Entwicklungsgeschichte neuer Insecticide. Teil 2: Organische Phosphorsäure-Verbindungen. 30. Oktober 1945, Bl. 21, National Archives Washington, RG 319, Entry IRR, Box 200, zit. in: F. Schmaltz: Kampfstoff-Forschung im Nationalsozialismus. Zur Kooperation von Kaiser-Wilhelm-Instituten, Militär und Industrie. Göttingen 2005, S. 448. Zu den wechselnden Tarnbezeichnungen siehe ebd.
- S. Everts: The Nazi origins of deadly nerve gases. In: Chemical and Engineering News 17. Oktober 2016.
- H. Sietz: Chemiewaffe Sarin, eine deutsche Erfindung. In: Zeit Online. 27. Juni 2013.
- A. Barnett: Final agony of RAF volunteer killed by sarin - in Britain, In: theguardian.com, 28. September 2003.
- C. Seidler: Giftgas Sarin. Tödlicher Dauerstress. In: Spiegel Online. 26. April 2013.
- SRF: 37 Jahre nach dem Putsch in Chile: Militärs verurteilt. 11. September 2010.
- H. John, M. J. van der Schans, M. Koller, H. E. T. Spruit, F. Worek, F. Thiermann, D. Noort: Fatal sarin poisoning in Syria 2013: forensic verification within an international laboratory network, Forensic Toxicology, Band 36, 2018, S. 61–71, doi:10.1007/s11419-017-0376-7
- R. Gladstone, N. Cumming-Bruce: U.N. Report Confirms Rockets Loaded With Sarin in Aug. 21 Attack. In: The New York Times. 16. September 2013.
- Report of the OPCW Fact--Finding Mission in Syria regarding an alleged Incident in Khan Shaykhun, Sryian Arab Repbulic. (PDF) 27. Juni 2017, abgerufen am 27. Juni 2017.
- Organisation für das Verbot chemischer Waffen: OPCW Confirms Use of Sarin and Chlorine in Ltamenah, Syria, on 24 and 25 March 2017. 13. Juni 2018, abgerufen am 12. März 2019.
- Bundesamt für Bevölkerungsschutz Labor Spiez: Sarin. (PDF; 51 kB), abgerufen am 4. Februar 2017.
- David Grob, John C. Harvey: Effects in man of the anticholinesterase compound Sarin (Isopropyl methyl phosphonofluoridat). In: J. Clin. Invest. 1958, 37, 350–368
- S. Eckert: Entwicklung eines dynamischen Modells zum Studium der Schutzeffekte reversibler Acetylcholinesterase-Hemmstoffe vor der irreversiblen Hemmung durch hochtoxische Organophosphate. (PDF; 1,3 MB) Dissertation. Universität München, 2006, S. 2.
- B. C. Saunders (Hrsg.): Some aspects of the chemistry and toxic action of organic compounds containing phosphorus and fluorine. Cambridge University Press, Cambridge 1957, S. 93.
- K. K. Kroening, R. N. Easter, D. D. Richardson, St. A. Willison, J. A. Caruso: Analysis of Chemical Warfare Degradation Products, Kapitel 2, Toxicity of Chemical Warfare Agents and their Degradation Products, Wiley-Blackwell, 2011, S. 19–57
- K. L. Koenig: Preparedness for terrorism: managing nuclear, biological and chemical threats. In: Ann. Acad. Med. Singapore. 38(12), 2009, S. 1026–1030. PMID 20052435.
- L. Szinicz, S. I. Baskin: Chemische und biologische Kampfstoffe. In: Lehrbuch der Toxikologie. 2. Auflage, W. V., Stuttgart 2004, ISBN 978-3-8047-1777-0, S. 865–895.
- Vergl. Verbesserte Entgiftungslösung EP 1802377 B1. zuletzt abgerufen 25. April 2013.
- A. Richardt, M. Blum, St. Mitchell: Was wissen Calamari über Sarin? Enzymatische Dekontamination von Nervenkampfstoffen. In: Chemie in unserer Zeit. 40, Nr. 4, 2006, S. 252–259 (doi:10.1002/ciuz.200600364).
- Eintrag zu Sarin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 9. September 2013.
- H. L. Boter, A. J. J. Ooms, G. R. Van DenBerg, C. Van Dijk: The synthesis of optically active isopropylmethylphosphonofluoridate (sarin). In: Recueil des Travaux Chimiques des Pays-Bas. Band 85, 1966, S. 147–150.
- H. P. Benschop, L. P. A. De Jong: Nerve agent stereoisomers: analysis, isolation and toxicology. In: Acc. Chem. Res. Band 21, Nr. 10, 1988, S. 368–374, doi:10.1021/ar00154a003.
- Christopher M. Timperley: Best Synthetic Methods: Organophosphorus (V) Chemistry. 1st Edition Auflage. Elsevier Ltd., 215, ISBN 978-0-08-098212-0.
- G. L. Hook, C. Jackson Lepage, S. I. Miller, P. A. Smith: Dynamic solid phase microextraction for sampling of airborne sarin with gas chromatography-mass spectrometry for rapid field detection and quantification. In: J Sep Sci. 27(12), August 2004, S. 1017–1022, PMID 15352721.
- Shaner RL, Coleman RM, Schulze N, Platanitis K, Brown AA, Seymour C, Kaplan P, Perez J, Hamelin EI, Johnson RC: Investigation of dried blood sampling with liquid chromatography tandem mass spectrometry to confirm human exposure to nerve agents., Anal Chim Acta. 2018 Nov 29;1033:100-107, PMID 30172315
- W. J. Driskell, M. Shih, L. L. Needham, D. B. Barr: Quantitation of organophosphorus nerve agent metabolites in human urine using isotope dilution gas chromatography-tandem mass spectrometry. In: J Anal Toxicol. 26(1), Januar-Februar 2002, S. 6–10, PMID 11888020.
- M. Nagao, T. Takatori, Y. Matsuda, M. Nakajima, H. Iwase, K. Iwadate: Definitive evidence for the acute sarin poisoning diagnosis in the Tokyo subway. In: Toxicol Appl Pharmacol. 144(1), Mai 1997, S. 198–203, PMID 9169085.
- B. Veriansyah, E. S. Song, J. D. Kim: Destruction of methylphosphonic acid in a supercritical water oxidation bench-scale double wall reactor. In: J Environ Sci (China). 23(4), 2011, S. 545–552. PMID 21793394.
- E. Gershonov, I. Columbus, Y. Zafrani: Facile hydrolysis-based chemical destruction of the warfare agents VX, GB, and HD by alumina-supported fluoride reagents. In: J Org Chem. 74(1), 2. Januar 2009, S. 329–338. PMID 19053582.
- Bundesamt für Wirtschaft und Ausfuhrkontrolle (BAFA): Chemikalien der Liste 1, abgerufen am 4. September 2013.
- Bundesamt für Wirtschaft und Ausfuhrkontrolle (BAFA): Chemiewaffenübereinkommen, abgerufen am 4. September 2013.
