Essigsäureisobutylester
Essigsäureisobutylester (nach IUPAC-Nomenklatur: 2-Methylpropylacetat, oft auch als Isobutylacetat bezeichnet) ist eine organisch-chemische Verbindung aus der Stoffgruppe der Carbonsäureester. Er dient neben dem isomeren Essigsäure-n-butylester als ausgezeichnetes Lösungsmittel für Beschichtungsstoffe, Druckfarben, Lacke sowie zahlreiche Kunststoffe und Harze.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Essigsäureisobutylester | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C6H12O2 | ||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit fruchtigem Geruch[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 116,16 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte |
0,87 g·cm−3 (20 °C)[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
118 °C[2] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Brechungsindex |
1,3902 (20 °C)[4] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK | |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Vorkommen
Essigsäureisobutylester ist ein Fruchtester, der auch in der Banane enthalten ist.[6] Allerdings ist er nur eine von vielen Nuancen, die den typischen Bananengeschmack ausmachen.
 Bananen
Bananen
Gewinnung und Darstellung
Essigsäureisobutylester wird großtechnisch durch säurekatalysierte Veresterung von Essigsäure mit Isobutanol bei Temperaturen von 110–120 °C in Reaktionskolonnen hergestellt.[7]
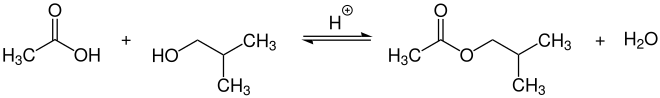
Als Katalysatoren eignen sich neben Mineralsäuren wie Schwefelsäure, auch saure Ionentauscherharze oder Zeolithe.[7] Im Labormaßstab wird als Katalysator meist p-Toluolsulfonsäure verwendet.[8]
Eigenschaften
Physikalische Eigenschaften
Essigsäureisobutylester hat eine relative Gasdichte von 4,01 (Dichteverhältnis zu trockener Luft bei gleicher Temperatur und gleichem Druck) und eine relative Dichte des Dampf-Luft-Gemisches von 1,06 (Dichteverhältnis zu trockener Luft bei 20 °C und Normaldruck). Außerdem weist Isobutylacetat einen Dampfdruck von 19,9 hPa bei 20 °C, 33,9 hPa bei 30 °C, 55,4 hPa bei 40 °C und 87,7 hPa bei 50 °C auf. Die Verdunstungszahl beträgt 7,2.[2] Mit Wasser bildet die Verbindung ein bei 87,4 °C azeotrop siedendes Gemisch.[9] Die Mischbarkeit mit Wasser ist nur gering. In Wasser lösen sich bei 20 °C nur 0,67 Ma% Ester bzw. im Ester lösen sich bei 20 °C nur 1,65 Ma% Wasser.[10]
Thermodynamische Eigenschaften
Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 4,53676, B = 1625,875 und C = −32,494 im Temperaturbereich von 2529 bis 391 K[11]
Zusammenstellung der wichtigsten thermodynamischen Eigenschaften Eigenschaft Typ Wert [Einheit] Bemerkungen Verbrennungsenthalpie ΔcH0liquid −3534 kJ·mol−1[12] Wärmekapazität cp 240,2 J·mol−1·K−1 (17 °C)[13] als Flüssigkeit Kritische Temperatur Tc 561,5 K[14] Kritischer Druck pc 31,8 bar[14] Verdampfungsenthalpie ΔVH0 35,9 kJ·mol−1[15] beim Normaldrucksiedepunkt
Chemische Eigenschaften
Essigsäureisobutylester ist eine leicht entzündbare Flüssigkeit aus der Stoffgruppe der Carbonsäureester. In Wasser ist der Ester schwer löslich, in den gebräuchlichen organischen Lösungsmitteln jedoch gut. Außerdem ist die Flüssigkeit leicht flüchtig. Mit starken Oxidationsmitteln können explosive Reaktionen eintreten. Mit Alkalihydroxide oder Kalium-tert-butoxid reagiert Isobutylacetat ebenfalls heftig.[2]
Verwendung
Essigsäureisobutylester wird als hervorragendes Lösungsmittel für Beschichtungsstoffe, Druckfarben und Lacke eingesetzt. Des Weiteren ist Isobutylacetat ein sehr gutes Lösemittel für Cellulosenitrat, Kolophonium und einige andere Naturharze, Polystyrol, Polyvinylacetate, Polyvinylether, Polyacrylsäureester und einige Copolymerisate des Vinylchlorids. Außerdem löst es modifizierte Phenolharze, Harnstoff- und Melamin-Harze, Keton- und Epoxidharze, ferner auch Fette und Öle. Nachchloriertes Polyvinylchlorid und Vinylacetat, Vinylchlorid, Dicarbonsäure-Copolymerisate sind etwas schwerer löslich, ebenso Chlorkautschuk. Naturkautschuk, Celluloseether und Polyvinylbutyrale werden nur gequollen. Praktisch unlöslich sind u. a. Schellack, Celluloseacetat, Celluloseacetobutyrat, Polyvinylformal, Polyvinylcarbazol und Wachse. Ganz besonders gut eingesetzt werden kann Isobutylacetat als Lösungsmittel für Nitrolacke, um die Viskosität herabzusetzen und die Verschneidfähigkeit zu erhöhen. Im Handel wird Isobutylacetat meist als Lösungsmittel-Gemisch mit 85 % Isobutylacetat und 15 % Isobutanol vertrieben.[3] Isobutylacetat wird ebenso als Duftstoff eingesetzt und hat einen durchdringenden Geruch nach Ananas und Banane.[10]
Sicherheitshinweise
Die Dämpfe von Isobutylacetat können mit Luft explosive Gemische bilden. Der Stoff wird hauptsächlich über den Atemtrakt und die Haut aufgenommen. Bei Aufnahme oder Exposition kommt es akut zu Reizungen der Augen und Atemwege. Bei höherer Konzentration kann eine Störung des Zentralnervensystems eintreten. Chronisch Folgen können Reizwirkungen auf Schleimhäute und Hautveränderungen sein. Eine Reproduktionstoxizität und Mutagenität konnte jedoch ausgeschlossen werden. Zur Kanzerogenität liegen keine ausreichenden Angaben vor. Isobutylacetat weist eine untere Explosionsgrenze (UEG) von ca. 1,25 Vol.-% (60 g/cm3) und eine obere Explosionsgrenze (OEG) von ca. 10,5 Vol.-% (510 g/cm3) auf. Der untere Explosionspunkt liegt bei 15 °C. Die Zündtemperatur beträgt 420 °C. Der Stoff fällt somit in die Temperaturklasse T2 und in die Explosionsgruppe IIA. Mit einem Flammpunkt von 18 °C gilt Isobutylacetat als leicht entflammbar.[2]
Weblinks
Einzelnachweise
- Eintrag zu ISOBUTYL ACETATE in der CosIng-Datenbank der EU-Kommission, abgerufen am 24. Oktober 2021.
- Eintrag zu Isobutylacetat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 11. Juli 2019. (JavaScript erforderlich)
- Eintrag zu Butylacetate. In: Römpp Online. Georg Thieme Verlag, abgerufen am 11. Juli 2019.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-308.
- Eintrag zu Isobutyl acetate im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 11. Juli 2019. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- R. Tressl, F. Drawert, W. Heimann, R. Emberger: Notizen: Gasehromatographische Bestandsaufnahme von Bananen-Aromastoffen. In: Zeitschrift für Naturforschung B. 24, 1969, S. 781–783 (online).
- Patent DE69907653T2: Verfahren und Einrichtung zum Herstellen von Butylacetat und Isobutylacetat. Angemeldet am 11. März 1999, veröffentlicht am 4. Oktober 2007, Anmelder: Sulzer Chemtech AG, Erfinder: Jaromir Lederer, Jiri Kolena, Jiri Hanika, Pavel Moravek, Quido Smejkal, Vladimir Macek, Wiekert Willem Levering, Oliver Bailer.
- Klaus Schwetlick u. a.: Organikum. 24. Auflage. Wiley-VCH, Weinheim 2015, ISBN 978-3-527-33968-6.
- H. Cheung, R. S. Tanke, G. P. Torrence: Acetic Acid. In: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH Verlag, Weinheim 2005, doi:10.1002/14356007.a01_045.
- D. Stoye: Solvents. In: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH Verlag, Weinheim 2005, doi:10.1002/14356007.a24_437
- D. R. Stull: Vapor Pressure of Pure Substances Organic Compounds. In: Ind. Eng. Chem. 39, 1947, S. 517–540.
- E. Schjanberg: Die Verbrennungswarmen und die Refraktionsdaten einiger chlorsubstituierter Fettsauren und Ester. In: Z. Phys. Chem. Abt. A. 172, 1935, S. 197–233.
- N. S. Kurnakov, N. K. Voskresenskaya: Calorimetry of liquid binary systems. In: Izv. Akad. Nauk SSSR, Otdel. Mat. i Estestv. Nauk. Ser. Khim. 1936, S. 439–461.
- A. Nadezhdin In: Rep. Phys. 23, 1887, S. 708.
- J. H. Mathews: The accurate measurement of heats of vaporization of liquids. In: J. Am. Chem. Soc. 48, 1926, S. 562–576, doi:10.1021/ja01414a002.

