Tabun
Tabun ist ein Nervenkampfstoff. Die Substanz wurde 1936 von dem deutschen Chemiker Gerhard Schrader entdeckt, der damals für die I.G. Farben (Leverkusen) in der Forschung über neue Pestizide arbeitete. Ab 1942 wurde Tabun industriell produziert und im Zweiten Weltkrieg für die deutsche Wehrmacht in Bomben und Granaten verfüllt,[5] jedoch nicht eingesetzt.
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
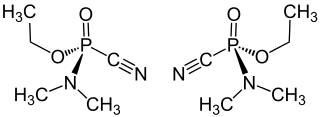 | |||||||||||||
| 1:1-Gemisch aus (R)-Tabun (links) und (S)-Tabun (rechts) | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Tabun | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | C5H11N2O2P | ||||||||||||
| Kurzbeschreibung |
farblose bis bräunliche Flüssigkeit mit fruchtigem, bei Erhitzen bittermandelartigem Geruch[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 162,13 g·mol−1 | ||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||
| Dichte |
1,08 g·cm−3[2] | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Siedepunkt |
246 °C (Zersetzung)[2] | ||||||||||||
| Dampfdruck | |||||||||||||
| Löslichkeit | |||||||||||||
| Brechungsindex |
1,4250 (20 °C)[3] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Toxikologische Daten | |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||
Geschichte
1934 erhielt Gerhard Schrader den Auftrag, Insektizide auf Basis organischer Phosphorverbindungen zu entwickeln. Im Jahr 1936 synthetisierte er Tabun. Auf die unerwartet hohe Giftigkeit wurde er erstmals durch einen schwerwiegenden Laborunfall aufmerksam. Der Geschichte nach sollen sich Schrader und Kollegen bei Experimenten mit Tabun Ende 1936 eine schwere Vergiftung zugezogen haben. Während der Arbeit traten bei Gerhard Schrader plötzlich Sehstörungen auf, die Vergiftungssymptome verschlimmerten sich dermaßen, dass er für 14 Tage stationär in ein Krankenhaus aufgenommen werden musste. Er erholte sich nur langsam und konnte seine Arbeit nach etwa 3 Wochen wieder aufnehmen. Da die neue Substanz Dimethylaminocyanophosphorsäureethylester (zunächst als Präparat 9/91 bezeichnet) als Insektizid aufgrund der extremen Toxizität unbrauchbar (tabu) war, erhielt sie den Decknamen Tabun. Die Entdeckung wurde am 5. Februar 1937 dem Hygienegewerblichen Institut Elberfeld und kurz danach dem Heereswaffenamt gemeldet. Dort wurde dann auf Basis der Struktur von Tabun die Entwicklung chemischer Waffen unter Leitung von Ministerialdirigent Christian Zahn eingeleitet. Im „Heeresgasschutzlaboratorium“ in Spandau wurden seine Eigenschaften und Wirkung sowie seine Eignung als Chemiewaffe detailliert untersucht. Eine erste Testanlage zur Produktion entstand im Raubkammer-Forst auf dem heutigen Truppenübungsplatz Munster.[6] 1940 begann die deutsche Wehrmacht und die SS 40 km nördlich von Breslau in Dyhernfurth mit dem Bau einer Chemiewaffenanlage mit Zwangsarbeiterlager (dem KZ Groß-Rosen zugehörig), vor allem zur Herstellung von Tabun (aber auch Sarin). Zahlreiche Zwangsarbeiter starben während der Produktion. Dort wurden etwa 12.000 Tonnen[7] Tabun erzeugt und verarbeitet. Otto Ambros, der Vorstandsvorsitzende der Anorgana GmbH, einer I.G.-Farben-Gesellschaft, war einer der Hauptverantwortlichen für das Werk.
Bei Kriegsende wurden die Bestände aus dem Osten teils mit Lastwagen (wobei es zum Beispiel in Lossa zu Toten kam, als ein Laster mit Tabun von alliierten Flugzeugen beschossen wurde), teils mit Barken auf der Elbe und Donau nach Westen geschafft. Die Zwangsarbeiter in Dyhernfurth wurden zu einem Todesmarsch gezwungen und vielfach ermordet. Erst bei der Durchsuchung einer Barke auf der Donau in Bayern entdeckten die Alliierten, dass in Deutschland während des Krieges Nervengase produziert wurden[8] und die britische Armee fand in der Tabun-Testanlage im Raubkammer-Forst bei Munster Unterlagen über die Entwicklung. Die Sowjets waren schon früher über die Nervengasentwicklungen informiert. Sie demontierten das Werk in Dyhernfurth und bauten es in Stalingrad wieder auf. Sowohl die alliierten (Großbritannien, USA) als auch die sowjetischen Besatzer beschäftigten nach dem Krieg deutsche Chemiker an ihren eigenen Chemiewaffenentwicklungen (in den USA im „Edgewood Arsenal“ in Maryland).
Nach dem Kriegsende wurden Wehrmachtsbestände von mit Tabun befüllten Bomben und Granaten in der Ostsee versenkt. Das aus den korrodierten Behältern austretende Gift gefährdet inzwischen den dortigen Fischbestand.
Erst 2008 wurde bekannt, dass 1949 etwa 2,5 Seemeilen (ca. 4,6 km) südlich von Helgoland Granaten mit bis zu zehn Tonnen Tabun versenkt wurden. Insgesamt handelt es sich um rund 90 Tonnen Giftgasgranaten (ca. 6000 einzelne Granaten), die dort auf dem Grund der Nordsee lagern.[9][10]
1955/56 wurden größere deutsche Tabunbestände, die von den britischen Streitkräften nach dem Zweiten Weltkrieg in Wales zwischengelagert worden waren, von der Royal Navy und Royal Air Force in der Operation Sandcastle aus Sicherheitsgründen auf ausgedienten Handelsschiffen nordwestlich von Irland versenkt: am 27. Juli 1955 der Dampfer Empire Castle, am 30. Mai 1956 das Motorschiff Vogtland und am 21. Juli 1956 der Dampfer Kotka.
Tabun ist der älteste der fünf sogenannten G-Kampfstoffe (Code: GA) neben Soman (GD), Sarin (GB), GV und Cyclosarin (GF). Nach dem Zweiten Weltkrieg übernahmen die USA und Großbritannien die Fertigung dieses Kampfstoffes. Die Sowjetunion hingegen zeigte kein großes Interesse an Tabun und konzentrierte sich mehr auf Soman. Tabun wurde außerdem von Saddam Hussein im Iran-Irak-Krieg und 1988 gegen die eigene Bevölkerung im kurdischen Nordirak beim Giftgasangriff auf Halabdscha eingesetzt.
Der dem Tabun sehr ähnliche Diethylaminocyanophosphorsäureethylester soll bereits 1898 von Carl Schall (einem Schüler von August Michaelis) hergestellt worden sein, ohne dass man auf die hohe Toxizität aufmerksam wurde.
Gewinnung und Darstellung
In Deutschland wurde Tabun im Zweiten Weltkrieg aus Dimethylaminophosphoryldichlorid mit absolutem Ethanol und überschüssigem Natriumcyanid in Chlorbenzol großtechnisch hergestellt.[1]
Eigenschaften
Tabun ist ein Ester einer zweifach substituierten Phosphorsäure und von der Struktur her vielen Pflanzenschutzmitteln (phosphororganischen Insektiziden, z. B. Methamidophos) ähnlich. Tabun ist eine farblose bis bräunliche Flüssigkeit mit fruchtigem, bei Erhitzen bittermandelartigem Geruch. Bei seinem Einsatz kann Blausäure entstehen.
Analoga
Von Tabun wurden zahlreiche Strukturanaloga hergestellt. Während der analoge Isopropylester (Dimethylaminocyanophosphorsäureisopropylester) etwas (1,3 mal) giftiger als Tabun ist, besitzt Dimethylaminofluorphosphorsäureethylester (Fluor-Tabun) eine etwa 3–4 mal geringere Toxizität. Eine Substanz, welche Strukturelemente von Tabun (das Dimethylamido-Fragment) und den sogenannten Tammelin-Estern (das Dialkylaminoalkylester-Fragment) vereint ist der Dimethylaminofluorophosphorsäuredimethylaminoethylester (GV).
Wirkungsweise
Die Aufnahme von Tabun ist über die Haut und die Atmung möglich. Im Körper blockiert Tabun die Acetylcholinesterase (AcChE), die im Nervensystem den Neurotransmitter Acetylcholin aufspaltet und somit essentiell für die Reizweiterleitung ist. Verglichen mit den anderen G-Stoffen (Sarin, Cyclosarin, Soman) hat Tabun die geringste Toxizität. Sarin ist etwa 3–4 mal und Soman 10–15 mal toxischer als Tabun.
Es kommt, je nach Stärke der Vergiftung, zu folgenden Symptomen: Kopfschmerzen, Übelkeit mit Erbrechen und Durchfällen, Augenschmerzen, Müdigkeit, Krampfanfälle, Zittern, Zucken der Muskulatur, unkontrollierter Harn- und Stuhlabgang, Atemnot, Appetitlosigkeit, Angstzustände, Spannungen, Verwirrtheit, Bewusstlosigkeit. Der Tod tritt durch Atemlähmung ein.
Schutzmaßnahmen
Nervenkampfstoffe wirken bereits in kleinsten Mengen tödlich. Angriffsfläche ist der gesamte Körper. Deshalb bieten nur ein Ganzkörper-Schutzanzug und eine Schutzmaske mit Atemfilter ausreichenden Schutz. Vor einem Kampfstoffeinsatz können Oxim-Tabletten oder Carbamate wie Pyridostigmin oder Physostigmin eingenommen werden.[11][12] Bei einer Vergiftung spritzt man Atropin oder Hyoscyamin (Alkaloid der Tollkirsche), die den Acetylcholinrezeptor blockieren und so die Wirkung des Acetylcholins aufheben.[13] Im Verlauf der wochenlangen Nachbehandlung versucht man, mit Obidoxim die Acetylcholinesterase zu regenerieren.
Für die Dekontamination können unter anderem Oxidationsmittel, wie z. B. Chlorkalk oder Calciumhypochlorit, alkalische Lösungen und nichtwässrige Medien, wie Aminoalkoholate, verwendet werden, da Nervenkampfstoffe empfindlich gegenüber Oxidationsmitteln sind und ihre Hydrolyse im basischen Milieu beschleunigt abläuft. Auf empfindlichen Oberflächen kann auch Natriumcarbonatlösung verwendet werden, die jedoch langsamer wirkt.
Analytik
Der zuverlässige Nachweis von Tabun und anderen Nervengiften wird möglich durch tragbare Geräte, welche die Kapillargaschromatographie mit der Massenspektrometrie zur Trennung und Identifizierung einsetzen.[14] Die Untersuchung von physiologischem Material setzt eine angemessene Probenvorbereitung voraus.[15]
Siehe auch
Literatur
- Roy Sloan: The tale of tabun. Nazi chemical weapons in North Wales. Gwasg Carreg Gwalch, Llanrwst 1998, ISBN 0-86381-465-4.
Einzelnachweise
- Eintrag zu Tabun. In: Römpp Online. Georg Thieme Verlag, abgerufen am 12. Juni 2014.
- Eintrag zu CAS-Nr. 77-81-6 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 27. Dezember 2019. (JavaScript erforderlich)
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-466.
- Günter Hommel: Handbuch der gefährlichen Güter. Band 6. Springer, Berlin / Heidelberg 2012, ISBN 978-3-642-25051-4, S. 2317.
- Nachr. Chem. 2012, 60, 1194.
- Sarah Everts: The Nazi origins of deadly nerve gases. In: Chemical and Engineering News, 17. Oktober 2016. Der Bericht folgt Jonathan Tucker: War of nerve. Pantheon Books, 2006.
- Florian Schmaltz: Kampfstoff-Forschung im Nationalsozialismus: zur Kooperation von Kaiser-Wilhelm-Instituten, Militär und Industrie. Wallstein, 2005, ISBN 3-89244-880-9, S. 453–455 (eingeschränkte Vorschau in der Google-Buchsuche).
- Sarah Everts: Chemical Engineering News. 2016.
- 6000 Granaten mit Nervengift vor Helgoland gesucht. In: Hamburger Abendblatt. 9. Dezember 2008.
- Giftgas vor Helgoland. In: Hamburger Abendblatt. 17. Juni 2009.
- Saskia Eckert: Entwicklung eines dynamischen Modells zum Studium der Schutzeffekte reversibler Acetylcholinesterase-Hemmstoffe vor der irreversiblen Hemmung durch hochtoxische Organophosphate. (PDF; 1,2 MB), Dissertation, Universität München, 2006, S. 1.
- L. Szinicz, S. I. Baskin: Chemische und biologische Kampfstoffe. In: Lehrbuch der Toxikologie. 2. Auflage, W. V. mbH, Stuttgart 2004, ISBN 978-3-8047-1777-0, S. 865–895.
- Eintrag zu Nervenkampfstoffe. In: Römpp Online. Georg Thieme Verlag, abgerufen am 12. Juni 2014.
- H. Nagashima, T. Kondo, T. Nagoya, T. Ikeda, N. Kurimata, S. Unoke, Y. Seto: Identification of chemical warfare agents from vapor samples using a field-portable capillary gas chromatography/membrane-interfaced electron ionization quadrupole mass spectrometry instrument with Tri-Bed concentrator. In: J Chromatogr A. 1406, 7. Aug 2015, S. 279–290. PMID 26118803.
- B. S. Crow, B. G. Pantazides, J. Quiñones-González, J. W. Garton, M. D. Carter, J. W. Perez, C. M. Watson, D. J. Tomcik, M. D. Crenshaw, B. N. Brewer, J. R. Riches, S. J. Stubbs, R. W. Read, R. A. Evans, J. D. Thomas, T. A. Blake, R. C. Johnson: Simultaneous measurement of tabun, sarin, soman, cyclosarin, VR, VX, and VM adducts to tyrosine in blood products by isotope dilution UHPLC-MS/MS. In: Anal Chem. 86(20), 21. Okt 2014, S. 10397–10405. PMID 25286390.

