Kohlensäurediethylester
Kohlensäurediethylester (auch Diatol oder Diethylcarbonat) ist eine organisch-chemische Verbindung. Bei Raumtemperatur liegt sie in Form einer klaren, etherisch riechenden Flüssigkeit vor.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
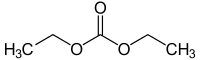 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Kohlensäurediethylester | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Summenformel | C5H10O3 | |||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit etherischem Geruch[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 118,13 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig[2] | |||||||||||||||
| Dichte |
0,9764 g·cm−3[3] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
125,8 °C[3] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Brechungsindex |
1,384 (20 °C)[4] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Darstellung und Gewinnung
Die Herstellung erfolgt durch die Umsetzung von Phosgen mit Ethanol.[3] Ein neueres Verfahren geht vom Harnstoff aus, wobei die Reaktion mit Ethanol bei 180 °C über Yttriumkatalysatoren erfolgt.[5]
Eigenschaften
Physikalische Eigenschaften
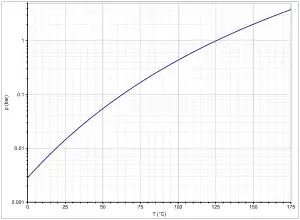
Kohlensäurediethylester ist eine farblose und niedrigviskose Flüssigkeit, die bei Normaldruck bei 126 °C siedet. Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 4,77616, B = 1721,904 und C = −37,959 im Temperaturbereich von 263 bis 399 K.[6] Die kritische Temperatur liegt bei 296 °C, der Kritische Druck bei 34,6 bar.[7] Die Wärmekapazität beträgt bei 21 °C 210,9 J·mol−1·K−1 bzw. 1,78 J·g−1·K−1.[8]
Chemische Eigenschaften
Bei höheren Temperaturen zerfällt Kohlensäurediethylester zu Kohlendioxid, Ethanol und Ethen. Die Zersetzungsreaktion verläuft nach einem Zeitgesetz erster Ordnung. Mit einer Aktivierungsenergie von 195 kJ·mol−1 und einem Arrheniusfaktor von 1,15·1013 s−1 ergeben die Halbwertszeiten der Zersetzung bei 270 °C mit 95 h, bei 310 °C mit 5 h und bei 360 °C mit 23 min.[9]
Sicherheitstechnische Kenngrößen
Kohlensäurediethylester bildet entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt unterhalb von 25 °C. Der Explosionsbereich liegt zwischen 1,4 Vol.‑% (69 g/m3) als untere Explosionsgrenze (UEG) und 11,7 Vol.‑% (570 g/m3) als obere Explosionsgrenze (OEG).[10] Die Grenzspaltweite wurde mit 0,83 mm bestimmt.[10] Es resultiert damit eine Zuordnung in die Explosionsgruppe IIB.[10] Die Zündtemperatur beträgt 445 °C.[10] Der Stoff fällt somit in die Temperaturklasse T2.
Verwendung
Kohlensäurediethylester wird als Lösungsmittel für Cellulosenitrat und -ether, Kunst- und Naturharze eingesetzt. Außerdem findet es Verwendung bei organischen Synthesen, zum Beispiel bei der Carboethoxylierung, sowie bei Synthesen von Heterocyclen.
Ferner entsteht es bei der „Entschärfung“ von Phosgen. Dieses entsteht bei der Zersetzung von Chloroform unter Sauerstoffzufuhr und Lichteinfluss neben Salzsäure. Durch den Zusatz von Ethanol kann das Chloroform „phosgensicher“ gemacht werden, denn mit dem Alkohol reagiert das Phosgen sofort zu unschädlichem Kohlensäurediethylester.
Die Verbindung ist auch ein Bestandteil von Elektrolytlösungen für Lithiumbatterien.[11][12]
Einzelnachweise
- Eintrag zu DIETHYL CARBONATE in der CosIng-Datenbank der EU-Kommission, abgerufen am 13. November 2021.
- Eintrag zu CAS-Nr. 105-58-8 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 25. April 2016. (JavaScript erforderlich)
- Eintrag zu Diethylcarbonat. In: Römpp Online. Georg Thieme Verlag, abgerufen am 19. Juni 2014.
- Datenblatt Diethyl carbonate bei Sigma-Aldrich, abgerufen am 29. Mai 2011 (PDF).
- Patent US2010/312001 A1, Bayer MaterialScience AG 2010.
- Stull, D.R.: Vapor Pressure of Pure Substances Organic Compounds in Ind. Eng. Chem. 39 (1947) 517–540, doi:10.1021/ie50448a022.
- Cocero, M.J.; Mato, F.; Garcia, I.; Cobos, J.C.: Thermodynamics of binary mixtures containing organic carbonates. 3. Isothermal vapor-liquid equilibria for diethyl carbonate + cyclohexane, + benzene, or + tetrachloromethane in J. Chem. Eng. Data 34 (1989) 443–445, doi:10.1021/je00058a021.
- Kolosovskii, N.A.; Udovenko, W.W.: Specific heat of liquids. II. in Zhur. Obshchei Khim. 4 (1934) 1027–1033.
- JTD Cross, R. Hunter, V. R. Stimson: The thermal decomposition of simple carbonate esters. In: Australian Journal of Chemistry. 29, 1976, S. 1477, doi:10.1071/CH9761477.
- E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen – Band 1: Brennbare Flüssigkeiten und Gase, Wirtschaftsverlag NW – Verlag für neue Wissenschaft GmbH, Bremerhaven 2003.
- Tetsuya Kawamura, Arihisa Kimura, Minato Egashira, Shigeto Okada, Jun-Ichi Yamaki: Thermal stability of alkyl carbonate mixed-solvent electrolytes for lithium ion cells. In: Journal of Power Sources. 104, 2002, S. 260–264, doi:10.1016/S0378-7753(01)00960-0. bibcode:2002JPS...104..260K.
- Boris Ravdel, K.M Abraham u. a.: Thermal stability of lithium-ion battery electrolytes. In: Journal of Power Sources. 119–121, 2003, S. 805–810, doi:10.1016/S0378-7753(03)00257-X.
