Carbamate
Carbamate sind Salze und Ester der Carbamidsäuren (R2N–COOH). Die Ester werden häufiger als Urethane bezeichnet. Auch Polyurethane gehören zu den Carbamaten.
| Carbamate |
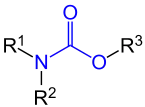 |
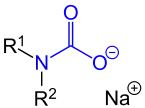 |
Herstellung
Carbamate lassen sich aus Isocyanaten und Alkoholen durch eine Additionsreaktion herstellen, wobei R1 und R2 Organylgruppen, wie z. B. Alkylgruppen oder Arylgruppen sind:[1]
Alternativ können Carbamate durch Umsetzung von Chlorameisensäureestern oder Kohlensäureestern mit Aminen hergestellt werden.
In seltenen Fällen mag eine Herstellung aus einem Amin und CO2 gelingen:
- R2NH + CO2 → R2NCO2H
Im Allgemeinen sind Carbamidsäuren jedoch instabil und decarboxylieren.
Eigenschaften
Urethane sind meist gut kristallisierende Feststoffe und dienen daher in der chemischen Analytik als Identifikationspräparate.
Die Giftigkeit einiger Carbamate (z. B. Bendiocarb) kommt der von als Pestizide verwendeten Phosphorsäurederivaten (Phosphorsäureester) gleich und beruht auf ihrer neurotoxischen Wirkung. Die Persistenz in der Umwelt beträgt 1 bis 12 Wochen. Carbamate sind hydrolysestabiler als Ester der Orthophosphorsäure.
Verwendung
Carbamate werden seit den 1950er Jahren vor allem als Insektizide, Fungizide und Herbizide in der Landwirtschaft eingesetzt. Der weltweite Verbrauch an Carbamaten lag 1995 bei etwa 30.000 Tonnen. Ammoniumcarbamat ist als Zwischenprodukt bei der technischen Gewinnung von Harnstoff von Bedeutung. Einige Carbamate wurden früher als Schlafmittel verwendet. In der organischen Synthese werden Carbamate wegen ihrer Stabilität gegenüber basenkatalysierter Hydrolyse als Schutzgruppen für Amine eingesetzt.[2]
Carbamat-analoge Stoffgruppen mit Heteroatomen
Durch Ersetzen eines oder beider Sauerstoffatome im Molekül gelangt man zu den heteroanalogen Verbindungen der Carbamate[3] (R1 bis R4 = aliphatische bzw. aromatische Reste oder Wasserstoff).
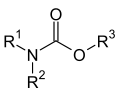 Carbamate
Carbamate
(Grundstruktur) Thiolocarbamate
Thiolocarbamate
(Syn.: Thiolourethane) Thionocarbamate
Thionocarbamate
(Syn.: Thionourethane) Dithiocarbamate
Dithiocarbamate
(Syn.: Dithiourethane) Iminocarbamate
Iminocarbamate
Einzelnachweise
- Siegfried Hauptmann: Organische Chemie, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig, 1985, S. 325. ISBN 3-342-00280-8.
- Eintrag zu Schutzgruppen. In: Römpp Online. Georg Thieme Verlag, abgerufen am 5. September 2013.
- Matthys J. Janssen: Thiolo, Thiono, und Dithio Acids and Esters in: The Chemistry of Carboxylic Acids and Their Esters (1969) Kap. 15.
