HMG-CoA-Reduktase
HMG-CoA-Reduktase (HMGCR, Abkürzung für 3-Hydroxy-3-Methylglutaryl-Coenzym-A-Reduktase) ist ein Enzym (EC 1.1.1.34), das in Eukaryoten das 3-Hydroxy-3-Methylglutaryl-Coenzym-A mit dem Cosubstrat NADPH zu Mevalonsäure reduziert. Im Menschen ist die Reaktion für die Cholesterinbiosynthese geschwindigkeitsbestimmend. Die Hemmung der HMG-CoA-Reduktase führt daher zur Senkung des Cholesterinspiegels. Als HMG-CoA-Reduktase-Inhibitoren haben sich die Statine durchgesetzt, die sich von dem Naturstoff Lovastatin ableiten, einer der Mevalonsäure verwandten Verbindung.
| HMG-CoA-Reduktase | ||
|---|---|---|
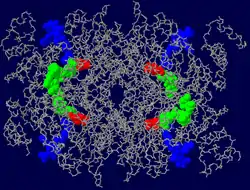 | ||
| Stäbchenmodell des Dimers mit Kalotten: Coenzym A (blau), β-Hydroxy-β-methyl-glutarylsäure (rot) und NADP (grün), nach PDB 1DQA | ||
|
Vorhandene Strukturdaten: s. UniProt | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 888 Aminosäuren | |
| Sekundär- bis Quartärstruktur | Homodimer | |
| Isoformen | 2 | |
| Bezeichner | ||
| Gen-Name | HMGCR | |
| Externe IDs | ||
| Transporter-Klassifikation | ||
| TCDB | 2.A.6.6.5 | |
| Bezeichnung | Steroltransporter-Familie | |
| Enzymklassifikation | ||
| EC, Kategorie | 1.1.1.34, Oxidoreduktase | |
| Reaktionsart | Redoxreaktion | |
| Substrat | 3-Hydroxy-3-Methylglutaryl-CoA + 2 NAD(P)H/H+ | |
| Produkte | (R)-Mevalonat + CoA-SH + 2 NAD(P)+ | |
| Vorkommen | ||
| Homologie-Familie | HMG-CoA-Reduktase | |
| Übergeordnetes Taxon | Eukaryoten | |
| Orthologe | ||
| Mensch | Hausmaus | |
| Entrez | 3156 | 15357 |
| Ensembl | ENSG00000113161 | ENSMUSG00000021670 |
| UniProt | P04035 | Q01237 |
| Refseq (mRNA) | NM_000859 | NM_008255 |
| Refseq (Protein) | NP_000850 | NP_032281 |
| Genlocus | Chr 5: 75.34 – 75.36 Mb | Chr 13: 96.65 – 96.67 Mb |
| PubMed-Suche | 3156 | 15357 |
Das entsprechende, in Bakterien aktive Enzym (EC 1.1.1.88) verwendet NADH als Cofactor. In Pflanzen ist Mevalonat der Ausgangsstoff der Isoprenoide.
Katalysierte Reaktion
-3-Hydroxy-3-methylglutaryl-CoA.svg.png.webp) + 2 NADPH/H+ ⇒
+ 2 NADPH/H+ ⇒ -Mevalonat.svg.png.webp) + CoA-SH + 2 NADP+
+ CoA-SH + 2 NADP+
- HMG-CoA wird zu Mevalonat reduziert.
Regulation
Die Transkription der HMG-CoA-Reduktase wird von Transkriptionsfaktoren reguliert, die unter Mitwirkung von SCAP (SREBP cleavage activating protein) durch MBTPS1-katalysierte proteolytische Spaltung von SREBPs (sterol regulatory element binding protein) entstehen. SCAP wird durch gebundenes Cholesterin inaktiviert, so dass bei steigender Cholesterinkonzentration die Bildung der HMG-CoA-Reduktase abnimmt. Zusätzlich wird die HMG-CoA-Reduktase durch Bindung von Cholesterin allosterisch gehemmt; Lanosterol, ein Vorläufer des Cholesterins, wirkt ebenfalls als allosterischer Hemmer. Bei zellulärem Energiemangel mit erhöhter AMP-Konzentration wird die HMG-CoA-Reduktase durch AMP-aktivierte Proteinkinase (AMPK) reversibel phosphoryliert und damit inaktiviert; die energieaufwändige Cholesterinsynthese wird so verringert. Bei Cholesterinmangel nimmt die Transkription des HMG-CoA-Reduktase-Gens wieder zu.
Weitere Hormone, die regulierend auf HMG-CoA-Reduktase wirken sind
- Insulin (stimulierend)
- Glucagon (Antagonist von Insulin)
- Thyroidhormone (stimulierend; allerdings führt eine Hypothyreose aus anderen, unklaren Gründen zu erhöhten Cholesterinspiegeln im Blut)
Weitere Namen
- 3-Hydroxy-3-methylglutaryl-CoA-Reduktase
- (S)-3-Hydroxy-3-methylglutaryl-CoA-Reduktase
- β-Hydroxy-β-methylglutaryl-Coenzym-A-Reduktase[1]
Literatur
- Georg Löffler: Biochemie und Pathobiochemie. 7. Auflage. Springer, 2003, ISBN 3-540-42295-1.
- J. Roitelman, E. H. Olender, S. Bar-Nun, W. A. Dunn, R. D. Simoni: Immunological evidence for eight spans in the membrane domain of 3-hydroxy-3-methylglutaryl coenzyme A reductase: implications for enzyme degradation in the endoplasmic reticulum. In: J. Cell Biol. 117 (5), Juni 1992, S. 959–973. doi:10.1083/jcb.117.5.959. PMC 2289486 (freier Volltext). PMID 1374417.
- V. Lindgren, K. L. Luskey, D. W. Russell, U. Francke: Human genes involved in cholesterol metabolism: chromosomal mapping of the loci for the low density lipoprotein receptor and 3-hydroxy-3-methylglutaryl-coenzyme A reductase with cDNA probes. In: Proc. Natl. Acad. Sci. U.S.A. 82 (24), Dezember 1985, S. 8567–8571. doi:10.1073/pnas.82.24.8567. PMC 390958 (freier Volltext). PMID 3866240.
- J. A. Farmer: Aggressive lipid therapy in the statin era. In: Prog. Cardiovasc. Dis. 41 (2), 1998, S. 71–94. doi:10.1016/S0033-0620(98)80006-6. PMID 9790411.
- Is there a "best" statin drug? In: Johns Hopkins Med. Lett. Health After. 50 15 (11), Januar 2004, S. 4–5. PMID 14983817.
- Y. L. Lin, T. H. Wang, M. H. Lee, N. W. Su: Biologically active components and nutraceuticals in the Monascus-fermented rice: a review. In: Appl. Microbiol. Biotechnol. 77 (5), Januar 2008, S. 965–973. doi:10.1007/s00253-007-1256-6. PMID 18038131.
- N. A. Flores: Ezetimibe + simvastatin (Merck/Schering-Plough). In: Current Opinion in Investigational Drugs. 5 (9), September 2004, S. 984–992. PMID 15503655.
- Department of Chemistry and Biochemistry: Biophysical Methods - Lecture 3: Membrane Proteins. University of Guelph, Oktober 1998.
- C. Arnaud, N. R. Veillard, F. Mach: Cholesterol-independent effects of statins in inflammation, immunomodulation and atherosclerosis. In: Curr. Drug Targets Cardiovasc. Haematol. Disord. 5 (2), April 2005, S. 127–134. doi:10.2174/1568006043586198. PMID 15853754.
- Sajoscha Sorrentino, Ulf Landmesser: Nonlipid-lowering effects of statins. In: Curr. Treat. Options Cardiovasc. Med., 7 (6), Dezember 2005, S. 459–466. doi:10.1007/s11936-005-0031-1. PMID 16283973.
- O. Stüve, S. Youssef, L. Steinman, S. S. Zamvil: Statins as potential therapeutic agents in neuroinflammatory disorders. In: Current Opinion in Neurology. 16 (3), Juni 2003, S. 393–401. doi:10.1097/01.wco.0000073942.19076.d1. PMID 12858078.
- J. L. Thorpe, M. Doitsidou, S. Y. Ho, E. Raz, S. A. Farber: Germ cell migration in zebrafish is dependent on HMGCoA reductase activity and prenylation. In: Dev. Cell. 6 (2), Februar 2004, S. 295–302. doi:10.1016/S1534-5807(04)00032-2. PMID 14960282.
- S. Eisa-Beygi, G. Hatch, S. Noble, M. Ekker, T. M. Moon: The 3-hydroxy-3-methylglutaryl-CoA reductase (HMGCR) pathway regulates developmental cerebral-vascular stability via prenylation-dependent signalling pathway. In: Dev. Biol. 373 (2), Januar 2013, S. 258–266. doi:10.1016/j.ydbio.2012.11.024. PMID 23206891.
- T. E. Meigs, D. S. Roseman, R. D. Simoni: Regulation of 3-hydroxy-3-methylglutaryl-coenzyme A reductase degradation by the nonsterol mevalonate metabolite farnesol in vivo. In: J. Biol. Chem. 271 (14), April 1996, S. 7916–7922. doi:10.1074/jbc.271.14.7916. PMID 8626470.
- T. E. Meigs, R. D. Simoni: Farnesol as a regulator of HMG-CoA reductase degradation: characterization and role of farnesyl pyrophosphatase. In: Arch. Biochem. Biophys. 345 (1), September 1997, S. 1–9. doi:10.1006/abbi.1997.0200. PMID 9281305.
- R. K. Keller, Z. Zhao, C. Chambers, G. C. Ness: Farnesol is not the nonsterol regulator mediating degradation of HMG-CoA reductase in rat liver. In: Arch. Biochem. Biophys. 328 (2), April 1996, S. 324–330. doi:10.1006/abbi.1996.0180. PMID 8645011.
- E. S. Istvan, M. Palnitkar, S. K. Buchanan, J. Deisenhofer: Crystal structure of the catalytic portion of human HMG-CoA reductase: insights into regulation of activity and catalysis. In: EMBO J. 19 (5), März 2000, S. 819–830. doi:10.1093/emboj/19.5.819. PMC 305622 (freier Volltext). PMID 10698924.
- J. L. Goldstein, M. S. Brown: Regulation of the mevalonate pathway. In: Nature. 343 (6257), Februar 1990, S. 425–430. doi:10.1038/343425a0. PMID 1967820.
- D. G. Hardie, J. W. Scott, D. A. Pan, E. R. Hudson: Management of cellular energy by the AMP-activated protein kinase system. In: FEBS Lett. 546 (1), Juli 2003, S. 113–120. doi:10.1016/S0014-5793(03)00560-X. PMID 12829246.
- L. A. Witters, B. E. Kemp, A. R. Means: Chutes and Ladders: the search for protein kinases that act on AMPK. In: Trends Biochem. Sci. 31 (1), Januar 2006, S. 13–16. doi:10.1016/j.tibs.2005.11.009. PMID 16356723.
Weblinks
- HMG-CoA-Reduktase. In: Online Mendelian Inheritance in Man. (englisch).
Anmerkungen
- siehe: KEGG EC 1.1.1.34