Proximale Tubuluszelle
Proximale Tubuluszellen (engl. proximal tubular cells, PTC) sind Epithelzellen, die in der Niere den vorderen Teil des Nierenkanälchens, den proximalen Tubulus, bilden. Es handelt sich um hochdifferenzierte Zellen, die einschichtig isoprismatisch, teilweise auch kubisch, angeordnet sind.
Aufbau und Funktion
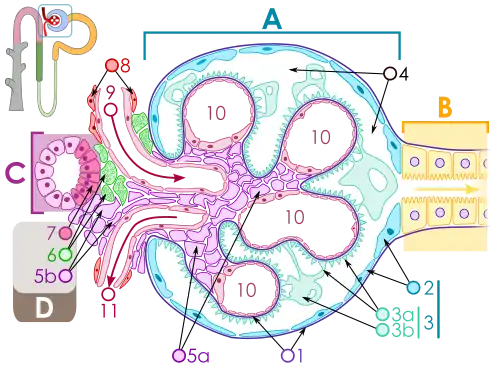
Im Glomerulum werden etwa 20 % der einströmenden Blutflüssigkeit – ähnlich wie bei einem Filter – als Primärharn abgepresst. Pro Tag sind dies bei einem erwachsenen Menschen etwa 150 Liter. Der größte Teil dieser Flüssigkeit (nahezu 99 %) und der darin enthaltenen Nähr- und Mineralstoffe muss dem Körper wieder zugeführt werden, da ein solcher Verlust nicht durch neue Flüssigkeitsaufnahme zu kompensieren wäre. Dies erfolgt durch Rückführung dieser Stoffe (Resorption) durch die Tubuluszellen in den Nephrons der Nieren. Bei der Rückführung des Wassers spricht man von einer Rückresorption; bei den lebensnotwendigen Nähr- und Mineralstoffen von Reabsorption. Neben den für den Körper wertvollen Nähr- und Mineralstoffen werden auch Abfallstoffe wie Harnsäure und Harnstoff zunächst rückresorbiert und in einem zweiten Schritt wieder sezerniert (ausgeschieden).[1] Bei Harnstoff wird über den proximalen Tubulus etwa 50 % rückresorbiert[2][3] und über die kortikalen Blutgefäße der Vena renalis (Nierenvene) zugeführt.[4]
An der zum Primärharn gerichteten Seite der proximalen Tubuluszellen befindet sich ein ganzes Netzwerk unterschiedlicher Rezeptoren, Coated Pits und Endosomen. Im Zellinneren findet sich entsprechend eine Vielzahl von späten Endosomen, primären Lysosomen und Lysosomen. Dichte apikale Tubuli sind für das Rezeptor-Recycling aus den Endosomen zuständig.[5]
An Rezeptoren befinden sich auf der apikalen Zellmembran der proximalen Tubuluszellen unter anderem Folatrezeptoren, IGF2R (insulin-like growth factor 2 receptor) und M6PR (Mannose-6-phosphat-Rezeptor) sowie vor allem Cubilin und Megalin.[5] In der Zellmembran stark exprimiertes Aquaporin 1, auch CHIP-28 genannt (engl. channel-forming integral proteins), ermöglicht einen transzellulären Transport von Wasser.[6][7][8][9]
Sekretion und Resorption in den Nierentubuli verändern den Primärharn. Am Ende des Tubulus wird der Endharn über Sammelrohre, Nierenbecken und Harnleiter der Harnblase zugeführt. Das Tubulussystem ist in verschiedene Abschnitte unterteilt, die unterschiedliche Aufgaben haben.
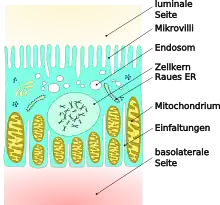
An der luminalen, das heißt dem Primärharn zugewandten, Seite weisen die Tubuluszellen Mikrovilli auf. Diese dienen der Vergrößerung der Zelloberfläche und somit dem besseren Stoffaustausch. Die basale Seite weist dagegen eine Faltenstruktur auf. Im Zytoplasma befinden sich vor allem auf der basalen Seite relativ viele Mitochondrien, um ausreichend Energie für die aufwändigen resorptiven Transportvorgänge zu Verfügung zu stellen. Dies ist insbesondere für die ATP-abhängigen Na+/K+-Pumpen wichtig.[10] Die Rückresorption ist energetisch recht aufwändig: Pro ATP-Molekül werden lediglich drei Natrium-Ionen aus dem Primärharn durch die Tubuluszellen transportiert.[11]
Der größte Teil des Sauerstoffverbrauches der Niere erfolgt durch die Tubuluszellen. Dabei benötigt alleine der Transport von Natriumionen, der zu etwa 2/3 im proximalen Tubulus erfolgt, ungefähr 75 Prozent des gesamten verbrauchten Sauerstoffs.[12]
Aufgaben
Tubuloglomerulärer Feedback
Postuliert wird ein tubuloglomeruläres Feedback (im Maskulinum auch als tubuloglomerulärer Feedback bezeichnet) oder ein tubuloglomeruläres Gleichgewicht, um gewissermaßen eine mehr oder weniger strikte Proportionalität zwischen Primärharnbildung und Urinproduktion zu gewährleisten. Im kardiogenen Schock oder bei körperlicher Extrembelastung ruft eine große oder normale glomeruläre Filtrationsrate oft jedoch im Gegenteil eine Oligurie oder sogar eine Anurie hervor, um bei einer Dehydrierung des Körpers eine relative Hypovolämie zu kompensieren. Wenn die tubuläre Rückresortionsquote sinkt, dann steigt die Sekundärharnbildung und umgekehrt.
Die glomeruläre Filtrationsrate ist weitgehend proportional zum Herzzeitvolumen. Die tubuläre Rückresorption ist weitgehend umgekehrt proportional zum Blutvolumen. Also gibt es keinen direkten Zusammenhang zwischen Primärharnbildung und Sekundärharnbildung. Wer viel trinkt, produziert bei großen Blutvolumen viel Urin und bei kleinem Blutvolumen wenig Urin. Wer wenig trinkt, produziert bei normalem Blutvolumen wenig Urin und bei kleinem Blutvolumen keinen Urin.
Mineral- und Wasserresorption
Etwa 60 % der über die Glomeruli filtrierten Natrium-, Kalium-, Hydrogencarbonat- und Chlorid-Ionen werden in den proximalen Tubuli resorbiert. Auch Phosphat- und Sulfationen gehören dazu. Ein Teil dieser Stoffe wird durch die Tubuluszellen hindurch (transzellulär) resorbiert. Bei Kalium, Chlorid, Calcium oder Harnstoff ermöglicht der Konzentrationsgradient die parazelluläre Diffusion (zwischen den Tubuluszellen) und so die Rückresorption. Beim Wasser genügt bereits der osmotische Druck für die parazelluläre Resorption. Durch den sogenannten Solvent Drag werden dabei auch im Wasser gelöste Ionen mit gezogen. Zudem haben die Tubuluszellen keine spezifischen Kaliumtransporter.[13][11]
Die Natriumionen werden im Antiport mit Protonen und im Symport mit Glucose, Galactose, Aminosäuren, Phosphat- und Sulfationen, sowie Mono- und Dicarbonsäuren aufgenommen. An der basolateralen Seite der Tubuluszellen sorgt die Natrium-Kalium-Pumpe (3 Na+/ 2 K+-ATPase) dafür, dass der Konzentrationsgradient über der Zellmembran erhalten bleibt.[13] Hydrogencarbonationen werden durch die Reaktion mit Protonen in Wasser und Kohlenstoffdioxid zerlegt und können so passiv zurück diffundieren.[13]
Glucoseresorption
In der gesunden Niere wird von den Tubuluszellen 100 % der Glucose rückresorbiert. Dies geschieht vor allem mit Hilfe der Glucosetransporter SGLT-2. Im Gegensatz dazu ist im distalen Tubulus vor allem der Glucosetransporter SGLT-1 an der Zellmembran exprimiert. Die Glucosetransporter GLUT-2 und GLUT-5 spielen eine untergeordnete Rolle. Die sogenannte Nierenschwelle von Glucose liegt bei ca. 180 mg/dl (10 mmol/l) im Serum, da ab dieser Konzentration von Glucose die Sättigung der Systeme, die an der Rückresorption beteiligt sind, erreicht ist. Ab einer Konzentration von 22 mmol/l liegt eine vollständige Sättigung vor und die Glucoseausscheidung über den Urin steigt proportional zur Konzentration im Plasma.[14]
Resorption von Aminosäuren, Peptiden und kleinen Proteinen
Auch Peptide oder Proteine, die klein genug sind durch das Glomerulum hindurch in den Primärharn zu gelangen, werden von den Tubuluszellen aufgenommen und komplett katabolisiert. Ein Beispiel hierfür ist das aus 120 Aminosäuren aufgebaute Cystatin C.[15][16]
Die Membranproteine Megalin und Cubilin der proximalen Tubuluszellen spielen bei der Endozytose von Peptiden und Proteinen eine wichtige Rolle. Beide werden an der apikalen, zum Primärharn ausgerichteten, Seite exprimiert.[17] Nach der endozytotischen Aufnahme werden die Proteine zur Proteolyse (Abbau) in Lysosome und die beiden Rezeptoren wieder an die apikale Seite der Zellmembran transportiert (Rezeptor-Recycling). Ein transzellulärer Proteintransport findet dagegen kaum statt. Die Resorption von Proteinen im proximalen Tubulus ist in einer gesunden Niere sehr effizient, so dass der Endharn des Menschen frei von Proteinen ist.[18]
Der Megalin-Cubilin-Komplex kann nicht nur Aminosäuren, Peptide und Proteine resorbieren, sondern eine Vielzahl anderer essenzieller Verbindungen, wie beispielsweise Vitamine oder an Plasmaproteine gebundene Spurenelemente.[18]
Krankheiten
Die proximalen Tubuluszellen spielen bei einer Reihe von Nierenerkrankungen und -funktionsstörungen eine zentrale Rolle, so beispielsweise bei der glomerulären Proteinurie und der chronischen Transplantatnephropathie. Durch Schädigung oder Stimulation der proximalen Tubuluszellen wird eine Reihe von Signalkaskaden über Botenstoffe ausgelöst. Dies kann beispielsweise zur Produktion von Proteinen des Komplementsystems, von Chemokinen, Zytokinen und Komponenten der extrazellulären Matrix in den proximalen Tubuluszellen führen. Die lokal erzeugten Botenstoffe können die Schädigung der proximalen Tubuluszellen durch eine verstärkte Diapedese (Leukozytenmigration), insbesondere von Makrophagen, Granulozyten und T-Zellen, weiter vorantreiben und zu einer Abwärtsspirale führen. Gerade die Produktion der Chemo- und Zytokine kann durch entzündungsfördernde (proinflammatorische) Prozesse die Nierenfunktion irreversibel beeinträchtigen, was bis zur Niereninsuffizienz führen kann. Die gezielte Immunsuppression der proximalen Tubuluszellen ist ein potenzieller therapeutischer Ansatzpunkt zur Behandlung der genannten Erkrankungen.[19]
Mutationen im LRP2-Gen, das für das Membranprotein Megalin kodiert, können eine Einschränkung der Funktionsfähigkeit dieses Rezeptors bewirken, was zu einer Proteinurie und dem sehr seltenen Donnai-Barrow-Syndrom führen kann.[20]
Weiterführende Literatur
- D. Brown u. a.: Regulation of the V-ATPase in kidney epithelial cells: dual role in acid-base homeostasis and vesicle trafficking. In: J Exp Biol 212, 2009, S. 1762–1772. PMID 19448085 (Review)
- U. Panchapakesan u. a.: Review article: importance of the kidney proximal tubular cells in thiazolidinedione-mediated sodium and water uptake. In: Nephrology 14, 2009, S. 298–301. PMID 19444964 (Review)
- Y. Motoyoshi u. a.: Megalin contributes to the early injury of proximal tubule cells during nonselective proteinuria. In: Kidney Int. 74, 2008, S. 1262–1269. PMID 18769366
- A. A. El-Sheikh u. a.: Mechanisms of renal anionic drug transport. In: Eur J Pharmacol 585, 2008, S. 245–255. PMID 18417112 (Review)
- Y. J. Lee u. a.: Regulatory mechanisms of Na(+)/glucose cotransporters in renal proximal tubule cells. In: Kidney Int Suppl 106, 2007, S. 27–35. PMID 17653207 (Review)
- E. E. Robertson und G. O. Rankin: Human renal organic anion transporters: characteristics and contributions to drug and drug metabolite excretion. In: Pharmacol Ther 109, 2006, S. 399–412. PMID 16169085 (Review)
- B. C. Burckhardt und G. Burckhardt: Transport of organic anions across the basolateral membrane of proximal tubule cells. In: Rev Physiol Biochem Pharmacol 146, 2003, S. 95–158. PMID 12605306 (Review)
Einzelnachweise
- Manuskript: Die Niere. (Memento vom 18. Juli 2003 im Internet Archive) Universitätsklinikum Gießen, abgerufen am 7. Januar 2010.
- S. Kawamura, J. P. Kokko: Urea secretion by the straight segment of the proximal tubule. In: The Journal of clinical investigation. Band 58, Nummer 3, September 1976, S. 604–612, doi:10.1172/JCI108507, PMID 956389, PMC 333219 (freier Volltext).
- T. Armsen und H. W. Reinhardt: Transtubular movement of urea at different degrees of water diuresis. In: Pflügers Arch 326, 1971, S. 270–280. PMID 5106093.
- B. Yang und L. Bankir: Urea and urine concentrating ability: new insights from studies in mice. In: Am J Physiol Renal Physiol 288, 2005, S. F881–896. PMID 15821253 (Review).
- E. I. Christensen u. a.: Membrane receptors for endocytosis in the renal proximal tubule. In: Int Rev Cytol 180, 1998, S. 237–284. PMID 9496636 (Review).
- S. Nielsen und P. Agre: The aquaporin family of water channels in kidney. In: Kidney Int 48, 1995, S. 1057–1068. PMID 8569067 (Review).
- I. Sabolić und D. Brown: Water transport in renal tubules is mediated by aquaporins. In: Clin Investig 72, 1994, S. 698–700. PMID 7531521 (Review).
- E. M. Wintour: Water channels and urea transporters. In: Clin Exp Pharmacol Physiol 24, 1997, S. 1–9. PMID 9043798 (Review).
- A. S. Verkman: Mechanisms and regulation of water permeability in renal epithelia. In: Am J Physiol 257, 1989, S. C837–850. PMID 2688434 (Review).
- Anatomie der Nieren: Tubulussystem des Nephrons. nach A. Benninghoff: Makroskopische Anatomie, Embryologie und Histologie des Menschen. 15. Auflage, Verlag Urban und Schwarzenberg, 1993.
- Anatomie der Nieren: Physiologie (Tubuläre Rückresorption). nach A. Benninghoff: Makroskopische Anatomie, Embryologie und Histologie des Menschen. 15. Auflage, Verlag Urban und Schwarzenberg, 1993.
- A. Wehner: Cystatin C als klinischer Parameter zur Erfassung der Nierenfunktion beim Hund. Dissertation, LMU München, 2008.
- E. Dayal: Charakterisierung des Chemokinrezeptors CXCR3 in humanen proximalen Tubuluszellen der Niere. Dissertation, Albert-Ludwigs-Universität Freiburg im Breisgau, 2005.
- Gekle et al., Taschenlehrbuch Physiologie, 2., überarbeitete Auflage, Stuttgart 2015, S. 368.
- H. Lofberg und A. O. Grubb: Quantitation of gamma-trace in human biological fluids: indications for production in the central nervous system. In: Scand J Clin Lab Invest 39, 1979, S. 619–626. PMID 119302.
- A. Grubb u. a.: Serum concentration of cystatin C, factor D and beta 2-microglobulin as a measure of glomerular filtration rate. In: Acta Med Scand 218, 1985, S. 499–503. PMID 3911736.
- A. Saito u. a.: Role of megalin, a proximal tubular endocytic receptor, in calcium and phosphate homeostasis. In: Ther Apher Dial 11, 2007, S. S23–26. PMID 17976080 (Review).
- E. I. Christensen u. a.: Receptor-mediated endocytosis in renal proximal tubule. In: Pflugers Arch 458, 2009, S. 1039–1048. PMID 19499243 (Review).
- M. R. Daha und C. van Kooten: Is the proximal tubular cell a proinflammatory cell? In: Nephrol Dial Transplant. 15, 2000, S. 41–43. PMID 11143986 (Review)
- S. Kantarci u. a.: Mutations in LRP2, which encodes the multiligand receptor megalin, cause Donnai-Barrow and facio-oculo-acoustico-renal syndromes. In: Nat Genet 39, 2007, S. 957–959. PMID 17632512.