Osteochondrosis dissecans
Die Osteochondrosis dissecans (kurz OCD bzw. OD, angloamerikanisch auch Osteochondritis dissecans) ist eine umschriebene Knochenläsion unterhalb des Gelenkknorpels, die im ungünstigen Fall mit der Abstoßung des betroffenen Knochenareals mit dem darüberliegenden Knorpel als freier Gelenkkörper (Gelenkmaus) enden kann. Es verbleibt dann ein Gelenkflächendefekt (Mausbett). Es besteht aber auch die Möglichkeit einer spontanen Ausheilung oder ein Ausheilung unter therapeutischen Maßnahmen. Die OCD kann die meisten großen Gelenke des menschlichen Körpers betreffen, sie tritt aber vor allem im Kniegelenk, im oberen Sprunggelenk und im Ellbogengelenk auf. Aufgrund konzentrierter mechanischer Einwirkung tritt die OD jedoch fast ausschließlich in konvexen Gelenkanteilen wie dem Femurkondylus, der Talusrolle, dem Condylus radialis des Humerus und am Femurkopf auf. Die klassische Osteochondrosis dissecans kommt bei größeren Kindern und Jugendlichen vor, da für die Entstehung noch erhaltene Wachstumsfugen erforderlich sind. OCD bei Erwachsenen ist keine andere Erkrankung, sondern eine Form, die im Jugendalter nicht erkannt wurde, weil sie möglicherweise sehr symptomarm verlief. Dieser Artikel orientiert sich vor allem an der Lokalisation Knie. In der Veterinärmedizin kommt sie insbesondere bei großen Hunderassen (Schulter, Ellbogen, Knie, Sprunggelenk etc.) und bei Mastschweinen vor.
| Klassifikation nach ICD-10 | |
|---|---|
| M93.2 | Osteochondrosis dissecans |
| ICD-10 online (WHO-Version 2019) | |
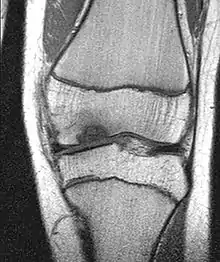
Ätiologie (Ursache)
Von unterschiedlichen, in der Vergangenheit kontrovers diskutierten Entstehungstheorien stellen mechanische Faktoren (repetitive Impulsbelastungen) die wahrscheinlichste Haupt-Ursache dar. Daher sind auch aktive bis hochaktive Kinder und Jugendliche am häufigsten betroffen. Ohne intensive sportliche Aktivitäten treten osteochondrotische Veränderungen am Knie nicht auf. Das trifft auch für die Osgood-Schlatter-Krankheit zu. Möglicherweise spielt bei der (typischen) OCD an der medialen Femurkondyle eine Störung des Bewegungsablaufs beim Rennen und Springen eine entscheidende Rolle. Sehr häufig kann bei den Patienten der OD am Knie eine langjährige und intensive Trampolin-Nutzung erfragt werden. Diese sportliche Besonderheit ist nicht überraschend: Es handelt sich um hoch belastete repetitive Beanspruchung. Bei der selteneren Osteochondrosis dissecans der lateralen Femurkondyle spielt oft eine Meniskuspathologie (z. B. ein Scheibenmeniskus) und möglicherweise auch kindliches Rheuma eine Rolle. Bei der ebenfalls häufigen OCD der medialen Talusschulter im oberen Sprunggelenk handelt es sich um eine echte OCD mit sportbedingter repetitiver Überlastung. Auch hier ist kein isoliertes Trauma zu identifizieren. Bei der Knorpelknochenläsion der lateralen (äußeren) Talusschulter handelt es sich ausschließlich um die Folge wiederholter Umknickverletzungen, damit also um traumatische osteochondrale Flakes, Knorpel-Knochenschuppen mit völlig anderem Therapieansatz. Bei der OCD am Ellenbogen sind armbelastende Wurfsportarten (Handball, Volleyball) aber auch Gitarrenspiel oft ursächlich beteiligt. Aber nicht bei allen OCD-Formen am Ellenbogen lässt sich die mechanische Genese so zweifelsfrei wie am Knie dokumentieren. Welche Rolle die Knochenstruktur und -qualität bei der Entstehung der OCD spielt, ist Gegenstand weiterer Untersuchungen der Osteologie. So findet sich bei fast allen Betroffenen eine Minderversorgung oder ein zum Teil ausgeprägter Vitamin D3-Mangel mit entsprechenden Störungen des Calcium-Stoffwechsels. Die mit dem Vitamin-D3-Mangel assoziierte Knochenstrukturstörung (kalksalzarme osteoidreiche Bälkchen) kann mit einer typischen Frakturheilungsstörung (Pseudarthrose) zum Bild der OCD beitragen. Es handelt sich bei der Osteochondrosis dissecans damit nicht, wie lange vermutet wurde, um eine Osteonekrose, der Knochen ist nicht abgestorben (nekrotisch), sondern nur strukturverändert. Der von der OCD befallene Gelenkteil (Maus) kann aufgrund der repetitiven mechanischen Beanspruchung nicht einheilen, sondern löst sich zunehmend. Vitamin-D3-Minderversorgung spielt bei dieser Heilungsstörung eine entscheidende Rolle.

Durchblutungsstörungen der epiphysären Wachstumsfuge spielen nach aktuellen Untersuchungen aus der Veterinärmedizin ursächlich für die Erkrankung OCD eine zentrale Rolle:[1] Für das Verständnis ist von großer Bedeutung, dass die knorpelige Wachstumsfuge (rot) nicht nur zum Oberschenkelschaft für das Längenwachstum wichtig ist, sondern auch als geschlossene Schicht auf dem knöchernen Epiphysenkern für das Dickenwachstum der Femurkondylen (Abb. gelbe Pfeile). Auf dieser knorpeligen epiphysären Wachstumsfuge liegt der gefäßfreie Gelenkknorpel. Die Wachstumsfuge ist aber von der Knochenseite (dem Epiphysenkern) her durchblutet und die Gefäße sind bei mechanischen Einwirkungen (Scherbelastungen) gefährdet.[2] Untersuchungen bei Fohlen und Ferkeln zeigen, dass es zu Knorpelnekrosen der Wachstumszone unter dem Gelenkknorpel kommt. Diese Nekrosezonen gelangen wie der umgebende Wachstumsknorpel im Verlauf des normalen Wachstums in die epiphysäre Knochenzone und markieren sich dort als knöcherne Osteochondrose-Zone. Damit sind sie erstmals kontrastarm im Röntgenbild sichtbar. Erst einige Zeit (Monate bis Jahre) nach Auftreten der Knorpelnekrose und Entstehung eines knöchernen OCD-Herdes treten die typischen belastungsabhängigen Schmerzen auf, die dann wiederum die Diagnosestellung ermöglichen.
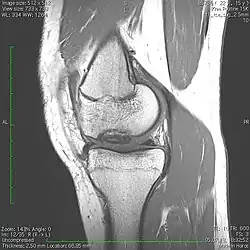
Pathogenese (Krankheitsverlauf)
Die Erkrankung entsteht möglicherweise auf dem Boden einer knöchernen Strukturstörung unterhalb des Gelenkknorpels (subchondrale Vaskularisationsstörung). Diese findet im Grenzbereich zwischen Gelenkknorpel und Wachstumsknorpel um den Epiphysenkern statt. (Lit. Olstad et al.) Am Anfang kommt es in diesem Bereich zu einer Chondronekrose, später zu einer bindegewebigen Demarkation (Abstoßung) gegenüber dem vitalen umgebenden Knochen. Dann scheint eine Heilungsstörung im Sinne einer Pseudarthrose der entscheidende Vorgang zu sein. Das einmal gelöste Dissekat heilt unter der mechanischen Beanspruchung nicht wieder ein. Der dem Osteochondroseherd aufliegende Gelenkknorpel zeigt anfänglich keinerlei Veränderungen, er ist vital und mechanisch stabil, weil seine (normale) Ernährung durch die Gelenkflüssigkeit Synovia unverändert sichergestellt ist. Später kommt es aufgrund der instabiler werdenden knöchernen Unterlage und einer Volumenzunahme durch lockeres, wasserreiches Gewebe im Grenzbereich zwischen Dissekat und Lagerknochen zu sekundären Knorpelveränderungen in Form von Überdehnungen und Einrissen an den Rändern der betroffenen Zone. Diese Konturveränderungen (Vorwölbung oder Buckelbildung) der effektiven Gelenkoberfläche kann durch Einklemmung (Impingement) nun erstmals zu Gelenk-Blockaden führen. Unter fortlaufender Beanspruchung kommt es dann zu einer Lockerung des knorpeltragenden Knochens aus der vitalen Umgebung und nach Riss der elastischen Knorpeldecke in der Spätphase zu einer Lösung des gesamten Knorpel-Knochenstücks und damit zur Gelenkmaus (Dissekat). Das Dissekat kann je nach Gelenkschluss lange im Mausbett verbleiben (häufig beim Sprungbein (Talus) und beim Femurkopf) oder akut dislozieren (öfter an der Femurkondyle), d. h. durch Gelenkbewegung aus dem Mausbett in andere Teile der Gelenkhöhle verschoben werden. Dieses Stadium der Dissektion gibt der Erkrankung den Namen (dissecans): Früher, vor Einführung der Röntgen- und Kernspin-Untersuchung, wurde die Krankheit erst durch die Ablösung der „Maus“ und die dadurch ausgelöste Blockierung erkannt. Im letzten Stadium der Erkrankung (der Dissektion) kann das Knorpel-Knochenfragment sich auch zerlegen und in kaum nachweisbare Teile zerfallen. Es verbleibt auf jeden Fall bei der Dissektion ein relevanter, der Mausgröße entsprechender Gelenkflächendefekt (Mausbett).
Klinik (Beschwerden)
Erste Beschwerden treten bei Kindern und Jugendlichen ab ca. dem 8. Lebensjahr bis etwa 15 Jahre als unspezifische belastungsabhängige Schmerzen am betroffenen Gelenk auf. Diese werden von Ärzten, Eltern und Trainern oft als Verletzungsfolgen, Wachstumsschmerzen oder Rheuma fehlinterpretiert. Die Dauer von den ersten Beschwerden bis zur definitiven Diagnosestellung beträgt heute immer noch etwa ein Jahr. Morgendliche Beschwerden kommen nie vor, sie treten immer nur während und/oder nach sportlicher Aktivität auf. Typischerweise muss der Sport aufgrund der Schmerzen oft eingestellt werden (Die Kinder sitzen nach der Halbzeit auf der Auswechselbank). Konsequente Sportpause oder Entlastung mindert die Beschwerden. Ein Gelenkerguss (dickes Knie) oder eine Weichteilschwellung (teigige Schwellung) gehört nicht zu den Zeichen der OCD, es handelt sich ja zunächst nicht um eine Gelenkerkrankung, sondern um eine Erkrankung am Knochenkern der Femurkondyle. Es kann auch nicht der Schmerzpunkt genau lokalisiert werden, also mit dem Finger draufgezeigt werden. Der Schmerz wird eher dumpf und ziehend tief im Knochen angegeben. Nach Ablösen einer Gelenkmaus ist die OD eine Gelenkerkrankung. Das Dissekat der Gelenkfläche kann einklemmen und es kommt zur Gelenksperre (Blockierung) und plötzlich einsetzenden heftigen Schmerzen wie bei einem großen Meniskusriss. Mechanische Symptome (Blockaden, Streckhemmung) zusätzlich zu Schmerzen sind immer ein Warnsignal und ein Hinweis auf eine bereits vorliegende Gelenkflächenveränderung, eine Instabilität oder auf eine beginnende Dissektion (Abstoßung) des Knorpel-Knochen-Fragmentes. In seltenen Fällen finden sich ausgeprägte OD-Befunde ohne jede Beschwerdesymptomatik. Eine Häufung dieses besonderen schmerzarmen Verlaufs findet sich bei Kortison-Therapie z. B. für Asthma bronchiale oder im Rahmen einer Chemotherapie bei Kinder z. B. wegen einer ALL.
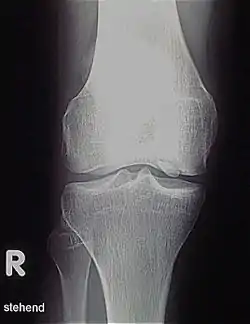
Diagnose
Die Erkrankung kann zufällig auf einem Röntgenbild entdeckt werden, das nach einem Unfall von der Knieregion, vom Sprunggelenk oder vom Ellbogen angefertigt wird. Bei typischen Beschwerden von aktiven Kindern und Jugendlichen kann mit einem solchen einfachen Röntgenbild die eindeutige Diagnose schon gestellt werden, weil der veränderte Knochen unterhalb der Gelenkoberfläche an typischer Stelle in der Oberschenkelrolle am Knie identifiziert werden kann. Manchmal kann eine sogenannte Tunnelaufnahme mit gebeugtem Knie die Schädigungszone noch besser zeigen. Zur genaueren Analyse sollte eine Kernspintomographie (MRT) durchgeführt werden. An den dabei erzeugten Bildern lässt sich die Lage und Größe des Befundes, die Tiefenausdehnung und vor allem eine Beteiligung des darüberliegenden Knorpels genau ausmessen. Es sind damit auch Aussagen zur Stabilität des Befundes zu treffen. Daraus ergeben sich dann entscheidende Anhaltspunkte für therapeutische Konsequenzen. Für die Verlaufsbeurteilung der Erkrankung eignet sich am besten das MRT, aber ggf. auch wieder die einfache Röntgenuntersuchung. Aufgrund der hohen Kosten für das MR in den USA werden die Verläufe dort weitgehend nur mit Röntgenbildern dokumentiert, was zu eigenen Empfehlungen zur Verlaufsbeurteilungen führt. Generell sind aber die MR-Untersuchungen das Verfahren der Wahl. Sie erlauben eine differenzierte Beurteilung der unterschiedlichen Kriterien für Ausheilung, Instabilität und drohende Dissektion. Untersuchungen mit Sonographie können zuverlässige, aber nur orientierende Befunde am Femurkondylus erheben. Es ist damit zum Beispiel ein schneller, kostengünstiger und sicherer Ausschluss des Befalls auch der Gegenseite möglich.
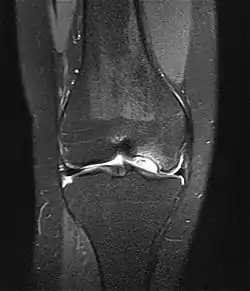
Therapie
Allgemeines
Die Therapie der Osteochondrosis dissecans am Kniegelenk ist zunächst abhängig von der relativen Größe der Läsion im Vergleich zur Kondyle. Es gibt OCD an der medialen und an der lateralen Oberschenkelrolle (Kondyle). Selten kommt die Veränderung auch am Gleitlager gegenüber der Kniescheibe und an der Kniescheibe selber vor. Ein weiteres wichtiges Entscheidungskriterium ist das Stadium (stabil / instabil) der Läsion. Als Instabilitätszeichen tritt im MRT eine Zystenbildung, eine Vorwölbung des Knorpel-Knochen-Dissekates, ein Bruch der subchondralen Knochenlamelle und eine Rissbildung im Knorpel deutlich hervor. Ein wichtiges klinisches Symptom einer Instabilität des OD-Herdes ist eine Blockierung in der Gelenkfunktion, die als Zeichen der Beteiligung der Gelenkfläche an dem Erkrankungsprozess auftreten. Zusätzlich spielt das Alter des Patienten eine gewisse Rolle. Bei noch weit offenen Wachstumsfugen – also bei Jungen bis zum 14. und bei Mädchen bis zum 13. Lebensjahr – sind die spontanen Heilungsaussichten besser. Im Durchschnitt heilen bei allen Studien 50 % der OCD-Fälle am Kniegelenk ohne operative Maßnahmen aus. Die Ausheilung erfordert immer Monate bis Jahre, weil der notwendige Knochenumbau (Remodeling) durch Osteoklasten und Osteoblasten lange Zeit in Anspruch nimmt. Hierzu müssen ja knöcherne Strukturen aufgelöst, abtransportiert und wieder aufgebaut werden.
Konservative Therapie
Zunächst sollte, außer bei dissezierten oder dissektionsgefährdeten (instabilen) Befunden und bei Befunden mit einer relevanten Zystenbildung, ein konservativer Versuch ohne Operation für mindestens 3–6 Monate gemacht werden. Hierzu wird die mechanische Beanspruchung des betreffenden Gelenkes massiv reduziert durch ein konsequentes Sportverbot. Hier spielt eine gute Kooperation von Arzt, Eltern und Patient eine entscheidende Rolle (Triade). Bei nachhaltigen Beschwerden kann auch eine Entlastung an Unterarmgehstützen bei Läsionen am Knie oder am Sprunggelenk bis zum Abklingen der Schmerzen notwendig werden. Ruhigstellungen von Gelenken, z. B. im Gipsverband oder Entlastungen mit z. B. einer Thomasschiene, finden bei aktuellen Behandlungskonzepten keine Anwendung mehr.
Unabhängig von den chirurgischen Aspekten der Therapie ist eine Therapie des allfälligen Vitamin D3 Mangels angezeigt. Am sichersten ist die vorherige Laboruntersuchung des Calcium-Stoffwechsel. Unabhängig davon empfiehlt die Deutsche Gesellschaft für Ernährung seit wenigen Jahren für jeden Menschen in Deutschland ab dem 1. LJ bereits eine Basisversorgung von 800E pro Tag. Als Therapie bei bestehender Osteochondrosis dissecans müssen mindestens 2000 E pro Tag verabreicht werden. Alternativ können auch einfacher nach osteologischer Empfehlung 20.000 E pro Woche angesetzt werden. Diese Basismaßnahme ist auch bei chirurgischer Therapie angezeigt.
Operative Therapie

Bei anhaltenden oder trotz konsequenter Sportpause zunehmenden Beschwerden am Knie oder Sprunggelenk, besonders bei Neuauftreten von mechanischen Symptomen wie Blockierungen oder Gelenkschnappen und bei Größenzunahme oder Instabilitätshinweisen im MRT ist eine Gelenkspiegelung (Arthroskopie) des betreffenden Gelenkes empfohlen, um den Zustand des Gelenkknorpels beurteilen zu können, was mit der Kernspintomographie nicht zuverlässig gelingt. Harte Kriterien für eine Operation sind ein großer Herd, Zystenbildungen über 2,3 mm und Instabilitätszeichen im MR.
Ist bei der arthroskopischen Diagnostik der Knorpel intakt und gelenkseitig noch keine Abgrenzung des betroffenen Bereichs zu erkennen, ist eine retrograde (von außerhalb des Gelenkes) oder anterograde (von der Gelenkfläche und durch den Knorpel) Anbohrung der Schädigungszone zur Revitalisierung des Knochens angezeigt. Für die retrograde Bohrung werden spezielle kanülierte Bohrer verwendet, bei denen mit einem Führungsdraht zunächst die korrekte Lage im Durchleuchtungs-Röntgenbild kontrolliert und dann definitiv überbohrt wird. Durch die Bohrlöcher können Gefäße, Wachstumsfaktoren und Stammzellen in den veränderten knöchernen Bereich eindringen und so die OD-Schuppe wieder mit dem umgebenden Knochen verheilen lassen.
Ist der betroffene Bereich noch nicht abgelöst, aber eine beginnende Abgrenzung erkennbar, kann man durch einen Bohrkanal eine retrograde Spongiosaplastik oder durch den abgehobenen Befund (Knorpel-Knochen-Deckel) eine offene Knochentransplantation und Bohrung durchführen. Dieses Verfahren findet besonders bei den hartnäckigen Befunden am Sprungbein (Talus) Anwendung, die selten spontan ausheilen.
Bei gelockertem oder gelöstem instabilem Dissekat ist die Refixierung (Wiederanheftung) des Dissekates bei jugendlichen Patienten zusätzlich zu einer Anbohrung im umgebenden Knochen immer angezeigt. Hier ist die Einheilungrate sehr gut. Hierzu werden vorzugsweise resorbierbare Pins verwendet, nachdem früher Mini-Schrauben aus Titan Verwendung fanden. Diese mussten aber nach Ausheilung wieder durch Operation entfernt werden. Das gelöste Dissekat und das „Mausbett“ muss dazu angefrischt und mögliche Substanzdefekte mit autologer Spongiosa aufgefüllt werden. Bei zerstörtem oder abgestorbenem Dissekat ist meist bei Erwachsenen eine Knochen-Knorpeltransplantation die Therapie der Wahl. Diese Operationen werden im Gegensatz zu den reinen Anbohrungen offen über eine Gelenkeröffnung (Arthrotomie) durchgeführt. Der Vorteil der Knorpel-Knochentransplantation ist die Verwendbarkeit auch bei tiefen knöchernen Läsionen, wie sie bei OCD häufig zu finden sind. Hierbei entstehen allerdings Entnahmedefekte. Über die geeignete Technik siehe Abschnitt über die osteochondrale Transplantation
Neuere Verfahren der Knorpelzelltransplantation wenden die Transplantation im Labor gezüchteter körpereigener (autologer) Knorpelzellen in die Knorpeldefekte unter einer Schutzschicht aus körpereigener Knochenhaut oder von collagenen Matrixvliesen als autologe Chondrozyten-Transplantation (ACT) oder in Matrixsubstanzen als matrix-assoziierte Chondrozytenimplantation (MACI) an. Erfolgreich ist inzwischen auch die zellfreie Implantation von collagener Matrix in das knöchern vorbereitete Defektlager als AMIC (autogene matrixinduzierte Chondrogenese). Vorteilhaft ist hier das Vermeiden der zeit- und kostenaufwendigen Zellzüchtung mit bekannt nur unvollständiger kompletter Differenzierung zu Knorpelzellen. Bei tiefen knöchernen Nekrosezonen sind diese Verfahren der Knorpelregeneration allein allerdings nicht geeignet. Es muss zusätzlich eine autologe (körpereigene) Spongiosatransplantation unter der Knorpelschicht durchgeführt werden.
Aktuelle Konzepte bei nicht refixierbaren Dissekaten verfolgen die Entnahme derselben und Aufarbeitung zur Wiederverwendung der Knorpelschicht durch Zerkleinerung mit dem Messer (Minced Cartilage). Diese Knorpelmasse wird dann in den Knorpeldefekt, ggf. auch auf einer Spongiosatransplantation, eingebracht. Hier können Collagenmembranen zur Abdeckung und Fibrinkleber hilfreich sein. Die bisherigen Ergebnisse sind vielversprechend, vor allem da auf eine aufwendige Knorpel-Zell-Züchtung verzichtet werden kann und das Knorpelmaterial sich in einem optimalen Differenzierungsstatus befindet.
Weiterhin versuchen einige Gruppen, mit einer extrakorporalen Stoßwellentherapie das Dissekat wieder zu revitalisieren, sofern es sich noch nicht als Gelenkmaus abgespalten hat. Andere Gruppen versuchen eine hyperbare Sauerstofftherapie. Wissenschaftliche Belege für den Erfolg gibt es bei diesen beiden Ansätzen nicht.
Ergebnisse
Je jünger der Patient ist, umso besser ist die Prognose der Heilung. Patienten nach dem Verschluss der Wachstumsfugen (je nach Geschlecht 15–17 Jahre) haben deutlich schlechtere Chancen für eine Heilung ohne Operation. Das Ziel der Behandlung ist eine vollständige Wiederherstellung der Struktur und Funktion des betroffenen Gelenks. Dazu ist eine Einheilung und eine Umstrukturierung (Remodeling) der veränderten Knochenareale Voraussetzung. Da Knochen generell völlig narbenfrei und in physiologischer Struktur ausheilen kann und umbaut, sind primär keine anatomischen oder mechanischen Restschäden zu erwarten, solange die knorpelige Gelenkoberfläche nicht betroffen ist. Kleinere und stabile Befunde bei Jugendlichen können sich unter konsequenter Sportpause in frühestens einem Jahr spontan zurückbilden bzw. ausheilen. Bei größeren, ebenfalls stabilen, nicht dissezierten Befunden kann trotz operativer Maßnahmen (Anbohrung) die Heilung mehrere Jahre in Anspruch nehmen. Bei Stillstand der konservativen Therapie ist eine Operation zu planen. Die Kriterien der Beurteilung lassen sich dazu nur zuverlässig im MR finden. Nach Ausheilung solcher Befunde sind die Ergebnisse meist als sehr gut und gut zu bezeichnen. Eine einmal ausgeheilte OD tritt nie erneut wieder auf. Der Grund ist die schon Jahre zurückliegende Genese als Durchblutungsstörung des Wachstumsknorpels, der zum Zeitpunkt der Ausheilung bereits vollständig in Knochen übergegangen ist.
Instabile Erkrankungen, bei denen ein osteochondrales Dissekat teilweise oder komplett aus dem Gelenkverbund gefallen ist, ist das Ziel die anatomische Einpassung des Gelenkteils in das „Mausbett“ und seine stabile Fixierung. Das Mausbett und das Dissekat werden zunächst mit scharfen Instrumenten von allem lockeren Gewebe befreit, bis die knöcherne Basis erreicht wird. Anschließend wird von der Kontaktfläche weit in den gesunden Knochen gebohrt, um auch hier Gefäßen und Stammzellen das Einwachsen zu ermöglichen. Dann wird der durch die Entfernung des lockeren Gewebes entstandene Knochendefekt durch ein Knochentransplantat aufgefüllt. Die Dissekatschuppe wird dann mit mehreren resorbierbaren Polymerstiften mechanisch stabil fixiert. Hier können bei optimaler Technik auch gute und zum Teil sehr gute Ergebnisse erreicht werden.
Einbau- und Umbauvorgänge dauern beim Knochen sehr lange (Jahre). Die Belastbarkeit eines solchen betroffenen und operierten Gelenks ist für viele Monate deutlich eingeschränkt.
Ebenfalls gute Ergebnisse lassen sich bei dissezierter Osteochondrose mit Verlust oder Zerfall des Dissekates erzielen, wenn eine osteochondrale Transplantation von einem Knorpel-Knochen-Zylinder aus einem wenig belasteten Gelenkareal in den Defektbezirk durchgeführt wird. Hier bieten sich der Notcheingang (Rand der Zone zwischen den Femurkondylen, die durch die Kreuzbänder belegt ist) sowie die hintere (dorsale) Kondyle an. Ausschließlich autologe Knorpelzelltransplantationen können den knöchernen Defekt nicht ausgleichen und eignen sich daher nicht für tiefgreifende Schäden der Gelenkflächen. Die Ergebnisse von Zelltransplantationen sind daher nur im Zusammenhang mit gleichzeitigen Knochentransplantationen oder durch Verwendung von synthetischen Matrixsubstanzen der osteochondralen Transplantation vergleichbar.
Literatur
- Krause M., Korthaus A., Meenen N.M.: Juvenile Osteochondrosis dissecans am Knie. In: Engelhardt M., Raschke M. (eds) Orthopädie und Unfallchirurgie: 1-14. Springer Reference Medizin. Springer, Berlin, Heidelberg, 2020, doi:10.1007/978-3-642-54673-0_218-1.
- M. Krause, D. Lehmann, M. Amling, T. Rolvien, KH. Frosch, K. Püschel, K. Bohndorf, NM Meenen: Intact Bone Vitality and Increased Accumulation of Nonmineralized Bone Matrix in Biopsy Specimens of Juvenile Osteochondritis Dissecans: A Histological Analysis. In: Am J Sports Med 2015 43, 6: 1337. 2015, doi:10.1177/0363546515572579 (englisch).
- M. Krause, A. Hapfelmeier, M. Möller, M. Amling, K. Bohndorf, N. M. Meenen: Healing Predictors of Stable Juvenile Osteochondritis Dissecans Knee Lesions After 6 and 12 Months of Nonoperative Treatment. In: Am J Sports Med. 2013 Jul 22. 2013, PMID 23876519 (englisch).
- Eric J. Wall, Jason Vourazeris, Gregory D. Myer, Kathleen H. Emery, Jon G. Divine, Todd G. Nick, Timothy E. Hewett: The Healing Potential of Stable Juvenile Osteochondritis Dissecans Knee Lesions. In: The Journal of Bone & Joint Surgery (American Edition). Band 90, Nr. 12. JBJS, Needham, MA 2008, S. 2655–2664, doi:10.2106/JBJS.G.01103, PMID 19047711 (englisch).
- N. M. Meenen, B. Rischke: Autogene osteochondrale Transplantation (AOT) bei Knorpeldefekten am Femurkondylus. In: Operative Orthopädie und Traumatologie. Band 15, 2003, S. 38–56, doi:10.1007/s00064-003-1061-z.
- J. P. Petersen, A. Ruecker, D. von Stechow, P. Adamietz, R. Poertner, J. M. Rueger, N. M. Meenen: Present and future therapies of articular cartilage defects. In: European Journal of Trauma. Band 29, Nr. 1, 2003, S. 1–10, doi:10.1007/s00068-003-1215-6.
- K. Baumbach, J. P. Petersen, P. Ueblacker, J. Schröder, C. Göpfert, A. Stork, J. M. Rueger. M. Amling, N. M. Meenen: The fate of osteochondral grafts after autologous osteochondral transplantation: a one-year follow-up study in a minipig model. In: Arch Orthop Trauma Surg. Band 128, Nr. 11, 2008, S. 1255–1263, PMID 18064477 (englisch).
- K. Olstad, B. Ytrehus, S. Ekman, C. S. Carlson, N. I. Dolvik: Early Lesions of Articular Osteochondrosis in the Distal Femur of Foals. In: Vet Pathol. Band 48. Sagepub, 2011, S. 1165–1175, doi:10.1177/0300985811398250 (englisch).
- K. Olstad, KG Shea, PC Cannamela, JD Polousky, S Ekman, B Ytreus, CS Carlson: Juvenile osteochondritis dissecans of the knee is a result of failure of the blood supply to growth cartilage and osteochondrosis. In: Osteoarthritis Cartilage. Band 26. WB Saunders, London, 2018, S. 1691–1698, doi:10.1016/j.joca.2018.06.019.Epub2018Sep21 (englisch).
- Jungesblut,OD, Berger-Groch,J, Meenen,NM, Stuecker,R, Rupprecht,M.: Validity of Ultrasound Compared with Magnetic Resonance Imaging in Evaluation of Osteochondritis Dissecans of the Distal Femur in Children. In: Cartilage. Febr. Sagepub, 2019, S. epub ahead of print, doi:10.1177/1947603519828434 (englisch).
Einzelnachweise
- Identification of Areas of Epiphyseal Cartilage Necrosis at Predilection Sites of Juvenile Osteochondritis Dissecans in Pediatric Cadavers 2018 F Toth, MA Tompkins, KG. Shea, JM. Ellermann CS. Carlson J Bone Joint Surg Am. 100:2132-9 PMID 30562294
- Juvenile osteochondritis dissecans of the knee is a result of failure of the blood supply to growth cartilage and osteochondrosis Olstad K, et al.2018 Osteoarthritis and Cartilage 26:1691-1698 PMID 30248503
Weblinks
- Die Abbildungen in den Commons entsprechen nicht in allen Details den aktuellen Vorstellungen der Erkrankung, besonders seit sich gezeigt hat, dass es sich nicht um eine Osteonekrose, sondern um eine Einheilungsstörung handelt.