Knochendichte
Unter der Knochendichte (auch Knochenmineraldichte, englisch Bone density, bone mineral density (BMD)) versteht man das Verhältnis der mineralisierten Knochensubstanz zu einem definierten Knochenvolumen.
Grundlagen
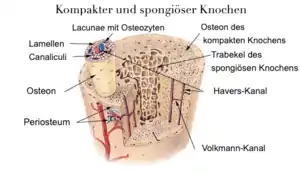
Der Knochen besteht aus einer harten Schicht (Substantia corticalis) und einer mineralischen Schicht (Substantia spongiosa). Letztere wird durch Einlagerung von Calciumphosphat in Form von unvollständig kristallinem Hydroxylapatit in die organische Knochenmatrix gebildet. Unvollständig kristallines Carbonatapatit [Ca10(PO4)6(OH)2] bzw. Knochenapatit ist die Hauptmineralkomponente des Knochens.[1] Eine der Strukturen, aus denen die mineralische Schicht des Knochens besteht und Schläuchen ähnelt, wird als Havers-Kanal bezeichnet. Diese Struktur dient unter anderem der Nährstoffversorgung, die das Knochensystem benötigt. Dünne Platten, Lamellen genannt, die das Knochenmark des Knochens enthalten, umgeben den Havers-Kanal. Im gelben Knochenmark (Fettmark, lateinisch Medulla ossium flava) sind besonders große Mengen Fett in die Retikulumzellen eingelagert. Im roten Knochenmark (lateinisch Medulla ossium rubra) finden sich die blutbildenden Zellen. Die harte Knochenschicht besteht aus Kollagen. Diese Schicht macht 70 % der Knochendichte bei Erwachsenen und 30 % bei Kindern aus. Drei Zellarten bilden den Funktionsteil des Knochens, die Osteoblasten, Osteozyten und Osteoklasten. Howship-Lakunen entstehen durch die Resorption von Knochensubstanz an den Oberflächen der Trabekel (Knochenbälkchen) der Substantia spongiosa. Sie sind Zeichen des ständig stattfindenden Knochenumbaus. Aktive Osteoklasten-Gruppen fressen sich durch den Knochen, wo ein Umbau nötig ist. Durch Osteoblasten werden neue Knochenlamellen gebildet. Das Ergebnis dieses Prozesses wird als Knochenumsatz (englisch Bone turnover) bezeichnet. Die Osteozyten kontrollieren den Mineralstoffhaushalt im Körper.[2]
Einflüsse auf die Knochendichte
Knochengewebe ist ein sehr aktives Gewebe, das ständig auf- und abgebaut wird, womit jedes Jahr 20 bis 40 Prozent des Skeletts erneuert wird. Im Wachstumsalter nimmt die Knochenmasse zu und erreicht mit etwa 20 Jahren ihren Höchststand (englisch Peak Bone Mass, pbm). Die Knochendichte unterliegt zahlreichen hormonellen Einflüssen, unter anderem des Wachstumshormons Somatropin, der Sexualhormone und der Steroidhormone. Die beiden mechanischen Hauptfunktionen des Skeletts bestehen darin, den Muskeln einen Hebel zur Kraftentfaltung zu geben und den Körper gegen die Schwerkraft zu stützen. Knochenwachstum und Knochenabbau werden durch die maximale elastische Verformung des Knochens bestimmt, die das Mechanostat-Modell beschreibt.[3] Um diese Funktionen dauerhaft zu erfüllen, muss das Skelett seinen Aufbau gemäß dem Wolffschen Gesetz immer wieder geringfügig an neue mechanische Anforderungen adaptieren. Diese Anpassungsprozesse werden Mechanotransduktion genannt, mit der sich die Knochendichte an den einzelnen Knochen verändert. Dabei werden mechanische Signale in zelluläre Signale umgewandelt.[4] Die durch mechanische Stimulation bedingten Scherkräfte werden von den Osteozyten wahrgenommen und führen zu einer Modulation der Freisetzung verschiedener, für das Gleichgewicht des Knochenstoffwechsels wesentlicher Mediatoren. Die Folge ist eine Steigerung der Osteoblasten- und eine Hemmung der Osteoklastenaktivität.
Eine normale Knochendichte liegt bei 150 mg/ml mit einer Standardabweichung von 20 mg/ml für beide Geschlechter und unabhängig vom Alter bis zum Eintritt in die Pubertät.
Die trabekuläre Peak Bone Mass in der Lendenwirbelsäule ist bei männlichen Probanden höher als bei weiblichen, die Knochendichte zum Zeitpunkt der Peak Bone Mass ist bei weiblichen Probanden höher als bei männlichen.[5]
Entwicklung der Knochendichte
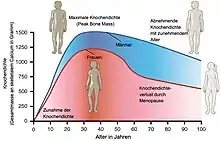
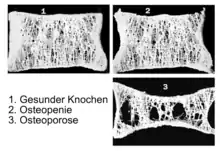
Im Alter zwischen 20 und 30 Jahren hält sich der Knochenabbau mit dem Knochenaufbau etwa die Waage. Danach überwiegt der Abbau, wobei der physiologische Knochenschwund etwa 0,3 bis 0,5 Prozent der Knochenmasse pro Jahr beträgt. Mit 50 Jahren hat man somit bereits 6–10 Prozent weniger Knochenmasse, so dass das Skelett bruchanfälliger wird. Frauen verlieren nach dem Klimakterium („Wechseljahre“) mit Abfall des Östrogenspiegels jährlich 1 bis 2 Prozent ihrer Knochendichte, was zur Osteopenie beziehungsweise zur Osteoporose führen kann.[6] Dieser Knochenschwund ist offensichtlich genetisch vorprogrammiert. Östrogen liegt als natürlicher Suppressor des Proteins Receptor Activator of NF-κB Ligand (RANKL) nicht mehr in ausreichender Menge vor. RANKL ist wesentlich an der Regulation des Knochenumbaus, insbesondere der Osteoklastendifferenzierung, beteiligt, die die Knochendichte verringert.[7]
Knochendichte bei Astronauten

Während eines Raumflugs entwickelt sich bei Raumfliegern durch die Schwerelosigkeit eine kontinuierlich fortschreitende negative Calciumbilanz. Bei der Skylab-Besatzung erreichte der Calciumverlust am Flugtag 84 etwa 300 mg/d. Der daraus resultierende mittlere Verlust an Knochendichte (Wirbel, Femurhals, Trochanter, Beckenknochen) betrug – trotz extremem Trainingsprogramm an Last tragenden Knochen – 1 % bis 1,6 % pro Monat, jedoch bei großen individuellen Unterschieden.[8] Nach dem Flug erholte sich die Knochendichte langfristig wieder. Nach einem 30-monatigen Marsflug würde bereits eine ausgeprägte Osteoporose drohen.[9][10][11]
Knochendichte bei Implantaten
Ein starker periprothetischer Knochendichteverlust findet innerhalb der ersten 3 Monate nach Implantation einer Hüftendoprothese statt. Dieser rasche Verlust an Knochendichte ist auch Folge der initialen operativen Irritationen und der Immobilisation des Patienten. Er wird außerdem durch den veränderten Kraftfluss mit Stress-Shielding sowie Ent- und Minderbelastung der operierten Extremität verursacht. Nach dem Wolffschen Gesetz wird ein Knochen sich immer seiner Funktion anpassen und bei geringer Last degenerieren.[12] Besonders auffällig ist die erhebliche Abnahme der Knochendichte im proximalen Teil des Femurs in der Region des Calcar femoris (Verdickung in der dorsalen Hälfte des proximalen Femurs). Nach dem initialen Remodelling-Prozess, der 12 Monate bis 2 Jahre andauert, ist dann kein relevanter Knochendichteverlust mehr festzustellen und es stellt sich ein sog. Steady state der Knochendichte ein.[13]
T-Score und Z-Score
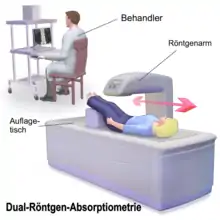
Die Bestimmung der Knochendichte erfolgt mittels der Knochendichtemessung (Osteodensitometrie). Gemessen wird der Knochenmineralgehalt (englisch Bone mineral content) in Gramm beziehungsweise die Knochenmineraldichte (englisch Bone mineral density) in g/cm² oder g/cm³, je nach Verfahren der Knochendichtemessung.[14] Der Messwert liefert keine Information über die dreidimensionale Geometrie des Messobjektes und somit keine Dichtewerte im physikalischen Sinne (SI-Einheit der Dichte: g/cm³), sondern eine flächenprojizierte Masse (SI-Einheit: g/cm²), auch als Flächendichte bezeichnet.
Zu den etablierten Untersuchungsverfahren zählen die Dual-Röntgen-Absorptiometrie (englisch Dual-energy X-ray absorptiometry, DXA, DEXA) und die quantitative Computertomographie (qCT).[15] Der T-Score gibt die Standardabweichung des altersabhängigen Mittelwerts des Peak Bone Mass an (Normwert T>−1,0). Es wird zusätzlich ein sogenannter Z-Score angegeben, der sich auf gesunde Männer bzw. Frauen gleichen Alters bezieht. Ein normaler Z-Score (>−1) zeigt an, dass die Knochendichte alterstypisch ist.
- Ein T-Score von ≥ −1 gilt als normal.
- Bei einem T-Score zwischen −1 bis −2,5 liegt noch keine Osteoporose vor, allerdings bereits eine Vorstufe, die sogenannte Osteopenie.
- Ein T-Score von < −2,5 führt zur Diagnose Osteoporose.
Neben dem reinen Messwert sind Faktoren wie Alter und Geschlecht maßgeblich.
Pathologische Knochendichteveränderungen
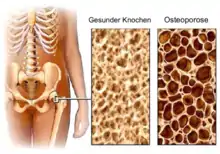
Die Knochendichte kann generalisiert oder umschrieben vermindert oder vermehrt sein.[16]
- Verminderte Knochendichte besteht bei
- Vermehrte Knochendichte besteht bei
Weblinks
- Leitlinie Osteoporose 2017, AWMV 183/001, Dachverband der deutschsprachigen wissenschaftlichen osteologischen Gesellschaften. Abgerufen am 10. Februar 2019.
Einzelnachweise
- Jörg Jerosch, Augustinus Bader, Günter Uhr: Knochen: Curasan-Taschenatlas spezial. Georg Thieme Verlag, 2002, ISBN 978-3-13-132921-9, S. 34.
- Kathy Donina, Density Of Bone, The Physics Factbook, 2002. Abgerufen am 13. Februar 2018.
- K. Kerschan-Schindl, Das Mechanostat-Modell, J Miner Stoffwechs 2012; 19 (4), S. 159–62.
- R. L. Duncan, C. H. Turner: Mechanotransduction and the functional response of bone to mechanical strain. In: Calcified tissue international. Band 57, Nummer 5, November 1995, ISSN 0171-967X, S. 344–358, PMID 8564797 (Review).
- L. Berthold, G. Haras, M. Mann, G. Alzen: Trabekuläre Knochendichte der Lendenwirbelsäule bei Kindern und Jugendlichen in der quantitativen CT: Referenzwerte und Peak Bone Mass. In: RöFo – Fortschritte auf dem Gebiet der Röntgenstrahlen und der bildgebenden Verfahren. 178, 2006, S. 1235, doi:10.1055/s-2006-927151.
- Peter Echevers H.: Vitamin D: Der Pharma-Skandal. LULU Press Enterprises, 9. September 2013, S. 64. ISBN 978-1-291-52930-2
- Michael McClung: Role of RANKL inhibition in osteoporosis. In: Arthritis Research & Therapy. 9, S. S3, doi:10.1186/ar2167.
- A. LeBlanc, L. Shackelford, V. Schneider: Future Human Bone Research in Space. In: Bone. Band 22, Nummer 5, Supp. 1, Mai 1998, S. 113–116, doi:10.1016/S8756-3282(98)00013-1.
- Jörg Jerosch, Augustinus Bader, Günter Uhr: Knochen: Curasan-Taschenatlas spezial. Georg Thieme Verlag, 2002, ISBN 978-3-13-132921-9, S. 56.
- J. C. Buckey: Preparing for Mars: the physiologic and medical challenges. In: European journal of medical research. Band 4, Nummer 9, September 1999, S. 353–356, PMID 10477498 (Review).
- A. Hawkey: Physiological and biomechanical considerations for a human Mars mission. In: Journal of the British Interplanetary Society. Band 58, Nummer 3–4, 2005 Mar-Apr, S. 117–130, PMID 15852539.
- M. Niinomi, M. Nakai: Titanium-Based Biomaterials for Preventing Stress Shielding between Implant Devices and Bone. In: International Journal of Biomaterials. 2011, S. 1, doi:10.1155/2011/836587.
- Klaus M. Peters, Dietmar Pierre König: Fortbildung Osteologie 2. Springer-Verlag, 2. September 2008, ISBN 978-3-7985-1825-4, S. 70.
- Reiner Bartl: Osteoporose: Prävention – Diagnostik – Therapie; 9 Tabellen. Georg Thieme Verlag, 2004, ISBN 978-3-13-105752-5, S. 46.
- Matthias Angstwurm, Thomas Kia: mediscript StaR 1 das Staatsexamens-Repetitorium zur Kardiologie und Angiologie. Elsevier, Urban & Fischer Verlag, 22. November 2012, ISBN 978-3-437-29441-9, S. 46.
- F. Hefti: Kinderorthopädie in der Praxis. Springer-Verlag, 1. Juli 2013, ISBN 978-3-662-08078-8., S. 648.