Spinalanästhesie
Eine Spinalanästhesie (von lateinisch spinalis, zu Wirbelsäule/Rückenmark gehörig, und Anästhesie) oder Lumbalanästhesie (von lateinisch lumbalis, zu Lende gehörig) ist eine rückenmarknahe Form der Regionalanästhesie. Durch die Injektion eines Lokalanästhetikums (und gegebenenfalls weiterer Medikamente) in den Hirnwasserraum (Subarachnoidalraum) in Höhe der Lendenwirbelsäule wird die Signalübermittlung in den vom Rückenmark ausgehenden Nerven gehemmt. Dadurch wird eine zeitweilige, umkehrbare Blockade des sympathischen Nervensystems, der Sensibilität und der Motorik der unteren Körperhälfte erreicht. Mögliche Nebenwirkungen sind Kreislaufschwankungen, Übelkeit sowie Rücken- und postpunktionelle Kopfschmerzen, die in den Tagen nach dem Verfahren auftreten können. Schwerwiegende Komplikationen (rückenmarksnahe Blutergüsse oder Infektionen, Nervenschäden) sind selten.
Die Ende des 19. Jahrhunderts in die klinische Praxis eingeführte Methode verlor mit den Fortschritten im Bereich der Narkose (Allgemeinanästhesie) an Bedeutung. Im 20. Jahrhundert führten Erkenntnisse über die Vorteile der Regionalanästhesie bei bestimmten Patientengruppen zu einer Renaissance dieser Technik. Als ein Standardverfahren der Anästhesie findet die Spinalanästhesie heute Anwendung bei einer Vielzahl von Operationen am Unterbauch, im Becken, der unteren Extremität sowie in der Geburtshilfe und stellt bei diesen Eingriffen eine Alternative zu anderen rückenmarksnahen Regionalverfahren wie der unter anderem lumbal (im Lendelwirbel- bzw. Lumbalbereich) und thorakal (im Brustwirbelbereich) durchführbaren Periduralanästhesie (Synonym Epiduralanästhesie) und zur Narkose dar.
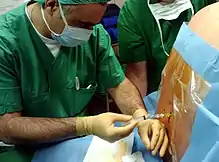
Übersicht über das Verfahren
Anatomische Grundlagen und Prinzip der Spinalanästhesie
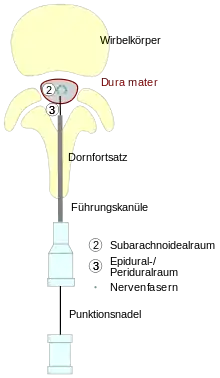
Die Wirbelsäule des Menschen besteht aus 24 Wirbeln, die die mechanische Stabilität der Körperachse gewährleisten. Diese sind durch feste Bänder verbunden und bestehen jeweils aus einem Wirbelkörper, einem Wirbelbogen, der das Rückenmark (1 in der Abbildung) und seine Häute umgibt, sowie zwei Quer- und einem Dornfortsatz an der rückenwärts gerichteten (dorsalen) Seite. Zwischen den Wirbeln treten Spinalnerven aus, die den Körper segmental innervieren und so Motorik und Sensibilität ermöglichen und darüber hinaus auch Fasern des vegetativen Nervensystems führen.
Als Bestandteil des zentralen Nervensystems ist das Rückenmark von den Hirnhäuten umgeben. Von innen nach außen sind dies die weiche Hirnhaut (Pia mater), die direkt dem Rückenmark aufliegt, die Spinnenhaut (Arachnoidea) und als äußere Begrenzung die harte Rückenmarkshaut (Dura mater). Zwischen Pia mater und Arachnoidea liegt der Hirnwasserraum (Subarachnoidalraum, Liquorraum), in dem das Hirnwasser (Liquor cerebrospinalis) zirkuliert.
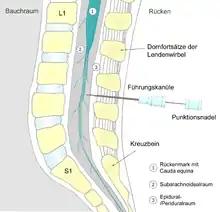
Dieser Liquorraum wird bei der Spinalanästhesie mit einer dünnen Kanüle punktiert, wobei die Nadel die Haut, den Bandapparat zwischen den Dornfortsätzen der Wirbel (Ligamentum supraspinale, Ligamentum interspinale, Ligamentum flavum), den mit Fettgewebe und Gefäßen gefüllten, außerhalb der Hirnhäute liegenden Peri- oder Epiduralraum (3 der Abbildung), die Dura und die Arachnoidea durchdringt und mit der Spitze im Liquorraum (2 der Abbildung) zu liegen kommt. Dort hinein (intrathekal) werden Lokalanästhetika injiziert, die auf Vorder- und Hinterwurzel der Spinalnerven einwirken und deren Fähigkeit zur Übertragung von Nervenimpulsen zeitlich begrenzt aufheben.
Während der Entwicklung des Menschen wächst die Wirbelsäule schneller als das Rückenmark, so dass das Rückenmark (beim Erwachsenen) auf Höhe des ersten/zweiten Lendenwirbels im Conus medullaris endet, die zugehörigen Spinalnerven aber weiter fußwärts (kaudal) ziehen und aus dem Rückenmarkskanal austreten. Sie bilden dabei den Pferdeschweif (Cauda equina). Dieser Umstand erlaubt eine Punktion in Höhe der mittleren Lendenwirbel ohne Verletzung des Rückenmarks.[1]
Abgrenzung zu anderen Verfahren
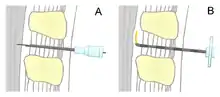
Bei der Spinalanästhesie durchdringt die Nadel die harte Hirnhaut (Dura mater), so dass das injizierte Lokalanästhetikum sich im Liquor cerebrospinalis des Subarachnoidalraumes frei ausbreiten kann und Nervenfasern dort betäubt werden. Bei der Periduralanästhesie hingegen wird die Dura mater nicht durchstochen. Der eingebrachte Katheter kommt außerhalb derselben im Periduralraum zu liegen, so dass das Lokalanästhetikum hauptsächlich außerhalb der Hirnhäute auf die vom Rückenmark abgehenden Spinalnerven einwirkt. Während bei der Spinalanästhesie durch die Verteilung der Medikamente alle Nervenfasern unterhalb der Punktionsstelle und dadurch die gesamte untere Körperhälfte betäubt sind, wird bei der Periduralanästhesie eine Betonung der Anästhesie in den korrespondierenden Dermatomen der Punktionshöhe erreicht.[2]
Bei der Lumbalpunktion wird in gleicher Weise wie bei der Spinalanästhesie der Liquorraum punktiert. Sie dient der Liquordruckmessung und diagnostischen Liquorentnahme, die bei Verdacht auf Infektionen des zentralen Nervensystems, Metastasierung und zur Antikörperdiagnostik durchgeführt wird.[3] Im Rahmen einer Chemotherapie werden mittels einer Lumbalpunktion auch Zytostatika intrathekal injiziert.
Varianten
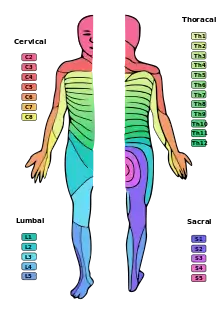
Zumeist wird die Spinalanästhesie als einmalige Injektion (Single Shot) durchgeführt. Dabei wird je nach Ausbreitung der sensorischen Blockade zwischen tiefer (unterhalb Dermatom/Segment Th 12, Höhe der Leiste), mittelhoher (bis Segment Th 10, Höhe Bauchnabel) und hoher (bis Segment Th 4, Höhe der Brustwarzen) Spinalanästhesie unterschieden. Eine Sonderform der Spinalanästhesie ist der Sattel- oder Sakralblock, bei dem sich die Ausdehnung auf die sakralen Spinalnerven, die hauptsächlich den Genitalbereich versorgen (S2–5), beschränkt.
Durch die Einlage eines Katheters können im Gegensatz zur einmaligen Punktion kontinuierlich Medikamente eingebracht (appliziert) werden (kontinuierliche Spinalanästhesie, CSA).[4] Eine weitere Variante ist die Kombination einer Spinal- mit einer Epi/Periduralanästhesie (Kombinierte Spinal- und Epiduralanästhesie, CSE). Dabei wird durch die liegende Periduralnadel eine Spinalnadel vorgeschoben und eine Spinalanästhesie durchgeführt. Im Anschluss wird ein Periduralkatheter in den Periduralraum eingelegt. Durch den liegenden Katheter ist eine bedarfsgerechte Dosierung der Medikamente und auch eine effektive postoperative Schmerztherapie möglich.[5]
Determinanten der Ausbreitungshöhe
Die Wirkhöhe der Spinalanästhesie hängt von der Ausbreitung der injizierten Wirkstoffe im Liquorraum ab. Diese wird primär von der Gesamtdosis und der Dichte (Barizität) der Lokalanästhetika bestimmt. Man unterscheidet isobare Lösungen, die dieselbe Dichte wie der Liquor aufweisen, von hyperbaren Präparationen, die durch den Zusatz von Glukose eine höhere Dichte erreichen. Isobare Lösungen verbleiben großteils im Bereich der Punktionsstelle. Die Dichte ist allerdings leicht temperaturabhängig, so dass durch die Erwärmung im Körper die Ausbreitung schwieriger als bei den hyperbaren Lokalanästhetika vorauszusagen ist. Letztere sinken, der Schwerkraft folgend, nach unten (kaudal) ab, wodurch sich durch die Lagerung des Patienten die Ausbreitung kontrollieren lässt. Durch eine Flachlagerung lässt sich eine der isobaren Anwendung vergleichbare Ausbreitung erreichen, durch Sitzen ein Sattelblock, durch Seitlagerung lässt sich die Anästhesie einseitig betonen. Der Einsatz von hypobaren Lösungen mit geringer Dichte erfolgt nur in Ausnahmefällen.[6][7]
Weitere Faktoren (Determinanten), die die Ausbreitung beeinflussen, sind die individuell stark schwankende Liquormenge und Raumverhältnisse im Liquorraum. Letztere werden von der Statur des Patienten beeinflusst: bei erhöhtem Druck im Bauchraum wie bei Fettsucht (Adipositas), Schwangerschaft oder Aszites ist der Liquorraum komprimiert, die Dosis muss entsprechend verringert werden.[7] Geringere Auswirkungen haben die Geschwindigkeit der Injektion, das injizierte Gesamtvolumen sowie eine absichtliche mehrfache Verwirbelung des Lokalanästhetikums mit dem Liquor (Barbotage).[6]
Verwendete Pharmaka
Die Wirkdauer der Spinalanästhesie ist von den verwendeten Substanzen abhängig. Lokalanästhetika sind die Standardmedikamente zur Durchführung einer Spinalanästhesie. Sie diffundieren in die Nerven, blockieren Natriumkanäle der Zellmembran und verringern dadurch den Einstrom von Natriumionen. Auf diese Weise wird die Bildung von Aktionspotentialen verhindert, eine Signalübermittlung in Nerven ist nicht mehr möglich.
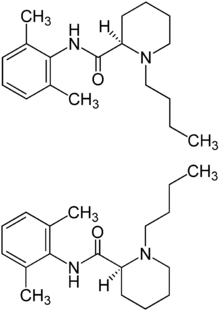
Lidocain war aufgrund der kurzen Anschlagszeit und einer mittellangen Wirkdauer von 60–90 Minuten lange der Standard zur Spinalanästhesie, wird nach Berichten über vorübergehende und bleibende Nervenschäden aber kaum noch eingesetzt.[8] Bupivacain ist ein vielfach eingesetztes Mittel mit längerer Wirkdauer, für das im Gegensatz zu Lidocain nur geringe Raten von Nervenschädigungen beschrieben sind. Es existieren sowohl isobare als auch hyperbare Lösungen. Mepivacain, Prilocain und Ropivacain sind weitere genutzte Alternativen. Procain wird in den Vereinigten Staaten angewendet, in Europa jedoch wenig eingesetzt. Die Wirkdauer von Prilocain und Mepivacain ist mit etwa einer Stunde relativ kurz, was die Anwendung bei kurzen und ambulant durchgeführten Eingriffen attraktiv macht. Als Lokalanästhetikum vom Aminoester-Typ ist bei Procain das Risiko einer allergischen Reaktion jedoch höher als bei den anderen Substanzen, die zu den Aminoamiden gehören.[9]
Durch die Kombination mit weiteren Arzneistoffen („Adjuvanzien“) sollen die Wirkung der Lokalanästhetika verlängert und Nebenwirkungen reduziert werden. Dies wird etwa durch den oft praktizierten Zusatz von Opioiden erreicht. Dazu werden deren fettlösliche Formen, etwa Fentanyl oder Sufentanil, benutzt, die über Opioid-Rezeptoren, die im Hinterhorn des Rückenmarkes lokalisiert sind, wirken. Vereinzelt können typische Opioid-Nebenwirkungen wie Juckreiz, Übelkeit oder ein verminderter Atemantrieb (Atemdepression) auftreten. Wasserlösliche Derivate wie Morphin bewirken eine wesentlich stärkere Atemdepression und müssen daher entsprechend zurückhaltend dosiert werden[10] und der Patient sollte eventuell länger überwacht werden.[11] Der Einsatz von Clonidin[12] oder Ketamin[13] wird seltener praktiziert. Adrenalin, das bei anderen Regionalanästhesieverfahren zu Wirkverlängerung zugesetzt wird, eignet sich nicht zur Anwendung bei der Spinalanästhesie.[14]
Indikationen und Gegenanzeigen
Anwendungsgebiete
Die Spinalanästhesie ist ein Standardverfahren der Anästhesie mit relativ einfacher Durchführung, raschem Wirkeintritt und kompletter Schmerzausschaltung. Sie stellt eine Alternative zur Narkose und der Periduralanästhesie dar, die bei chirurgischen Eingriffen am Unterbauch (beispielsweise Leistenhernien-Operationen), gynäkologischen und urologischen Operationen im Beckenbereich sowie orthopädischen, unfallchirurgischen oder gefäßchirurgischen Eingriffen an der unteren Extremität angewendet werden kann. Die kontinuierliche Spinalanästhesie bietet darüber hinaus die Möglichkeit der fortgesetzten postoperativen Schmerztherapie. Ungeeignet ist die Spinalanästhesie hingegen für Eingriffe am Oberbauch und höher gelegenen Regionen des Körpers.[15]
In der Geburtshilfe ist die Spinalanästhesie zum Kaiserschnitt (Sectio caesarea) ein Standardverfahren. Während noch bis in die 1990er Jahre in Deutschland die Häufigkeit der Vollnarkose überwog, hatte sich bereits 2005 die Spinalanästhesie als bevorzugtes Verfahren deutlich durchgesetzt.[16] Mit einer Spinalanästhesie wird das bei Schwangeren erhöhte Aspirationsrisikos einer Narkose vermieden. Vollnarkosen sind jedoch weiterhin erforderlich, wenn bei einer Notfall-Entbindung die Zeit bis zum vollständigen Wirkeintritt einer Spinal- oder Periduralanästhesie nicht abgewartet werden kann.[17]
Die Spinalanästhesie ist eine Möglichkeit, bei Patienten mit Neigung zu maligner Hyperthermie eine solche Komplikation zu vermeiden, da die Substanzen keine Auslöser (Trigger) für die Erkrankung darstellen. Auch bei zu erwartenden Schwierigkeiten bei der Atemwegssicherung und nicht nüchternen Patienten kann der Spinalanästhesie gegenüber einer Allgemeinanästhesie der Vorzug gegeben werden.[15] Auch Patienten mit obstruktiven Atemwegserkrankungen (Asthma bronchiale, COPD) profitieren vom Verzicht auf eine Narkose.
Es gibt Hinweise, dass durch die rückenmarksnahen Anästhesieverfahren die Rate verschiedener Komplikationen (Beinvenenthrombose, Lungenembolie, Blutverlust, Lungenkomplikationen) und möglicherweise auch die Sterblichkeitsrate gesenkt werden kann,[18] die Datenlage ist jedoch für eine abschließende Beurteilung nicht ausreichend.[19] Auch die Frage, ob die rückenmarksnahen Verfahren bei Patienten mit schweren kardialen oder pulmonalen Vorerkrankungen (Erkrankungen von Herz oder Lunge) Vorteile bieten, wird kontrovers diskutiert. Eine Überlegenheit gegenüber der Allgemeinanästhesie konnte bisher nicht gezeigt werden.[20]
Gegenanzeigen
Absolute Kontraindikationen stellen Unverträglichkeiten gegenüber den eingesetzten Anästhetika, lokale Infektionen im Bereich der Punktionsstelle, unbehandelte körperweite Infektionskrankheiten (Bakteriämie), ein unbehandelter Volumenmangel (Hypovolämie), ein erhöhter Hirndruck sowie eine manifeste Blutungsneigung durch genetisch bedingte Gerinnungsstörungen oder eine therapeutische Gerinnungshemmung dar (vgl. Tabelle).[21] Eine solche Behandlung mit gerinnungshemmenden Mitteln muss vor der Durchführung einer Spinalanästhesie bei unfraktioniertem Heparin vier Stunden, bei niedermolekularen Heparinen hingegen zwölf (prophylaktische Niedrigdosierung) beziehungsweise 24 Stunden (therapeutische Dosis) pausiert werden. Clopidogrel muss sieben, Ticlopidin zehn Tage zuvor abgesetzt werden, nach der Einnahme von Cumarinen (Phenprocoumon u. a.) muss ein INR<1,4 erreicht sein. Die alleinige Behandlung mit Acetylsalicylsäure in niedriger Dosis (bis 100 mg pro Tag) erfordert keine Behandlungspause mehr (Empfehlungen der Deutschen Gesellschaft für Anästhesie und Intensivmedizin[22]).
Ein Mangel an Blutplättchen (Thrombozytopenie) erhöht das Risiko für eine Blutungskomplikation. Eine absolute Untergrenze bis zu der eine Spinalanästhesie durchgeführt werden kann, ist seitens der Fachgesellschaften nicht festgelegt. Vielmehr muss die Gesamtsituation der Blutgerinnung berücksichtigt werden.[23] Die Transfusion von Thrombozytenkonzentraten zur Erhöhung der Thrombozytenzahl im Blut vor einer Spinalanästhesie, wird ab einem Wert von kleiner 50.000/μl empfohlen, so dass dies als Orientierung für die Untergrenze herangezogen werden kann. Bei der Periduralanästhesie, bei der meist dickere Nadeln verwendet werden, wird schon bei weniger als 80.000/μl eine Transfusion empfohlen.[24]
Relative Kontraindikationen sind chronische Rückenschmerzen, eine systemische Infektion unter antibiotischer Behandlung, ein Morbus Bechterew, eine signifikante Aortenstenose oder andere Herzklappenfehler, die Syringomyelie sowie eine pulmonale Hypertonie. Bei diesen Zuständen müssen Vorteile durch die Spinalanästhesie gegen die Risiken abgewogen werden.[21]
| Substanz | Vor Punktion bzw. Katheterentfernung | Nach Punktion bzw. Katheterentfernung |
|---|---|---|
| Unfraktioniertes Heparin (UFH) | 4–6 h | 1 h |
| Niedermolekulare Heparine NMH-Prophylaxe | 12 h | 4 h |
| Niedermolekulare Heparine NMH-Therapie | 24 h | 4 h |
| Fondaparinux | 36–42 h | 6–12 h |
| Vitamin-K-Antagonisten | INR < 1,4 | nach Katheterentfernung |
| Clopidogrel | 7 Tage | nach Katheterentfernung |
| Prasugrel | 7–10 Tage | 6 h |
| Ticlopidin | 10 Tage | nach Katheterentfernung |
| Abciximab | 48 h | 4 h |
| Tirofiban | 8 h | 4 h |
| Prostacyclin (PGI2) | 0,5 h | sofort |
| Dabigatranetexilat | > 34 h | 4–6 h |
| Rivaroxaban | 22–26 h | 4–6 h |
| Apixaban | 26–30 h | 4–6 h |
| Ticagrelor | 5 Tage | 6 h |
| Cilostazol | 42 h | 5 h |
| Dipyridamol plus ASS | 48 h | sofort |
Ablauf
Vorbereitung
Wie bei anderen Anästhesieverfahren findet im Vorfeld ein Aufklärungsgespräch zwischen Patient und Anästhesist statt. Am Tag der Operation muss Nüchternheit eingehalten werden, da möglicherweise im Falle von Komplikationen oder ungenügender Wirkung ein Verfahrenswechsel auf eine Narkose stattfinden muss. Oft wird vor dem Eingriff als Prämedikation ein beruhigendes und spannungslösendes Mittel (Sedativum) verabreicht.
Die Spinalanästhesie wird am Patienten im Sitzen oder in Seitenlage durchgeführt. In sitzender Position wird der Patient von vorne durch eine Hilfsperson gestützt. Ein venöser Zugang muss sicher platziert sein, Notfallausrüstung zur Verfügung stehen. Mittels Basismonitoring (EKG-Überwachung, Pulsoxymetrie, Blutdruckmessung) wird der Patient kontinuierlich überwacht.
Durchführung
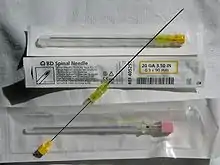
Zur Applikation der Spinalanästhesie wird mit einer Spinalkanüle zwischen dem zweiten und dritten (L2/L3) oder dritten und vierten Lendenwirbel (L3/L4) punktiert. Nach mehrfacher Desinfektion sowie örtlicher Betäubung wird die Kanüle unter sterilen Bedingungen zwischen zwei Dornfortsätzen eingestochen. Dabei kann gerade von hinten (median) in der Ebene der Dornfortsätze oder mit leichter seitlicher Abweichung von 10° (paramedian) punktiert werden. Alternativ kann der laterale Zugang nach Taylor genutzt werden, bei der der Einstich im Winkel von 45° von seitlich und unten erfolgt.
Die Mitarbeit des Patienten ist wichtig, weil er durch Abrunden des Rückens („Katzenbuckel“) den Abstand der Dornfortsätze vergrößern kann. Vor allem bei älteren Menschen behindern verknöcherte Bänder das Vorschieben der Nadel. Deshalb wird oft eine großlumigere Führungskanüle (Introducer) benutzt. Hat diese die Bandstrukturen durchdrungen, wird die eigentliche, dünne Punktionsnadel durch sie eingeführt und damit der Subarachnoidalraum punktiert. Berührt die Nadel eine Nervenwurzel, kann es während der Punktion kurzzeitig zu Missempfindungen (Parästhesien) in den Beinen kommen. Nach Durchtritt durch die Dura tropft der klare Liquor cerebrospinalis aus der Nadel heraus und zeigt dem durchführenden Arzt, dass die Nadel korrekt platziert ist.
Der klare Liquor kann durch Schlierenbildung in der aufgesetzten Spritze mit dem Lokalanästhetikum erkannt werden. Bei blutigem Liquor (Punktion eines Blutgefäßes) oder fehlendem Liquorrückfluss muss die Kanüle entfernt und neu eingestochen werden. Nach dem Einspritzen der an den Patienten angepassten Dosis Lokalanästhetikum setzt die Wirkung nahezu sofort ein und beginnt mit einem Wärmegefühl der Beine oder des Gesäßes. Innerhalb von Minuten setzen Empfindungs- und Schmerzlosigkeit sowie eine Einschränkung der Beweglichkeit ein. Durch die Lagerung des Patienten lässt sich bei der Verwendung hyperbarer Lokalanästhetika die Ausbreitung des betäubten Gebietes beeinflussen (mittelhohe Ausbreitung, Sakralblock, einseitig betonte Anästhesie).
Nach Injektion der Anästhetika steht je nach benutzter Substanz ein Zeitraum von 1–2,5 Stunden für den operativen Eingriff zur Verfügung. Oft wird der Patient durch die intravenöse Verabreichung entsprechender Medikamente (meist Benzodiazepine wie Midazolam) zur Stressminderung etwas sediert. Während der gesamten Wirkdauer muss der Patient durch Fachpersonal und technisches Monitoring überwacht werden, da frühere Konzepte einer „Fixierungszeit“ der Spinalanästhesie heute als obsolet angesehen werden und durch ein Aufsteigen der injizierten Anästhetika im Liquorraum Komplikationen auftreten können. Ist die Operation abgeschlossen, wird die Überwachung im Aufwachraum fortgesetzt, bis die Spinalanästhesie sich deutlich zurückgebildet hat.[27]
Nebenwirkungen und Komplikationen
Relativ häufige Nebenwirkungen einer Spinalanästhesie sind Blutdruckschwankungen, Herzrhythmusstörungen, Rückenschmerzen, Übelkeit und Erbrechen sowie postoperativ der postpunktionelle Kopfschmerz und Harnverhalt. Diese Probleme werden aufgrund der kontinuierlichen Überwachung in der Regel rasch vom Anästhesisten erkannt und ohne Folgen behandelt.[28]
Schwerwiegende Komplikationen wie schwere Kreislaufstörungen oder bleibende Nervenschäden durch direkte Schädigung, Infektionen oder Blutungen sind seltene Ereignisse. Die Häufigkeit ist dabei nur schwer zu ermitteln; Probleme sind fehlende Studien mit ausreichender Patientenzahl, ungenaue und abweichende (heterogene) Definitionen der Schäden in diesen Untersuchungen sowie die Abgrenzung von anderen möglichen Schädigungsmechanismen wie dem operativen Eingriff selbst, der Lagerung, bestehenden (möglicherweise unbekannten) Erkrankungen oder spontan auftretenden Ereignissen (Blutungen, Infektionen), die oft nur schwer möglich ist.[29][30]
Kreislaufstörungen
Ein Abfall des arteriellen Blutdrucks (Hypotonie) ist die häufigste Nebenwirkung einer Spinalanästhesie, die bei bis zu einem Drittel der Patienten auftritt. Sie entsteht durch die Betäubung des sympathischen Nervensystems (Sympathikolyse) der unteren Körperhälfte, wodurch die Gefäße weitgestellt (Vasodilatation) und das zirkulierende Blutvolumen und damit der Rückstrom zum Herzen vermindert sind. Je höher die Ausbreitung der Spinalanästhesie reicht, desto ausgeprägter ist der hypotone Effekt. Er wird zuweilen von einer Verlangsamung der Herzfrequenz (Bradykardie) und Übelkeit begleitet.
Der Abfall ist bei Patienten mit Flüssigkeitsmangel besonders ausgeprägt, weshalb vor der Durchführung einer Spinalanästhesie prophylaktisch Elektrolytlösungen als Infusion verabreicht werden, um ein solches Defizit auszugleichen. Auch Blutverluste, Lagerungsmanöver und das Ablassen einer Stauung bei Blutleere begünstigen die Hypotonie. Behandelt wird eine Hypotonie mit Volumengabe per Infusion, durch eine leichte Kopftieflagerung (Trendelenburg-Lage, beeinflusst bis etwa 10° die Ausbreitung des Lokalanästhetikums nur wenig) sowie durch die Gabe von Medikamenten, falls notwendig. Dabei werden Katecholamin-Derivate wie Cafedrin/Theodrenalin (Akrinor) oder seltener Noradrenalin eingesetzt, bei Bradykardien auch Atropin oder Orciprenalin.[31] Während Störungen des Blutdrucks oder der Herzfrequenz in der Regel effektiv behandelt werden können, treten selten auch schwere Verlaufsformen bis zum Kreislaufstillstand auf (ca. 3/10.000[32]).
Postspinaler Kopfschmerz
Der postpunktionelle oder postspinale Kopfschmerz (postdural puncture headache, PDPH) gehört zu den unangenehmen Nebenwirkungen der Spinalanästhesie, hat jedoch in der Regel eine gute Prognose. Als Entstehungsmechanismus wird ein Liquorverlustsyndrom durch die Perforationsstelle der harten Hirnhaut postuliert. Durch dieses Leck tritt Liquor aus, wobei sich ein Unterdruck im Liquorraum entwickelt, wenn der Verlust die Neubildungsrate übersteigt. Eine Dehnung schmerzempfindlicher Strukturen des Gehirns (Hirnhäute, Gefäße, Falx cerebri), eine kompensatorische Gefäßweitstellung (Vasodilatation) und möglicherweise ein erhöhter Hirndruck durch einen verminderten venösen Abfluss der Gehirngefäße bewirken in der Summe die Ausbildung des Kopfschmerzes. Das Syndrom wurde schon bei der Beschreibung der Spinalanästhesie durch August Bier (1899, s. u.) erwähnt.
Der Kopfschmerz tritt, stark von der eingesetzten Spinalnadel abhängig, bei 0,5–18 % der Patienten auf und beginnt meist ab dem zweiten Tag nach der Punktion. Im Liegen tritt eine Besserung, im Sitzen und Stehen sowie bei Kopfschütteln und erhöhtem Bauchdruck eine Verschlimmerung der Beschwerden auf. Der postpunktionelle Kopfschmerz kann von Übelkeit, Erbrechen, Schwindel, Nackensteifigkeit, Rückenschmerzen, Licht- und Geräuschempfindlichkeit, Auftreten von Doppelbildern und Sehstörungen (durch Irritationen des dritten, vierten und sechsten Hirnnerven) sowie vermindertem Hörvermögen oder Tinnitus (durch Irritationen des achten Hirnnerven) begleitet werden.
Die Behandlung erfolgt primär konservativ durch Bettruhe, ausreichende Flüssigkeitszufuhr und Schmerzmedikation. Bei Erfolglosigkeit dieser Maßnahmen werden verschiedene invasive Therapieverfahren angewendet, als Mittel der Wahl gilt der epidurale Blutpatch. Dabei wird steril entnommenes Blut des Patienten auf Höhe der Punktionsstelle in den Epiduralraum injiziert. Dieses komprimiert und verschließt die Perforation der Hirnhaut.
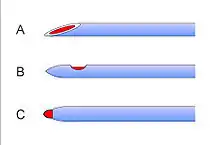
Die wichtigste Maßnahme zur Prophylaxe eines postpunktionellen Kopfschmerzes ist die Verwendung von möglichst dünnen Punktionsnadeln mit atraumatischer Spitze (Pencil-Point-Spitze), die weitaus geringere Raten an Kopfschmerz (0,5–1 %) aufweisen als Nadeln mit größerem Durchmesser und schneidender, schräg angeschliffener Spitze (z. B. Quincke-Nadel).[33][34] Entwickelt wurde die atraumatsche Spitze der 1979 eingeführten Sprotte-Kanüle von dem Anästhesisten und Schmerztherapeuten Günter Sprotte (* 1945) in Zusammenarbeit mit der Firma Pajunk[35]
Neurologische Komplikationen
Bei Schädigungen von Nerven kann zwischen primär durch die Spinalanästhesie entstandenen und sekundär entwickelten Schäden unterschieden werden. Als primäre Schädigungsmechanismen sind mechanische Verletzungen durch die Nadel oder toxische Effekte der injizierten Lösungen möglich, als sekundäre Infektionen und Blutungen mit raumforderndem Charakter (s. u.), die durch Druck auf die Nerven (Kompression) Schäden verursachen können.[36]
Nervenschäden, die nach einem operativen Eingriff auftreten, sind nur selten durch Nadelverletzungen einer Spinalanästhesie bedingt, sondern oft Folge der Lagerung, der Operation oder unabhängiger Faktoren wie Vorerkrankungen. Die Häufigkeit an Schäden von Spinalnerven durch eine Spinalanästhesie wird auf 3,8/10.000 geschätzt, von denen ein großer Teil reversibel ist.[29]
Als transiente neurologische Symptome (TNS) bezeichnet man symmetrische, in die Beine ausstrahlende Rückenschmerzen ohne sensible Ausfälle, die typischerweise innerhalb weniger Stunden nach dem Anästhesieverfahren beginnen und innerhalb von Tagen wieder ohne Folgen abklingen. Sie sind durch die Toxizität der Lokalanästhetika bedingt und treten bei etwa einem Prozent der Patienten auf. Wird Lidocain benutzt, ist die Rate jedoch deutlich höher.[37][38]
Die Ursache für das selten auftretende Cauda-equina-Syndrom (0,02–0,16/10.000[29]) ist ebenfalls in der Neurotoxizität der Lokalanästhetika begründet. Eine Schwäche der unteren Extremitäten, Störung von Wasserlassen und Stuhlgang sowie Sensibilitätsstörungen im Genitalbereich (Reithosenanästhesie) sind klinische Zeichen. Diese Schäden sind oft dauerhaft.[36]
Blutungen
Durch Verletzungen von Blutgefäßen beim Vorschieben der Nadel in den Rückenmarkskanal können Blutungen des Epidural- und Spinalraums verursacht werden. Raumfordernde Blutergüsse (Hämatome) entstehen jedoch nur sehr selten auf diese Weise, ihre Häufigkeit wird auf 1:220.000 geschätzt. Patienten, die unter Gerinnungsstörungen leiden oder gerinnungshemmende Medikamente einnehmen, haben ein etwas erhöhtes Risiko (ca. 1:40.000). Klinisch stehen ein Ausfall der Reflexe (Areflexie), Muskelschwäche und Sensibilitätsstörungen unterhalb des Niveaus der Kompression im Vordergrund, typischerweise nachdem die Wirkung der Spinalanästhesie sich primär zurückgebildet hat. Da durch eine rückenmarksnahe Blutung eine dauerhafte Nervenschädigung verursacht werden kann, muss im Verdachtsfall zur Diagnosesicherung eine MRT-Aufnahme durchgeführt werden. Wird dabei eine blutungsbedingte Kompression der Nerven identifiziert, muss umgehend eine operative Entlastung (Laminektomie) erfolgen. Zur Vermeidung von Blutungen müssen zwischen der Verabreichung gerinnungshemmender Arzneimittel und rückenmarksnahen Punktionen bestimmte Zeitabstände (s. o.) eingehalten werden.[22][36][39]
Infektionen
Infektiöse Komplikationen nach einer einmaligen Spinalanästhesie sind sehr selten. Mögliche Ursachen sind die Verschleppung von Keimen aus einer bestehenden Infektion oder ein Einbringen durch eine kontaminierte Nadel oder ungenügend steriles Arbeiten, wodurch Erreger in der Spinalraum und Epiduralraum eindringen können. Mögliche Manifestationen sind Entzündungen der Hirnhäute (Meningitis) sowie die Ausbildung eines Abszesses (eitrige Raumforderung) des Epiduralraumes (zwischen Dura und Periost). Verlässliche Zahlen zur Häufigkeit liegen nicht vor; während das Risiko für Katheterverfahren stark variierend auf 1:1000 bis 1:100.000 geschätzt wird, ist ein Auftreten nach einer einmaligen Injektion eine Rarität. Eine Abgrenzung zu spontan auftretenden Abszessen (0,2–1,2:10.000) ist nur schwer möglich. Die häufigsten Erreger sind Staphylokokken, deren Vorkommen in der Hautflora die Wichtigkeit von gründlicher Desinfektion der Punktionsstelle und streng steriler Durchführung der Punktion zeigt.
Eine Meningitis zeigt sich typischerweise nach 24–48 Stunden durch Fieber, Nackensteifigkeit (Meningismus), Kopfschmerzen und Lichtscheue (Photophobie). Bei Verdacht muss eine diagnostische Lumbalpunktion durchgeführt werden, um mittels Liquoruntersuchung die Erreger zu bestimmen und mit gezielter Antibiotikatherapie behandeln zu können. Eine Sonderform ist die aseptische Meningitis, bei der kein Erregernachweis gelingt.
Eine schwerwiegende Komplikation ist die Ausbildung eines Abszesses des Epiduralraumes. Die Symptome sind variabel und umfassen Fieber, Rückenschmerzen sowie neurologische Ausfälle. Die wegweisende Diagnostik umfasst insbesondere bildgebende Verfahren (MRT). Therapeutisch werden Antibiotika eingesetzt, eine frühe chirurgische Entlastung ist in den meisten Fällen notwendig. In einem Drittel der Fälle bleiben gravierende, in einem weiteren Drittel leichte Nervenschäden zurück. Die Sterblichkeit aufgrund der Entwicklung einer Sepsis liegt bei etwa 10–15 %.[40][36][41]
Weitere Nebenwirkungen
Übelkeit und Erbrechen treten in bis zu 15 % der Spinalanästhesien auf. Rückenschmerzen werden von etwa 10 % der Patienten angegeben, eine ursächliche Zuordnung zu Anästhesieverfahren, Operation oder Lagerung ist nur schwer möglich. Ein Harnverhalt tritt bei 1,5–3 % der Patienten auf, die operativ keinen Dauerkatheter in die Harnblase eingelegt bekommen. Ursache ist ein Ungleichgewicht von hemmenden Einfluss des Sympathikus und fördernden Einfluss des Parasympathikus auf die Blasenentleerung[42]. Zur Behandlung muss unter Umständen eine sterile Einmalkatheterisierung durchgeführt werden.
Eine schwere Nebenwirkung ist eine zu hoch aufsteigende Spinalanästhesie, wie sie etwa bei versehentlicher Überdosierung der Medikamente auftreten kann. Verteilen sich diese im gesamten Spinalraum, spricht man von einer totalen Spinalanästhesie. Bewusstlosigkeit, Atem- und Kreislaufstillstand können die Folge sein und müssen durch endotracheale Intubation und Beatmung, Katecholamin-Therapie sowie gegebenenfalls durch Wiederbelebungsmaßnahmen behandelt werden. Bei adäquater Therapie ist in der Regel eine vollständige Rückbildung (Restitutio ad integrum) möglich.[43]
Ein technisches Versagen der Spinalanästhesie (Unmöglichkeit der Durchführung, Nadelverbiegung, sehr selten Nadelbruch) ist direkt vom Durchmesser der Spinalnadel abhängig. Bei Standardnadeln (Gauge 25) beträgt diese Rate weniger als fünf Prozent, nimmt bei dünneren Nadeln jedoch zu. Da eine größere Nadeldicke mit einer höheren Rate an postpunktionellem Kopfschmerz assoziiert ist, ist die Auswahl der Nadel ein Kompromiss.[28]
Geschichtliche Aspekte
Die ersten Punktionen des lumbalen Liquorraumes wurden 1891 von Heinrich Irenaeus Quincke in Kiel durchgeführt, allerdings zur diagnostischen Entnahme von Liquor. Er entwickelte dazu eine schräg angeschliffene Punktionsnadel (Quincke-Nadel).[44]

Am 24. August 1898 führten der Chirurg August Bier (1861–1949) und sein Assistent August Hildebrandt (1868–1954) ebenfalls in Kiel in einem gegenseitigen Versuch erfolgreich Spinalanästhesien durch.[45] Durch die Injektion von Kokain wurde „ein starker Schlag mit einem Eisenhammer gegen das Schienbein“ und „starkes Drücken und Ziehen am Hoden“ nicht mehr als schmerzhaft empfunden. Beide entwickelten in der Folge einen stark ausgeprägten postspinalen Kopfschmerz mit Übelkeit und Erbrechen.[46]
Der US-Amerikaner James Leonard Corning hatte 1885 bereits ähnliche Versuche unternommen und in rückenmarksnahe Strukturen Kokain eingespritzt, woraufhin eine Gefühllosigkeit von Beinen und Genitalien zu beobachten war.[47] Ob dabei eine Spinalanästhesie gelang oder die Substanzen nur in die Bandstrukturen appliziert wurden, ist umstritten. Im Anschluss an die 1899 erfolgte Veröffentlichung von August Bier, der 1898 im Tierversuch die Spinalanästhesie untersucht hat,[48] entwickelte sich eine Kontroverse um das erste erfolgreich durchgeführte Anästhesieverfahren dieser Art, was sowohl Bier als auch Corning für sich beanspruchten. In der Folge zerstritt sich Bier auch mit seinem Assistenten Hildebrandt, der unzufrieden war, da Bier ihn nicht als Mitautor aufgeführt hatte. Heute wird Corning die Schaffung der experimentellen und theoretischen Voraussetzungen für die Spinalanästhesie zugeschrieben, Bier die erfolgreiche Anwendung und anschließende Etablierung des Verfahrens in der Klinik.[46] Bier warnte vor dem von ihm zuvor empfohlenen Verfahren der Lumbalanästhesie mit Kokain, da es häufig zu ernsten Zwischenfällen führte. Erst nachdem 1903 das weniger toxische, von Ernest Fourneau entwickelte Lokalanästhestikum Stovain erhältlich war, praktizierte er die Lumbalanästhesie wieder. Zu den ersten Amerikanern, welche die Spinalanästhesie anwendeten gehören die Chirurgen F. Dudley Tait und Guido E. Caglieri in San Francisco[49] sowie der Gefäßchirurg Rudolph Matás (1860–1957) in New Orleans, der sie 1899[50] mit Hilfe von Felix A. Larue, Hermann B. Gessner und Carroll Allen bei einer Hämorrhoidenoperation durchgeführt hatte.[51][52] Der Franzose Théodore Tuffier (1857–1929) empfahl die Spinalanästhesie 1899 für operative Eingriff am Urogenitaltrakt.[53] Mediziner wie Pierre Marie, Georges Charles Guillain und Charles Achard wendeten die subarachnoidale Injektion von Kokain auch zur Behandlung von Nervenschmerzen im Lendenbereich und in den Beinen wie beim Ischiasschmerz oder dem Hexenschuss (Lumbago) an.[54]
Anfang des 20. Jahrhunderts etablierte sich die Spinalanästhesie in der Geburtshilfe. In den 1930er Jahren brachten Veröffentlichungen über Todesfälle bei der Spinalanästhesie zum Kaiserschnitt diese Anwendung jedoch in Verruf; man ermutigte die Schwangeren stattdessen zu „natürlichen Geburtsverfahren“ und zur „Psychoprophylaxe“. Aufgrund der Vernachlässigung der Schmerztherapie unter Geburt wird diese Zeit auch als die „dunklen Jahre der geburtshilflichen Anästhesie“ bezeichnet. Erst in den 1950er Jahren änderte sich diese Sichtweise wieder. Heute ist die Spinalanästhesie ein Standardverfahren bei der Durchführung eines Kaiserschnittes.[55]
1951 entwickelten Whitacre und Hart Kanülen mit Pencilpoint-Spitze. Deren Einführung in die klinische Praxis führte zu einer signifikanten Reduktion der Rate von postspinalem Kopfschmerz, der zuvor bei einem Großteil der Patienten aufgetreten war.[56]
Die erste kontinuierliche Spinalanästhesie unter der Belassung der Spinalnadel während der Operation am Punktionsort wurde schon 1907 durch den Chirurgen Dean durchgeführt.[57] Die Etablierung dieses Verfahrens durch die Entwicklung ausreichend dünner Katheter, wodurch akzeptabel geringe Raten an postspinalem Kopfschmerz erreicht werden konnten, fand jedoch erst in der zweiten Hälfte des 20. Jahrhunderts statt.
Literatur
- D. Jankovic: Regionalblockaden und Infiltrationstherapie. 3. Auflage. Abw Wissenschaftsverlag, 2003, ISBN 3-936072-16-7.
- R. Rossaint, C. Werner, B. Zwißler: Die Anästhesiologie: Allgemeine und spezielle Anästhesiologie, Schmerztherapie und Intensivmedizin. 2. Auflage. Springer, 2008, ISBN 978-3-540-76301-7.
- F. Gerheuser, D. Craß: Spinalanästhesie. In: Anaesthesist. 2005 Dec;54(12), S. 1245–1267. Review. PMID 16317479.
- Michael Heck, Michael Fresenius: Repetitorium Anästhesiologie. 5. Auflage. Springer, 2007, ISBN 978-3-540-46575-1.
Einzelnachweise
- Rossaint u. a. 2008, S. 620–624; Jankovic 2003, S. 263–271; Gerheuser und Craß 2005, S. 1246–1248.
- F. Gerheuser, A. Roth: Periduralanästhesie. In: Anaesthesist. Band 56, Nr. 5, Mai 2007, S. 499–523, doi:10.1007/s00101-007-1181-1, PMID 17431551.
- Diagnostische Liquorpunktion (Memento vom 15. Dezember 2007 im Internet Archive) – Leitlinie der deutschen Gesellschaft für Neurologie, 2005.
- N. M. Denny, D. E. Selander: Continuous spinal anaesthesia. In: Br J Anaesth. 1998 Oct;81(4), S. 590–597. PMID 9924237
- B. Neruda: Entwicklung und gegenwärtiger Stand der kombinierten Spinal-Periduralanästhesie. In: Anasthesiol Intensivmed Notfallmed Schmerzther. 2005 Aug;40(8), S. 459–468. PMID 16078156
- Rossaint u. a. 2008, S. 636f.
- G. Hocking, J. A. Wildsmith: Intrathecal drug spread. In: Br J Anaesth. 2004 Oct;93(4), S. 568–578. PMID 15220175
- D. Zaric, C. Christiansen, N. L. Pace, Y. Punjasawadwong: Transient neurologic symptoms (TNS) following spinal anaesthesia with lidocaine versus other local anaesthetics. In: Cochrane Database Syst Rev. 2005 Oct 19;(4), S. CD003006. PMID 16235310
- Rossaint u. a. 2008, S. 639f.
- M. A. Chaney: Side effects of intrathecal and epidural opioids. In: Can J Anaesth. 1995 Oct;42(10), S. 891–903. PMID 8706199
- Dorothee H. Bremerich: Stellungnahme zum Leserbrief Ist die Mischung Bupivacain+Sufentanil+Morphin intrathekal für sie SPA zur Sectio obsolet? In: Anästhesiologie & Intensivmedizin. Band 60, 2019, S. 578–581, hier: S. 580, Tabelle 1: International geforderte Überwachungsintervalle nach rückenmarknaher Applikation von Morphin.
- N. Elia, X. Culebras, C. Mazza, E. Schiffer, M. R. Tramèr: Clonidine as an adjuvant to intrathecal local anesthetics for surgery: systematic review of randomized trials. In: Reg Anesth Pain Med. 2008 Mar-Apr;33(2), S. 159–167. PMID 18299097
- K. Govindan, R. Krishnan, M. P. Kaufman, R. Michael, R. J. Fogler, J. Gintautas: Intrathecal ketamine in surgeries for lower abdomen and lower extremities. In: Proc West Pharmacol Soc. 2001; 44, S. 197–199. PMID 11793982
- Gerheuser und Craß 2005, S. 1257.
- Jankovic u. a. 2003, S. 272f.
- U. M. Stamer, R. Wiese, F. Stüber, H. Wulf, T. Meuser: Change in anaesthetic practice for Caesarean section in Germany. In: Acta Anaesthesiol Scand. Band 49, Nr. 2, 2005, S. 170–176. PMID 15715617 doi: 10.1111/j.1399-6576.2004.00583.x
- V. Hempel: Spinalanästhesie zur Sectio caesarea. In: Anasthesiol Intensivmed Notfallmed Schmerzther. 2001 Jan;36(1), S. 57–60.PMID 11227314
- A. Rodgers, N. Walker, S. Schug, A. McKee, H. Kehlet, A. van Zundert, D. Sage, M. Futter, G. Saville, T. Clark, S. MacMahon: Reduction of postoperative mortality and morbidity with epidural or spinal anaesthesia: results from overview of randomised trials. In: BMJ. 2000 Dec 16;321(7275), S. 1493. PMID 11118174
- E. Tziavrangos, S. A. Schug: Regional anaesthesia and perioperative outcome. In: Curr Opin Anaesthesiol. 2006 Oct;19(5), S. 521–525. PMID 16960485
- F. Wappler, K. Bangert: Perioperatives Management bei kardialen Risikopatienten. In: Anasthesiol Intensivmed Notfallmed Schmerzther. Band 40, Nr. 5, Mai 2005, S. 284–291. PMID 15902608.
- Rossaint u. a. 2008, S. 631f.
- W. Gogarten, H. Van Aken, J. Büttner, H. Riess, H. Wulf, H. Bürkle: Rückenmarksnahe Regionalanästhesien und Thromboembolieprophylaxe/antithrombotische Medikation. (Seite nicht mehr abrufbar, Suche in Webarchiven) Info: Der Link wurde automatisch als defekt markiert. Bitte prüfe den Link gemäß Anleitung und entferne dann diesen Hinweis. (PDF; 216 kB) 2. überarbeitete Empfehlung der Deutschen Gesellschaft für Anästhesiologie und Intensivmedizin. In: Anästh Intensivmed. 2007;48, S. S109–S124
- Durchführung von Analgesie- und Anästhesieverfahren in der Geburtshilfe. 2. überarbeitete Empfehlungen der Deutschen Gesellschaft für Anästhesiologie und Intensivmedizin und des Berufsverbandes Deutscher Anästhesisten in Zusammenarbeit mit der Deutschen Gesellschaft für Gynäkologie und Geburtshilfe. In: Anästh. Intensivmed., 50, 2009, S. S490–S495
- Querschnitts-Leitlinien (BÄK) zur Therapie mit Blutkomponenten und Plasmaderivaten. 4. überarbeitete und aktualisierte Auflage 2014, Deutsches Ärzteblatt, Jg. 112, Heft 6, 6. Februar 2015
- Wiebke Gogarten, Hugo K Van Aken: Perioperative Thromboseprophylaxe – Thrombozytenaggregationshemmer – Bedeutung für die Anästhesie. In: AINS – Anästhesiologie • Intensivmedizin • Notfallmedizin • Schmerztherapie. Ausgabe 04, April 2012, S. 242–254, doi:10.1055/s-002-23167.
- S. A. Kozek-Langenecker, D. Fries, M. Gütl, N. Hofmann, P. Innerhofer, W. Kneifl, L. Neuner, P. Perger,T. Pernerstorfer, G. Pfanner u. a.: Lokoregionalanästhesien unter gerinnungshemmender Medikation. Empfehlungen der Arbeitsgruppe Perioperative Gerinnung (AGPG) der Österreichischen Gesellschaft für Anästhesiologie und Intensivmedizin (ÖGARI). In: Der Anaesthesist. Volume 54, Number 5 (2005), S. 476–484, doi:10.1007/s00101-005-0827-0.
- Jankovic 2003, S. 273–278; Rossaint u. a. 2008, S. 634–642; Gerheuser und Craß 2005, S. 1253 f.
- Rossaint u. a. 2008, S. 643f; Jankovic 2003, S. 285f.
- R. Brull, C. J. McCartney, V. W. Chan, H. El-Beheiry: Neurological complications after regional anesthesia: contemporary estimates of risk. In: Anesth Analg. 2007 Apr;104(4), S. 965–974. Review: PMID 17377115
- E. M. Pogatzki-Zahn, M. Wenk, H. Wassmann, W. L. Heindel, H. Van Aken: Schwere Komplikationen durch Regionalanalgesieverfahren – Symptome, Diagnose und Therapie. In: Anasthesiol Intensivmed Notfallmed Schmerzther. 2007 Jan;42(1), S. 42–52. Review: PMID 17253336
- Jankovic 2003, S. 285.
- S. L. Kopp, T. T. Horlocker, M. E. Warner, J. R. Hebl, C. A. Vachon, D. R. Schroeder, A. B. Gould Jr, J. Sprung: Cardiac arrest during neuraxial anesthesia: frequency and predisposing factors associated with survival. In: Anesth Analg. 2005 Mar;100(3), S. 855–865, PMID 15728079
- P. Kessler, H. Wulf: Duraperforation – postpunktioneller Kopfschmerz – Prophylaxe- und Therapiemöglichkeiten. In: Anästhesiol Intensivmed Notfallmed Schmerzther. 2008; 43, S. 346–353. PMID 18464211, doi:10.1055/s-2008-1079107.
- D. K. Turnbull, D. B. Shepherd: Post-dural puncture headache: pathogenesis, prevention and treatment. In: Br J Anaesth. 2003 Nov;91(5), S. 718–729. doi: 10.1093/bja/aeg231, PMID 14570796.
- 40 Jahre Sprotte®. Eine Erfolgsgeschichte seit vier Jahrzehnten. In: Anästhesiologie & Intensivmedizin. Band 61, Januar 2020, Heftrücken.
- H. Ohnesorge, H. Beck: Neurologische Komplikationen nach Regionalanästhesie. In: Anasthesiol Intensivmed Notfallmed Schmerzther. 2003 Jul;38(7), S. 472–475, PMID 12822119.
- L. H. Eberhart, A. M. Morin, P. Kranke, G. Geldner, H. Wulf: Transiente neurologische Symptome nach Spinalanästhesie: Eine quantitative systematische Übersicht (Metaanalyse) randomisierter kontrollierter Studien. In: Anaesthesist. 2002 Jul;51(7), S. 539–546. PMID 12243039
- D. Zaric, C. Christiansen, N. L. Pace, Y. Punjasawadwong: Transient neurologic symptoms after spinal anesthesia with lidocaine versus other local anesthetics: a systematic review of randomized, controlled trials. In: Anesth Analg. 2005 Jun;100(6), S. 1811–1816. PMID 15920219
- Rossaint u. a. 2008, S. 627–630.
- S. Grewal, G. Hocking, J. A. Wildsmith: Epidural abscesses. In: Br J Anaesth. 2006 Mar;96(3), S. 292–302. PMID 16431882.
- Rossaint u. a. 2008, S. 625–627, S. 648.
- Robert Schmidt: Physiologie des Menschen mit Pathophysiologie; mit 85 Tabellen; mit herausnehmbarem Repetitorium. Springer-Medizin-Verl, Heidelberg 2010, ISBN 978-3-642-01650-9.
- Gerheuser und Craß 2005, S. 1266.
- H. I. Quincke: Die Lumbalpunktion des Hydrocephalus. In: Berl Med Wochenschr. 1891; 28, S. 929–933.
- August Bier: Versuche über Cocainisierung des Rückenmarks. In: Deutsche Zeitschrift für Chirurgie. Band 51, 1899, S. 361–368.
- Peter Oehme: Rückenmarksanästhesie mit Kokain: Die Prioritätskontroverse zur Lumbalanästhesie. In: Dtsch Arztebl. 1998;95(41), S. A-2556–A-2558.
- J. L. Corning: Spinal anaesthesia and local medication of the cord. In: New York State Med J. Band 42, 1885, S. 483.
- H. Orth, I. Kis: Schmerzbekämpfung und Narkose. In: Franz Xaver Sailer, Friedrich Wilhelm Gierhake (Hrsg.): Chirurgie historisch gesehen. Anfang – Entwicklung – Differenzierung. Dustri-Verlag, Deisenhofen bei München 1973, ISBN 3-87185-021-7, S. 1–32, hier: S. 20.
- D. Tait, G. Caglieri: Experimental and clinical notes on the subarachnoid espace. In: J. Amer. Med. Ass. Band 35, 1900, S. 6 ff.
- Rudolph Matas, Felix A. Larue, Hermann B. Gessner, Carroll Allen: Intraspinal Cocainization. In: Journal of the American Medical Association. Band 33, (30. Dezember) 1899, S. 1659 (Medical News).
- Merlin D. Larson: Tait and Caglieri: The First Spinal Anesthetic in America.
- Albert Faulconer, Thomas Edward Keys: Rudolph Matas. In: Foundations of Anesthesiology. Charles C Thomas, Springfield (Illinois) 1965, S. 858.
- H. Orth, I. Kis: Schmerzbekämpfung und Narkose. 1973, S. 20.
- Jean-Athanase Sicard: The Extradural Injection of Agents by the Sacrococcygeal Route. (Übersetzung von Les injections médicamenteuses extradurales par voie sacrococcygienne. In: Comptes rendus hebdomadaires des séances et mémoires de la Société de biologie. Band 53, (20. April) 1901, S. 396–398.) In: Albert Faulconer, Thomas Edward Keys: Foundations of Anesthesiology. Charles C Thomas, Springfield (Illinois) 1965, S. 921–923, hier: 921 f.
- W. Gogarten, H. Van Aken: A century of regional analgesia in obstetrics. In: Anesth Analg. 2000 Oct,91(4), S. 773–775. PMID 11004024
- J. R. Hart, R. J. Whitacre: Pencil-point needle in prevention of postspinal headache. In: J Am Med Assoc. 1951 Oct 13;147(7), S. 657–658, PMID 14873528
- H. P. Dean: Discussion on the Relative Value of Inhalation and Injection Methods of Inducing Anaesthesia. In: Br Med J. 1907; 5, S. 869–877.