Maligne Hyperthermie
Die Maligne Hyperthermie (MH), veraltet auch maligne Hyperpyrexie, Narkose-Hyperthermie-Syndrom und Ombrédanne-Syndrom, ist ein vor allem nach Verabreichung bestimmter Narkosemittel selten auftretender medizinischer Notfall. Es handelt sich um eine seltene pharmakogenetische Erkrankung der Skelettmuskulatur, der ein angeborener Defekt der intrazellulären Calciumregulation zugrunde liegt.[1]
| Klassifikation nach ICD-10 | |
|---|---|
| T88.3 | Maligne Hyperthermie |
| ICD-10 online (WHO-Version 2019) | |
Nach Verabreichung von auslösenden Substanzen (Triggern) wird bei entsprechender genetischer Veranlagung durch eine unkontrollierte Freisetzung von Calcium-Ionen über funktionell veränderte sarkoplasmatische Calciumkanäle eine lebensbedrohliche Stoffwechselentgleisung in der Skelettmuskulatur verursacht, die einer schnellen Behandlung bedarf.[2]
Die Maligne Hyperthermie ist eine sehr seltene, lebensbedrohliche Komplikation einer Narkose und kann auch in der Phase nach der Operation auftreten.[3] Die Triggersubstanzen (insbesondere als volatile Anästhetika eingesetzte halogenierte Kohlenwasserstoffe und das muskelentspannende Succinylcholin) werden nicht nur bei Operationen in Allgemeinanästhesie, sondern auch auf Intensivstationen und in der Notfallmedizin eingesetzt.[4][1]
Die Symptomatik ist sehr variabel (von nur leicht verlaufenden Formen mit nur einem oder wenigen Symptomen bis zur fulminanten MH-Krise[5]) und umfasst unter anderem Muskelstarre, Herzrasen, eine erhöhte Produktion von Kohlenstoffdioxid (CO2) und Temperaturerhöhung (von leichtem Temperaturanstieg bis Fieber) bis hin zur Übersäuerung des Körpers sowie Stoffwechsel- und Organversagen (so auch akutes Nierenversagen, Funktionsstörungen von Herz und Lunge sowie neurologische Komplikationen[6]), die letztlich zum Tod führen können. Durch sofortige Unterbrechung der Zufuhr von als Auslöser in Frage kommenden Narkosemitteln und schnellstmögliche Behandlung mit dem seit 1979 hierzu zur Verfügung stehenden Wirkstoff Dantrolen kann eine Maligne Hyperthermie wirksam behandelt werden. Durch dessen Einführung konnte in der Vergangenheit die Sterblichkeit stark (auf unter 3 Prozent[7]) gesenkt werden.
Bei Verdacht auf eine Veranlagung zur Malignen Hyperthermie stehen der In-vitro-Kontrakturtest sowie molekularbiologische Verfahren zur Verfügung, um diese abzuklären. Die Durchführung einer Narkose ist in solchen Fällen auch ohne auslösende Substanzen möglich.
Neben Menschen ist ein Vorkommen auch bei anderen Säugetieren bekannt wie etwa bei Schweinen, Hunden und Pferden, weshalb diese in der Forschung als Tiermodell genutzt werden.
Epidemiologie
Die Häufigkeit (Prävalenz) der genetischen Disposition für das Maligne-Hyperthermie-Syndrom (MHS) liegt unabhängig von ethnischer Zugehörigkeit in Deutschland bei etwa 1:2.600,[8] bzw. bei 1:3.000 bis 1:2.000.[9] Angaben zur Häufigkeit eines klinischen Auftretens variieren von 1:5.000 bis 1:100.000 Narkosen. Die meisten Autoren gehen von etwa einem Fall pro 20.000 Narkosen aus, wobei fulminante MH-Krisen mit 1:60.000 (1:250.000 bis 1:10.000[10]) deutlich seltener sind. Auch in nichtoperativen Fachgebieten können MH-Fälle auftreten: Vor dem Hintergrund, dass 2017 beispielsweise 430.452 intensivmedizinisch behandelte Patienten in Deutschland beatmet wurden,[11] sind allein auf Intensivstationen statistisch jährlich bis zu 165 Fälle einer MH zu erwarten. Die Maligne Hyperthermie tritt in jeder Altersstufe auf, junge Patienten sind jedoch häufiger betroffen (etwa die Hälfte der MH-Krisen betreffen Kinder und Jugendliche bis zum zwölften Lebensjahr).[12]) Das Durchschnittsalter liegt bei etwa 18 Jahren, zudem tritt die MH aus unbekannten Gründen[13] öfter bei Männern (2:1) auf. Die Mehrzahl der Patienten mit einer aufgetretenen Malignen Hyperthermie hatte bereits vorherige Narkosen mit unauffälligem Verlauf (in zahlreichen Fällen tritt eine MH erst nach wiederholter Triggerexposition auf).[14] Aufgrund des abnehmenden Einsatzes der Triggersubstanzen (insbesondere Halothan und Succinylcholin) ist die Häufigkeit rückläufig. Die Sterblichkeitsrate (Letalität) wurde in der Vergangenheit durch verbesserte Ausbildung und Patientenüberwachung wie die Entwicklung von Dantrolen von über 90 % auf unter 5 % gesenkt. Im Durchschnitt wird die Erkrankung im Fall eines Auftretens heute früher erkannt.[15]
Am häufigsten tritt die Maligne Hyperthermie bei Hausschweinen auf, insbesondere bei schnellwüchsigen Rassen mit hohem Skelettmuskelansatz wie Pietrain. In einigen Zuchtlinien können bis zu 95 % der Tiere betroffen sein.[16] Bei Schweinen kann bereits Stress als Auslöser der Erkrankung ausreichen, man spricht dann vom Porcinen Stress-Syndrom (PSS). Die Fleischqualität dieser Tiere ist vermindert (siehe PSE-Fleisch).
Bei Haushunden wird die Prävalenz mit 1:15.000 angegeben, womit die Erkrankung eine sehr seltene Komplikation darstellt. Eine genetische Prädisposition ist beim Greyhound nachgewiesen.[17]
Ursachen und Entstehungsmechanismen
Normale Skelettmuskelkontraktion
Die physiologische Kontraktion des Skelettmuskels erfolgt durch die Freisetzung von Calciumionen (Ca2+) aus dem Speichersystem der Zelle, dem sarkoplasmatischen Retikulum. Zur Auslösung einer Muskelkontraktion wird über die motorische Endplatte ein elektrischer Impuls (Aktionspotential) eines motorischen Nerven auf die Muskelzelle übergeleitet. Dadurch kommt es in Ausstülpungen der Zellmembran (T-Tubuli) zur Aktivierung eines spannungsgesteuerten Ionenkanals. Dieser steht in räumlichem Kontakt zu einem Calciumkanal des sarkoplasmatischen Retikulums, dem Ryanodin-Rezeptor, der in der Folge geöffnet wird. Durch das in das Zellinnere (Zytosol) strömende Calcium (Ca2+) wird die Kontraktion der Aktin- und Myosinfilamente ermöglicht, der Muskel zieht sich zusammen. Diese Verbindung eines Aktionspotentials mit der Muskelkontraktion wird als elektromechanische Kopplung bezeichnet.[18]
Vorgänge bei der Malignen Hyperthermie
Bei einer Malignen Hyperthermie liegen genetische Veränderungen (Mutationen) der Ryanodin- oder Dihydropyridin-Rezeptoren (das heißt der sarkoplasmatischen Calciumionenkanäle[19]) vor. Durch die Verabreichung von Triggersubstanzen wird bei disponierten Patienten eine massive und unkontrollierte Calciumfreisetzung innerhalb der Muskelzelle ausgelöst. Dadurch kommt es zu einer Aktivierung der Muskelfasern. Da sowohl die Wiederaufnahme des Calciums in das sarkoplasmatische Retikulum als auch die Lösung der kontraktilen Filamente im Anschluss an das Kontrahieren energieabhängige Prozesse sind, die ATP benötigen, kommt es rasch zu einem Energiemangel in der Zelle. Die Calciumionen führen zu einer starken Steigerung des Zellstoffwechsels (aerobe Energiegewinnung, später auch anaerober Stoffwechsel), was zu einem erhöhten Sauerstoffumsatz (und damit -verbrauch) und einer erhöhten Kohlenstoffdioxid- und Wärmeproduktion führt. Diese Prozesse finden anfangs isoliert im Skelettmuskel statt. Im Verlauf kommt es zu Muskelkontraktionen bis zum Rigor, Zelluntergang und Muskelzerfall (Rhabdomyolyse), was einen Sauerstoffmangel (Hypoxie), vermehrte Kohlenstoffdioxidanreicherung (Hyperkapnie) und starke Übersäuerung (Azidose) mit Laktatazidose bzw. Laktatämie (durch anaerobe Glykolyse)[20] und Überwärmung (Hyperthermie) des gesamten Körpers verursacht. Dies wirkt sich in der Folge (sekundär) schädigend auf andere Organe aus (vgl. Klinisches Bild). Ob neben dem Skelettmuskel auch an anderen Organen die genetischen Veränderungen eine Rolle spielen und dort zu Störungen führen, ist unklar. Die Herzmuskulatur ist von den Mutationen des Ryanodin-Rezeptors nicht betroffen.[21]
Genetik
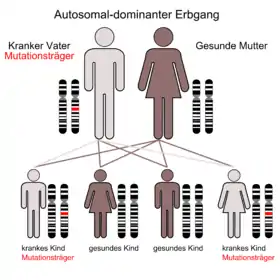
Sechs verschiedene Genorte auf verschiedenen Chromosomen konnten bislang mit der Malignen Hyperthermie in Verbindung gebracht werden.[22] Die häufigste Ursache ist eine von etwa 100 bekannten Punktmutationen des Ryanodin-Rezeptor codierenden Gens RYR1 auf Chromosom 19, die sich bei über 80 % der MH-Patienten nachweisen lassen (MH-susceptibility 1). Daneben können auch Mutationen auf dem Gen des Dihydropyridin-Rezeptors und anderer Proteine ursächlich für eine Maligne Hyperthermie sein (MH-susceptibility 2–6). Während Punktmutationen in den meisten Fällen den Austausch einer einzelnen Aminosäure bewirken, sind auch Deletionen und Insertionen bekannt. Die Vererbung der Mutationen erfolgt beim Menschen autosomal-dominant.
Patienten mit einer Central-Core-Myopathie und einer Multiminicore-Myopathie können eine MH-Disposition aufweisen. Diesen seltenen Muskelerkrankungen liegen häufig ebenfalls Mutationen des RYR1-Gens zugrunde.[23][24] Auch bei anderen Muskelkrankheiten wie der periodischen hypokaliämischen Lähmung, der kaliumsensitiven Myotonie (Myotonia fluctuans), dem seltenen King-Denborough-Syndrom kann eine MH-Disposition bestehen.[25] Auch wenn bei der Mehrzahl der Patienten mit McArdle-Erkrankung (Glykogenose Typ V) keine Narkoseprobleme dokumentiert wurden, kann auch in dieser Patientengruppe ausnahmsweise eine Maligne Hyperthermie auftreten.[26]
Es wurde festgestellt, dass eine Disposition für einen durch Sport ausgelösten Hitzschlag und MH auf dieselbe genetische Anlage zurückzuführen sei.[27][28]
Triggersubstanzen

Auslösende Triggersubstanzen sind dampf- oder gasförmige Inhalationsanästhetika wie z. B. Sevofluran, Desfluran und Isofluran sowie depolarisierende Muskelrelaxanzien (Succinylcholin).[1] Vergiftungen, Drogenkonsum, körperliche Anstrengung oder Angst können als Kofaktoren für die Auslösung eine Rolle spielen, in Einzelfällen auch die alleinige Ursache sein. Die anderen in der Anästhesie genutzten Pharmaka (Lachgas, Opioide, Schlafmittel, Benzodiazepine, nichtdepolarisierende Muskelrelaxanzien) sind sicher und können auch bei MH-Disposition genutzt werden.
Neben Halothan können Koffein, Ryanodin und Kresole eine Maligne Hyperthermie auslösen, was für diagnostische Zwecke im Labor genutzt wird (Kontrakturtest, s. u.). Durch die Aufnahme von Koffein mit der Nahrung oder die Verabreichung kresolhaltiger Medikamente wie Heparin oder Insulin ist keine Gefährdung zu erwarten.[30]
Klinisches Bild und Akutdiagnostik
Die Ausprägung der Malignen Hyperthermie ist sehr variabel, dadurch ist die Diagnose, die durch eine frühzeitige Blutgasanalyse und Labordiagnostik bestätigt werden muss, schwierig.
Frühsymptome
Frühe Zeichen sind eine erhöhte Kohlenstoffdioxidkonzentration (Hyperkapnie) der Ausatemluft, eine Erhöhung der Herzfrequenz (Tachykardie bzw. tachykarde Herzrhythmusstörungen), eine gesteigerte Atemfrequenz (Tachypnoe), eine Muskelstarre (Rigor, generalisierte Muskelrigidität), eine Verkrampfung des Musculus masseter (Masseterspasmus, „Trismus“) unmittelbar nach Gabe von Succinylcholin, eine Übersäuerung des Körpers (kombinierte respiratorische und metabolische Azidose mit negativem Basenüberschuss) sowie Laktatämie (ein Überschuss an Laktat im Blut) und ein durch erhöhten Sauerstoffverbrauch bedingter Sauerstoffmangel (Hypoxämie). Weitere Frühsymptome sind ventrikuläre Arrhythmien und ein instabiles Blutdruckverhalten sowie nur selten ein Temperaturanstieg.[31]
Spätsymptome
Der namensgebende Temperaturanstieg (Hyperthermie) ist in der Regel[32] ein Spätzeichen (Spätsymptom), kann aber auch das einzige klinische Zeichen einer drohenden MH-Krise sein. Weitere Spätzeichen sind Blutdruckabfall (Hypotonie), Abfall der Sauerstoffsättigung und Zyanose durch extrem erhöhten Sauerstoffverbrauch bei exzessiv gesteigertem Muskelstoffwechsel, Kaliumfreisetzung aus den Zellen (Hyperkaliämie, mitbedingt durch eine erhöhte Zellmembranpermeabilität), bedrohliche Herzrhythmusstörungen bis hin zum Herz-Kreislaufstillstand und Muskelzerfall (Rhabdomyolyse, mit zum Teil, im späteren Verlauf nach über vier Stunden auftretender, extremer Erhöhung von Creatinphosphokinase (CK) und Myoglobin im Blut).[4][1][33]
Überwachung
Neben den Standard-Überwachungsmaßnahmen (EKG, Blutdruckmessung, Pulsoxymetrie, Kapnometrie zur Messung der endtidalen Kohlendioxid-Konzentration, Beurteilung des Muskeltonus) sind zur Sicherung der Diagnose und zur Verlaufskontrolle nach begonnener Behandlung die frühzeitige und wiederholte Entnahme von Blutproben (Blutgasanalyse, Elektrolyte wie Kalium im Serum, Creatinphosphokinase (CK), Transaminasen, Laktat und Myoglobin) notwendig. Der früh einsetzende Anstieg der Kohlendioxidkonzentration in der Ausatemluft ist oft verbunden mit einer starken Erwärmung des CO2-Absorbers am Narkosegerät.[34]
Verlaufsformen
Es werden folgende Verlaufsformen der Malignen Hyperthermie unterschieden:
- Die fulminante Maligne Hyperthermie entwickelt sich krisenhaft rasant und ist charakterisiert durch ein breites Spektrum klinischer Symptome. Das erste Zeichen ist ein schneller, enormer Anstieg der endexspiratorisch gemessenen CO2-Konzentration, verbunden mit einem Anstieg der Herzfrequenz. Eine fulminante MH-Krise liegt vor, wenn der CO2-Partialdruck im arteriellen Blut über 8,0 kPa (60 mmHg) beträgt (Normalwert bis 6,0 kPa; 45 mmHg), ein Basendefizit von > 8 mmol/l bzw. mval/l (Normalwert bis 3 mmol/l) als Zeichen einer schweren metabolischen Azidose vorliegt und/oder ein rascher Temperaturanstieg ohne andere Ursache auf über 38,8 °C gemessen werden kann[35] (Temperaturanstiege von bis zu 1 °C pro 5 Minuten wurden gemessen[36]). Im weiteren Verlauf kommt es zu einer zunehmenden Beeinträchtigung des Kreislaufes mit reflektorischer Erhöhung des Herzminutenvolumens, Tachykardie, Blutdruckabfall und Schädigung des Herzmuskels. Wird die Krise nicht schnell erkannt und behandelt, kommt es durch die Stoffwechselstörungen zu Organschäden wie einem Nierenversagen (Crush-Niere), Schäden des Gehirns (Hirnödem), Blutgerinnungsstörungen (Verbrauchskoagulopathie), und Herz-Kreislaufversagen, die letztlich zum Multiorganversagen und zum Tod führen. Die Ausbildung und Entwicklung einer fulminanten MH geschieht innerhalb von Minuten bis wenigen Stunden.
- Die abortive Maligne Hyperthermie beginnt schleichender, oft erst Stunden, nach der Triggerexposition. Diese Form der Malignen Hyperthermie ist wesentlich häufiger, durch ihr sehr variables klinisches Bild aber oft schwer zu diagnostizieren. Niedrigere Werte von Kohlendioxidpartialdruck, Basendefizit und Temperatur als bei einer fulminanten MH-Krise schließen hierbei eine MH-Diagnose nicht sicher aus.[37] Differenzialdiagnostisch kommen bei entsprechender Symptomatik vor allem eine Sepsis, eine thyreotoxische Krise, ein malignes Neuroleptika-Syndrom oder ein Phäochromozytom in Frage. Ein abortiver Verlauf kann sich jederzeit zu einer fulminanten Krise entwickeln (exazerbieren).
- Bei einem Masseterspasmus handelt es sich um eine starke, akute Verkrampfung des Musculus masseter am Kiefer, die typischerweise nach der Gabe von Succinylcholin auftritt und im Rahmen der endotrachealen Intubation durch eine erschwerte oder unmögliche Mundöffnung auffällt. Während dieses Symptom oft isoliert auftritt, kann es auch eine sich schnell entwickelnde Verlaufsform ankündigen. Eine weitere Manifestation, die ohne weitere Symptome vorkommen kann, ist eine dunkle Verfärbung des Urins durch eine Myoglobinurie infolge einer schweren Schädigung der Skelettmuskulatur (Rhabdomyolyse), wenn Triggersubstanzen im Rahmen einer Narkose verwendet wurden.[38][39]
Therapie
Bei frühzeitiger Verdachtsdiagnose, umgehender Unterbrechung der Zufuhr auslösender Substanzen und sofortiger Behandlung (insbesondere mit dem Medikament Dantrolen) kann die Maligne Hyperthermie meist erfolgreich therapiert werden.
Sofortige Maßnahmen
Die Therapie muss bei Verdacht auf das Vorliegen einer sich entwickelnden MH-Krise nach Feststellung von Frühsymptomen und Ausschluss anderer Ursachen unverzüglich eingeleitet und konsequent weitergeführt werden. Die Maßnahmen zur Behandlung der fulminanten MH sind sehr personalintensiv, zusätzliche Unterstützung muss unmittelbar organisiert werden. Empfehlungen für die Behandlung der Malignen Hyperthermie einschließlich eines Algorithmus liefert die S1-Leitlinie Therapie der malignen Hyperthermie (Stand: März 2018). Beim Verdacht auf die Entwicklung einer MH kurz vor Beginn einer nichtnotfallmäßigen Operation muss der Operateur informiert und der Eingriff verschoben werden. Bei schon begonnener Operation erfolgt eine gemeinsame Entscheidung von Narkosearzt und Operateur darüber, ob (zügig) weiteroperiert oder abgebrochen wird.[1]
Die sofortige Beendigung und Vermeidung der weiteren Zufuhr von MH-Triggersubstanzen ist vorrangig. Beim Einsatz von Inhalationsanästhetika (meist Sevofluran, Desfluran oder Isofluran) wird der Verdampfer vom Narkosegerät entfernt und (zur Aufrechterhaltung bzw. Wiederherstellung einer ausreichenden Sauerstoffsättigung) eine kontrollierte Beatmung mit hohem Frischgasfluss von 10 Litern pro Minute (um eine Rückatmung der Dämpfe zu minimieren) und 100 % Sauerstoff (zur Therapie der bestehenden oder drohenden Hypoxämie) durchgeführt. Ein Auswechseln des Narkosegerätes ist nicht indiziert. Wenn machbar – abhängig vom Narkosegerät –, wird das CO2-Absorbervolumen (Atemkalk) deutlich erhöht. Ebenfalls erhöht wird das Atemminutenvolumen (auf das etwa Drei- bis Vierfache), um das stark angestiegene CO2 durch Abatmung (mittels Hyperventilation) zu normalisieren. Die Narkose wird mit intravenösen Medikamenten (Sedativa wie Propofol, Opioide wie Sufentanil, nicht-depolarisierende Muskelrelaxanzien wie Rocuronium) ohne Triggerwirkung fortgeführt (Total intravenöse Anästhesie, TIVA).[40][1]
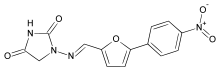
Entscheidend für die Prognose ist die spezifische Therapie durch schnellstmögliche Infusion des Wirkstoffs Dantrolen mit einer Anfangsdosierung von 2,5 mg/kg KG. Dieser ist ein Hydantoin-Derivat, das die Calciumfreisetzung aus dem sarkoplasmatischen Retikulum hemmt. Dantrolen ist der einzige verfügbare Wirkstoff, der eine ursächliche (kausale) Therapie ermöglicht. Daher befindet sich der Wirkstoff auf der Liste der versorgungsrelevanten Wirkstoffe des Bundesinstituts für Arzneimittel und Medizinprodukte (BfArM).[41] Laut der neuen S1-Leitlinie (März 2018) ist zur Notfalltherapie bei Erwachsenen eine Bevorratung mit mindestens 10 mg/kg Körpergewicht Dantrolen notwendig; dies entspricht 36 bis 48 Injektionsflaschen Dantrolen (Eine Flasche Dantrolen enthält 20 mg Dantrolen-Natrium). Da das Notfallmedikament innerhalb weniger Minuten verfügbar sein muss, sollte es in ausreichender Menge unmittelbar in der operativen Einheit gelagert werden. In Kliniken mit weiter auseinanderliegenden Narkoseplätzen empfiehlt die Leitlinie eine Lagerung an mehreren prädestinierten Stellen. Auch in Praxen, die Patienten ambulant in Allgemeinanästhesie und unter Verwendung von Triggersubstanzen der Malignen Hyperthermie versorgen, ist eine ausreichende Vorratshaltung von Dantrolen unerlässlich.[1] Ein Unterschreiten der Mindestmengen kann im Einzelfall zu gefährlichen Verzögerungen führen und gegebenenfalls schwerste Schädigungen des Patienten zur Folge haben.[42]
Die S1-Leitlinie zur Therapie der Malignen Hyperthermie sowie die Guideline der europäischen Malignen Hyperthermie Gruppe (EMHG) empfehlen für die Soforttherapie die etablierte Initialdosis Dantrolen von zunächst 2,5 mg/kg Körpergewicht als Bolusgabe.[43][44][45] Dabei liegt die Dosisobergrenze für den initialen Bolus laut der EMHG-Leitlinie bei 300 mg. Die Gabe muss gegebenenfalls mehrmals und in kurzen Abständen (mindestens alle 10 Minuten) wiederholt werden, bis eine klinische Wirkung durch Normalisierung der hypermetabolen Stoffwechsellage („hypermetaboles Syndrom“) einsetzt und keine MH-Symptome mehr nachweisbar sind. In Einzelfällen, beispielsweise bei stark übergewichtigen Patienten, müssen hierbei auch Dosierungen von 10 mg/kg Körpergewicht überschritten werden.[1] Die Gesamtdosis ist von der klinischen Symptomatik abhängig – daher hat die EMHG keine Obergrenze festgelegt. Die Dantrolengabe kann abgebrochen werden, sobald der arterielle Kohlendioxidpartialdruck (paCO2) bei Normoventilation unter 45 mm Hg [6kPa] fällt.[46] Führt die Bolusgabe von Dantrolen, auch bei Gabe von mehr als 10 mg/kg KG Dantrolen nicht zum Erfolg, muss die Diagnose überdacht werden. Ein Wiederauftreten der MH kann Dantrolengaben mit bis zu 10 mg/kg KG in 24 Stunden, abhängig vom klinischen Verlauf, auch nach erfolgreicher Primärtherapie erforderlich machen.[1] Dantrolen hat eine leicht muskelrelaxierende Wirkung. Meistens jedoch ist nach Beendigung der Narkose trotzdem eine ausreichende Spontanatmung möglich.
Parallel wird eine symptomatische Therapie durchgeführt. Dazu gehört die Stabilisierung des Kreislaufes (sofern notwendig mittels Volumengabe, Vasopressoren oder Inotropika), ein bei kontinuierlichem Ausstrom von Laktat aus der Zelle auch wiederholt notwendiger Ausgleich der metabolischen Azidose (mit Natriumhydrogenkarbonat oder ggf. TRIS-Puffer entsprechend dem Säure-Basen-Status in der Blutgasanalyse) sowie der Elektrolytstörungen, insbesondere der eines hohen Kaliumspiegels (Hyperkaliämie), eine Steigerung der Urinproduktion (Diurese) zur Ausschwemmung nierenfunktionsschädigender Stoffe sowie, wenn unter den bisherigen Maßnahmen noch keine Besserung eingetreten ist die Behandlung von (durch Überwiegen des Sympathikus bedingten und mit der Gefahr einer Herzschwäche einhergehenden) Herzrhythmusstörungen (mit Antiarrhythmika wie Amiodaron oder Betarezeptorenblockern, nicht aber mit wegen möglicher Wechselwirkungen mit Dantrolen kontraindizierten Calciumantagonisten).[47]
Weitere Maßnahmen
Da die Hyperthermie ein Spätsymptom ist, ist eine aktive Kühlung (äußere Maßnahmen zur Oberflächenkühlung des Patienten, kalte Infusionslösungen von etwa 4 °C) bei erhöhter Körpertemperatur bzw. auftretendem Fieber meist erst im Verlauf notwendig. Eine solche Kühlung wird mindestens so lange fortgeführt bis die Körpertemperatur auf unter 38,5 °C gesunken ist. Die forcierte Diurese (mit einer Steigerung der Urinproduktion auf 1 bis 2 ml/kg/Stunde) mit ausreichender Flüssigkeitszufuhr zur Vermeidung eines akuten Nierenversagens, welches aufgrund einer Schocksymptomatik und Rhabdomyolyse entstehen kann, erfordert zum Monitoring der Nierenfunktion einen Blasen-Dauerkatheter, über den ebenfalls eine Kühlung (hypothermische Spülung) erfolgen kann. Kann die Hyperkaliämie oder die Nierenfunktionseinschränkung nicht mit forcierter Diurese mit Schleifendiuretika und Zufuhr einer Glukose-Insulin-Infusion ausreichend behandelt werden, so ist ebenso wie bei anderen therapierefraktären Elektrolytentgleisungen eine Dialyse zu erwägen. Durch die Verabreichung von Heparin kann den im Verlauf möglichen Gerinnungsstörungen (disseminierte intravasale Gerinnung) entgegengewirkt werden.[48] Die Gabe von Kalziumantagonisten ist unwirksam und kann bei gleichzeitiger Dantrolengabe zu Schäden am Herzmuskel führen, sie ist deshalb nicht angezeigt (kontraindiziert).
Die Kreislaufüberwachung sollte (zusätzlich zum Standardmonitoring) mittels invasiver Blutdruckmessung über einen arteriellen Zugang durchgeführt werden. Zudem erfolgt die Anlage eines Zentralen Venenkatheters und das Legen ausreichender peripherer Volumenzugänge. Nach der initialen Stabilisierung des Patienten sind Überwachung und Weiterbehandlung auf einer (anästhesiologischen) Intensivstation für mindestens 24 Stunden notwendig. Kontrolliert werden dort insbesondere Laborparameter (Blutgasanalysen, Elektrolyte, CK, Nierenfunktionswerte). Es besteht neben Hyperkaliämie auch die Gefahr einer Hypernatriämie (durch vorherige Infusions- und Azidosetherapie). Das Ausmaß der Muskelschädigung wird mittels Bestimmung von CK, Transaminasen und Myoglobin (im Serum und im Urin) eingeschätzt. Zur Prophylaxe einer disseminierten intravasalen Gerinnung mit Verbrauchskoagulopathie sollte die Gabe von niedrig-dosiertem Heparin weitergeführt bzw. frühzeitig begonnen werden und die Gerinnungsparameter regelmäßig kontrolliert werden.[49][39]
Prävention
Diagnostik der MH-Veranlagung
Die Indikation zur klärenden Diagnostik an einem MH-Zentrum besteht nach einem Narkosezwischenfall oder dem Verdacht auf das Vorliegen einer familiären Veranlagung. Patienten mit nachgewiesener Hyperthermieneigung (MH-susceptible MHS) werden über die Gefahren der Exposition mit Triggersubstanzen für sie und möglicherweise auch deren Blutsverwandte aufgeklärt und erhalten einen Anästhesieausweis als Attest über die MH-Veranlagung mit entsprechender Warnung.
In-vitro-Kontraktur-Test
Der In-vitro-Kontraktur-Test (IVKT, IVCT) ist ein empfindliches und spezifisches Verfahren (Sensitivität 94 %, Spezifität 99 %) und stellt den Goldstandard der MH-Diagnostik dar.[50]
Hierbei wird in Regionalanästhesie eine Muskelbiopsie aus dem Oberschenkel (Musculus vastus lateralis oder Musculus vastus medialis) entnommen und gemäß dem europäischen Testprotokoll den Triggern Halothan (aufsteigende Dosierungen von 0,5; 1,0; 2,0; 3,0 und ggf. 4,0 Volumenprozent) und Koffein (aufsteigende Dosierungen von 0,5 bis 32 mmol/l) ausgesetzt. Bei Patienten mit MH-Veranlagung tritt eine Kontraktion der entnommenen Probe auf, diese werden als MH-susceptible (MHS) bezeichnet, bei negativer Reaktion als MH-nonsusceptible (MHN). Die Reaktion auf nur eines der beiden Agenzien tritt bei 10 % der Patienten auf (MH-equivocal, MHE), auch diese gelten als gefährdet, obwohl eine abschließende wissenschaftliche Beurteilung solcher Fälle aussteht. Neben dieser Definition der European Malignant Hyperthermia Group[51] existiert eine Testvariante der North American Malignant Hyperthermia Group, nach der auch eine positive Reaktion auf nur einen der beiden Trigger als MH-susceptible bezeichnet wird.[52]
Der Verlässlichkeit des IVCT steht der Nachteil der Invasivität gegenüber. Die Diagnostik sollte frühestens drei Monate nach einem Zwischenfall erfolgen, aufgrund einer möglichen Altersabhängigkeit auch erst ab dem Schulalter.[53] Die Durchführung des In-vitro-Kontraktur-Tests ist zudem logistisch aufwendig. Das Untersuchungsergebnis ist nur am frischen Muskelpräparat aussagekräftig, weswegen von der Entnahme bis zum Abschluss der Untersuchungen höchstens fünf Stunden vergehen dürfen.
Die diagnostische Wertigkeit des IVCT bei unklaren muskulären Symptomen oder einer erhöhten Aktivität der Creatin-Kinase im Blutserum ungeklärter Ursache wird uneinheitlich beurteilt.[54][55]
Molekulargenetische Diagnostik
Bei einem positiven IVCT kann eine molekulargenetische Diagnostik angeschlossen werden, um die zugrundeliegende Mutation zu identifizieren.[56] Dazu reicht eine eingeschickte Blutprobe aus, was die Durchführbarkeit einfach gestaltet, eine Altersbeschränkung besteht nicht. Eine initiale genetische Testung (ohne vorherigen Kontraktionstest) ist wegen der Heterogenität der MH-Veranlagung und der damit bedingten Unsicherheit, Betroffene nicht zu erkennen oder Nicht-Betroffenen falsch zu diagnostizieren, nicht sinnvoll. Ist eine Mutation identifiziert, wird auch den Familienangehörigen eine Untersuchung angeboten. Allerdings stimmen in etwa 5 % die Ergebnisse von Genstatus und IVCT nicht überein, so dass negativ getesteten Personen zum weitgehend sicheren Ausschluss ein IVCT empfohlen wird.[53][56]
Hotline für Maligne Hyperthermie
Die SRH-Kliniken Landkreis Sigmaringen bieten auf ihrer Webseite eine Informationsbroschüre zum Download an, die u. a. Adressen der Diagnostik- und Informationszentren enthält.[57] Für weitere Fragen sowie zur Notfallberatung zur Malignen Hyperthermie steht die deutschlandweite MH-Hotline unter der Rufnummer 07571/100-2828 zur Verfügung.[58]
Eine weitere deutschlandweite 24-Stunden-Hotline für Laien und medizinisches Fachpersonal war 2011 eingerichtet worden: 08221-9600.[59]
Narkosedurchführung
Für jede Einrichtung bzw. Behandlungseinheit, die Triggersubstanzen der MH verwendet ist es sinnvoll, Verfahrensanweisungen[60] bzw. Notfallchecklisten[61] zur Therapie einer Malignen Hyperthermie bereitzuhalten.[62]
Im Prämedikationsgespräch wird anamnestisch nach dem Auftreten der MH in der Familie des Patienten gesucht. Besteht ein Verdacht, wird vor geplanten Eingriffen eine entsprechende Testung durchgeführt.
Wenn für den Eingriff geeignet, können Regionalanästhesieverfahren bei Patienten mit MH-Risiko (genetische Prädisposition, vorhandene risikobehaftete Muskelerkrankung) in der Regel gefahrlos eingesetzt werden. Ist eine Allgemeinanästhesie notwendig, wird auf die Triggersubstanzen (Succinylcholin, Inhalationsanästhetika) verzichtet und eine total intravenöse Anästhesie (TIVA) durchgeführt. Das Narkosegerät muss zuvor mit reinem Sauerstoff durchspült werden, der Narkosegasverdampfer wird entfernt. Eine prophylaktische Gabe von Dantrolen ist nicht angezeigt.[63]
Vorhaltung von Dantrolen
Leitlinie der Europäischen Malignen Hyperthermie Gruppe
Die 2020 publizierte Leitlinie der EMHG (European Malignant Hyperthermia Group) gibt Empfehlungen zur Bevorratungsmenge und Lagerung von Dantrolen. Dantrolen sollte überall dort sofort verfügbar sein, wo Triggersubstanzen (Auslöser) der Malignen Hyperthermie (volatile Anästhetika volatile Anästhetika und Succinylcholin) verwendet werden. Dazu gehören nicht nur der anästhesiologische Arbeitsplatz im OP, sondern auch Intensivstationen, Eingriffsräume in Psychiatrien oder ambulante OP-Zentren.[64]
Entscheidend ist laut der europäischen Leitlinie, dass ein strukturierter Prozess etabliert, als SOP festgehalten und dem ganzen Team bekannt sein sollte. Somit kann die dosisgerechte Versorgung mit Dantrolen garantiert werden. Dabei sollte der Bolus innerhalb von 5 Minuten verabreicht werden – jede weitere Gabe in 10-minütigen Abständen. Zu diesem Zwecke gibt die EMHG-Guideline konkrete Bevorratungsempfehlungen. 36 Flaschen Dantrolen sollten sofort verfügbar sein, was eine 20- bis 30-minütige Behandlung bei erwachsenen Patienten sicherstellt. Wenn zusätzliche Vorräte nicht innerhalb von 30 Minuten beschafft werden können, sollte der Lagerbestand auf 48 Flaschen erhöht werden. Weiter entfernte Einrichtungen, von denen nicht innerhalb einer Stunde zusätzliche Dantroleneinheiten beschafft werden können, sollten 60 Flaschen lagern. Dabei müssen die Dantrolen-Vorräte für den schwersten Patienten, den eine Einrichtung versorgt, ausreichen. Falls beispielsweise stark übergewichtige Patienten behandelt werden, sollten die Bevorratungsmenge von Dantrolen auch auf diese Patienten ausgelegt sein.[65]
Der Lagerort des Notfallmedikaments sollte allen Mitarbeitern bekannt und leicht zu lokalisieren sein. Dantrolen-Flaschen sollten in Notfall-Kits zusammen mit den erforderlichen Mengen an Wasser für Injektionszwecke gelagert werden. Die Notfall-Kits sollten darüber hinaus aktuelle Telefonnummern zu den nächstgelegenen Beschaffungsmöglichkeiten für Dantrolen enthalten.[66]
Wenn Dantrolenvorräte nicht mehr ausreichen oder komplett aufgebraucht sind, empfiehlt die europäische Leitlinie, dass die Verwendung von Inhalationsanästhetika und Succinylcholin für geplante Eingriffe vermieden werden sollte, bis die Dantrolenvorräte aufgefüllt wurden.[67]
Rechtliche Aspekte
Laut § 630e BGB ist der Arzt dazu verpflichtet, den Patienten sowohl über Art und Umfang als auch über mögliche Risiken des bevorstehenden Eingriffes aufzuklären. Hierbei müssen alternative Behandlungsmethoden ebenfalls in Betracht gezogen werden, solange diese gleichermaßen zum Erfolg des Eingriffes führen.[68] Auf das Risiko einer MH und deren Häufigkeit wird in allgemeinen Aufklärungsgesprächen zur Anästhesie hingewiesen. Sollte sich jedoch aus der Anamnese des Patienten der Verdacht einer Eigen- oder Familiendisposition ergeben, muss der Patient über die Möglichkeit einer MH-Krise aufgeklärt werden und diese Aufklärung schriftlich dokumentiert werden. Sollte es nach einer Operation zu einem Schadenersatzprozess kommen, kann im Zweifel die Dokumentation einer ordnungsgemäßen Aufklärung und Einwilligung des Patienten prozessentscheidend sein.[69] Aufgrund des zeitkritischen Einsatzes des Notfallmedikamentes ist die Lagerung des Wirkstoffes in der operativen Einheit notwendig. In Kliniken mit weiter auseinanderliegenden Operationseinheiten sollte das Notfallmedikament auch an mehreren Stellen gelagert werden. Auch auf Intensivstationen und in anästhesiologischen Praxen muss ausreichend Dantrolen vorhanden sein.[1][69] Laut einem Urteil des Bundesgerichtshofes aus dem Jahr 1990 „kann ein Organisationsverschulden des Krankenhausträgers darin liegen, dass ein Medikament […] nicht rechtzeitig vor der Operation zur Verfügung steht.[69]“ Nationale Fachgesellschaften und internationale Expertengruppen empfehlen, dass in jeder Anästhesie- oder Intensiveinheit, in der MH-Triggersubstanzen verwendet werden, Handlungsempfehlungen (SOPs) zur Prävention, zum Erkennen und Behandeln einer MH-Krise vorzuhalten sind.[42][70] Die Festlegung der Menge des zu bevorratenden Medikaments liegt in der Verantwortung des Abteilungsleiters, die Bevorratung selbst liegt in der Obhut des Leiters der Klinikapotheke.[69]
Geschichte
Schon in den Anfangszeiten der Anästhesie, als Äther- und Chloroformnarkosen die Regel waren, wurde über „Hitzschläge“ und „Ätherkrämpfe“ berichtet, denen wahrscheinlich eine Maligne Hyperthermie zugrunde lag.[71] Die ersten Veröffentlichungen über solche Ereignisse in der internationalen Fachliteratur gehen auf das Jahr 1900 zurück. Der Kinderchirurg Louis Ombrédanne (1871–1956), der neben einem 1908 entwickelten Ätherverdampfer auch weitere Verbesserungen zur Narkosetechnik beitrug, ist Namensgeber des Hyperpyrexie-Syndroms.[72]
Als eigenständiges Krankheitsbild wurde die Maligne Hyperthermie erstmals 1960 durch M. A. Denborough und R. R. Lovell beschrieben.[73] Den Zusammenhang zwischen genetischer Disposition und der Auslösung durch die Allgemeinanästhesie beschrieb Michael Denborough. 1962 in Australien.[74] Dieser hatte den Fall eines jungen Studenten untersucht, der wegen eines Unterschenkelbruches operiert worden war und nach Verabreichung von Halothan die Symptome einer fulminanten Malignen Hyperthermie entwickelt hatte. Der Patient wurde mit Eis gekühlt und überlebte die Krise. Es stellte sich heraus, dass zuvor bereits zehn nahe Verwandte bei Narkosen verstorben waren.[75] Verläufe bei Schweinen nach der Gabe von Succinylcholin wurden wenig später veröffentlicht.[76] Die Wirksamkeit von Dantrolen zur Behandlung der Malignen Hyperthermie wurde 1975 zunächst ebenfalls bei Schweinen nachgewiesen,[77] 1979 zur Behandlung der Malignen Hyperthermie klinisch eingeführt und 1982 in einer klinischen Studie auch beim Menschen bestätigt.[78] Im Jahr 1983 erfolgte die Gründung der European Malignant Hyperpyrexia Group, ein Zusammenschluss von Ärzten aus acht Ländern.[79] Im selben Jahr wurde der Kontrakturtest zur Diagnose der MH eingeführt, der seit 2001 durch die genetische Diagnostik ergänzt wird. Bereits 1990 hatten zwei Arbeitsgruppen unabhängig voneinander den Genort der meisten MH-assoziierten Mutationen identifiziert.[80][81]
Literatur
- Werner Klingler (Hrsg.): Maligne Hyperthermie und assoziierte Erkrankungen in Anästhesie und Intensivmedizin. Thieme, Stuttgart 2016, ISBN 978-3-13-240868-5.
- Deutsche Gesellschaft für Anästhesiologie und Intensivmedizin, Deutsche Interdisziplinäre Vereinigung für Intensiv- und Notfallmedizin: S1-Leitlinie: Therapie der malignen Hyperthermie. Erarbeitet von Werner Klingler, Norbert Roewer, Frank Schuster und Frank Wappler. In: Anästh Intensivmed. Band 59, 2018, S. 204–208.
- Frank Wappler: S1-Leitlinie maligne Hyperthermie, Update 2018. In: Anaesthesist. Band 67, 2018, S. 529–532.
- Werner Klingler, E. Pfenninger: Inhalative Analgosedierung auf der Intensivstation. In: Medizinische Klinik – Intensivmedizin und Notfallmedizin. , doi:10.1007/s00063-018-0453-7.
- E. Pfenninger, M. Minde, S. Heiderich, Werner Klingler: SOPs und Guidelines zur malignen Hyperthermie. In: Anästh Intensivmed. Band 59, 2018, S. 4–11.
- H. Rosenberg, N. Pollock, A. Schiemann, T. Bulger, K. Stowell: Malignant hyperthermia: a review. In: Orphan J Rare Dis. Band 10, 2015, S. 93.
- Thomas Metterlein, Frank Schuster, B. M. Graf, Martin Anetseder: Maligne Hyperthermie. In: Anaesthesist. Band 63, 2014, S. 908–918.
- Martin Anetseder, N. Roewer: Maligne Hyperthermie. In: Rossaint, Werner, Zwissler (Hrsg.): Die Anästhesiologie. Allgemeine und spezielle Anästhesiologie, Schmerztherapie und Intensivmedizin. 2. Auflage. Springer, Berlin 2008, ISBN 978-3-540-76301-7.
- H. Rüffert, M. Wehner, C. Deutrich, D. Olthoff: Maligne Hyperthermie – The ugly. In: Anaesthesist. 2007 Sep;56(9), S. 923–929. Review. PMID 17565473
- H. Rosenberg, M. Davis, D. James, N. Pollock, K. Stowell: Malignant hyperthermia. In: Orphanet J Rare Dis. 2007 Apr 24;2, S. 21. Review. PMID 17456235
- H. Rosenberg, N. Sambuughin: Malignant Hyperthermia Susceptibility GeneReviews. University of Washington, Seattle 2006.
- M. Steinfath, F. Wappler, J. Scholz: Maligne Hyperthermie. Allgemeine, klinische und experimentelle Aspekte. In: Anaesthesist. 2002 Apr;51(4), S. 328–345. Review. PMID 12063729
- M. U. Gerbershagen: Triggerfreie Anästhesie – wie, wann und warum? Refresher Course Nr. 40, Mai 2014 Leipzig
Weblinks
- European Malignant Hyperthermia Group
- S1-Leitlinie: Therapie der malignen Hyperthermie
- Universitätsklinikum Leipzig: Maligne Hyperthermie
Einzelnachweise
- Deutsche Gesellschaft für Anästhesiologie und Intensivmedizin: S1-Leitlinie: Therapie der malignen Hyperthermie. In: Anästh Intensivmed. 2018, S. 204–208.
- T. Girard, O. Bandschapp: Maligne Hyperthermie. In: Anästhesiologie & Intensivmedizin. Band 60, 2019, S. 135–143. DOI: 10.19224/ai2019.135
- R.S. Litman, C.D. Flood, R.F. Kaplan, Y.L. Kim, J.R. Tobin: Postoperative malignant hyperthermia. An analysis of cases from the North American Malignant Hyperthermia Registry. In: Anesthesiology. Band 109, 2008, S. 825–829.
- Werner Klingler, E. Pfenninger: Inhalative Analgosedierung auf der Intensivstation. In: Medizinische Klinik - Intensivmedizin und Notfallmedizin. 3. August 2018, ISSN 2193-6218.
- H. Rosenberg, N. Pollock, A. Schiemann, T. Bulger, K. Stowell: Malignant hyperthermia: a review. 2015.
- Deutsche Gesellschaft für Anästhesiologie und Intensivmedizin: S1-Leitlinie: Therapie der malignen Hyperthermie. 2018, S. 205 f.
- M.G. Larach u. a.: Cardiac arrests and deaths associated with malignant hyperthermia in North America from 1887 to 2006. A Report from the North American Malignant Hyperthermia Registry of the Malignant Hyperthermia Association of the United States. In: Anesthesiology. Band 108, 2008, S. 603–611.
- Frank Lehmann-Horn, Werner Klingler, Karin Jurkat-Rott: Nonanesthetic Malignant Hyperthermia. In: Anesthesiology: The Journal of the American Society of Anesthesiologists. Band 115, Nr. 5, 1. November 2011, ISSN 0003-3022, S. 915–917, doi:10.1097/ALN.0b013e318232008f (asahq.org [abgerufen am 19. Oktober 2018]).
- S. Wolak, B., Rücker, N. Kohlschmidt, S. Doetsch, O. Bartsch, U. Zechner, Irene Tzanova: Homozygous and compound heterozygous RYRI mutations. New findings on prevalence and penetrance of malignant hyperthermia. In: Anaesthesist. Band 63, 2014, S. 643–650.
- Deutsche Gesellschaft für Anästhesiologie und Intensivmedizin: S1-Leitlinie: Therapie der malignen Hyperthermie. 2018, S. 204.
- Statistisches Bundesamt: Gesundheit. Grunddaten der Krankenhäuser. Fachserie 12 Reihe 6.1.1-2017, 2017.
- Deutsche Gesellschaft für Anästhesiologie und Intensivmedizin: S1-Leitlinie: Therapie der malignen Hyperthermie. 2018, S. 204.
- W. Klingler, S. Heiderich u. a.: Functional and genetic characterization of clinical malignant hyperthermie crises: a multi-centre study. In: Orphan J Rare Dis. Band 9, 2014, S. 8.
- Deutsche Gesellschaft für Anästhesiologie und Intensivmedizin: S1-Leitlinie: Therapie der malignen Hyperthermie. 2018, S. 204.
- Rosenberg u. a. 2007; Anetseder und Roewer 2008, S. 1315.
- Wolfgang Löscher: Narkotika. In: Löscher, Ungemach (Hrsg.): Pharmakotherapie bei Haus- und Nutztieren. 7. erw. Auflage. Paul Parey, 2006, ISBN 3-8304-4160-6, S. 66–82.
- Roman T. Skarda: Maligne Hyperthermie. In: Peter F. Suter, Hans G. Niemand (Hrsg.): Praktikum der Hundeklinik. 10. Auflage. Paul-Parey-Verlag, Stuttgart 2006, ISBN 3-8304-4141-X, S. 146.
- Schmidt, Lang (Hrsg.): Physiologie des Menschen: Mit Pathophysiologie. 30. Auflage. Springer, Berlin 2007, ISBN 978-3-540-32908-4, S. 115–121.
- Deutsche Gesellschaft für Anästhesiologie und Intensivmedizin: S1-Leitlinie: Therapie der malignen Hyperthermie. 2018, S. 204.
- Deutsche Gesellschaft für Anästhesiologie und Intensivmedizin: S1-Leitlinie: Therapie der malignen Hyperthermie. 2018, S. 206.
- Rüffert u. a. 2007, S. 923ff; Rosenberg u. a. 2007.
- Online Mendelian Inheritance in Man – Malignant Hyperthermia Susceptibility (abgerufen am 5. Juli 2019)
- Monnier u. a.: A homozygous splicing mutation causing a depletion of skeletal muscle RYR1 is associated with multi-minicore disease congenital myopathy with ophthalmoplegia. In: Hum Mol Genet. 2003;12, S. 1171–1178 PMID 12719381
- Zhang u. a.: A mutation in the human ryanodine receptor gene associated with central core disease. In: Nature Genet. 1993;5, S. 46–50 PMID 8220422
- Rosenberg und Sambuughin 2007; Rosenberg u. a. 2007; Anetseder und Roewer 2008, S. 1316.
- G. Bollig, S. Mohr, J. Raeder: McArdle's disease and anaesthesia: case reports. Review of potential problems and association with malignant hyperthermia. In: Acta anaesthesiologica Scandinavica. Band 49, Nummer 8, September 2005, S. 1077–1083, ISSN 0001-5172. doi:10.1111/j.1399-6576.2005.00755.x. PMID 16095447. (Review).
- F. Protasi u. a.: Calsequestrin-1: a new candidate gene for malignant hyperthermia and exertional/environmental heat stroke. In: J Physiol. 2009 Jul 1;587(Pt 13), S. 3095–3100.
- Bendahan u. a.: A noninvasive investigation of muscle energetics supports similarities between exertional heat stroke and malignant hyperthermia. In: Anesth Analg. 2001 Sep;93(3), S. 683–689.
- Denborough MA, Lovell R, Anaesthetic deaths in a family. Lancet 1960 276:45
- Anetseder und Roewer 2008; Rosenberg u. a. 2007, Rüffert u. a. 2007.
- Deutsche Gesellschaft für Anästhesiologie und Intensivmedizin: S1-Leitlinie: Therapie der malignen Hyperthermie. 2018, S. 205 f.
- Deutsche Gesellschaft für Anästhesiologie und Intensivmedizin: S1-Leitlinie: Therapie der malignen Hyperthermie. 2018, S. 205 f.
- Deutsche Gesellschaft für Anästhesiologie und Intensivmedizin: S1-Leitlinie: Therapie der malignen Hyperthermie. 2018, S. 204 f.
- Deutsche Gesellschaft für Anästhesiologie und Intensivmedizin: S1-Leitlinie: Therapie der malignen Hyperthermie. 2018, S. 204–206.
- M. G. Larach, A. R. Localio, G. C. Allen u. a.: A clinical grading scale to predict malignant hyperthermia susceptibility. In: Anesthesiology. Band 80, 1994, S. 771–779.
- Deutsche Gesellschaft für Anästhesiologie und Intensivmedizin: S1-Leitlinie: Therapie der malignen Hyperthermie. 2018, S. 205.
- Deutsche Gesellschaft für Anästhesiologie und Intensivmedizin: S1-Leitlinie: Therapie der malignen Hyperthermie. 2018, S. 205.
- Rosenberg u. a. 2007; Anetseder und Roewer 2008, S. 1317–1318.
- Deutsche Gesellschaft für Anästhesiologie und Intensivmedizin (DGAI): Empfehlung zur Therapie der malignen Hyperthermie. Revidierte Version 2008.
- K.P.E. Glahn u. a.: Recognizing and managing a malignant hyerthermia crisis: guidelines from the European Malignant Hyperthermia Group. In: Brit J Anaesth. Band 105, 2010, S. 417–420.
- Liste der versorgungsrelevanten Wirkstoffe (ohne Impfstoffe). (PDF) Bundesinstitut für Arzneimittel und Medizinprodukte, abgerufen am 19. September 2018.
- Frank Wappler: S1-Leitlinie Maligne Hyperthermie. In: Der Anaesthesist. Band 67, Nr. 7, 26. Juni 2018, ISSN 0003-2417, S. 529–532, doi:10.1007/s00101-018-0462-1.
- Glahn KP, Bendixen D, Girard T, et al. Availability of dantrolene for the management of malignant hyperthermia crises: European Malignant Hyperthermia Group Guidelines, British Journal of Anaesthesia, 125 (2): 133e140 (2020)
- T. Krause, M.U. Gerbershagen, M. Fiege, R. Weißhorn, F. Wappler: Dantrolene: a review of its pharmacology, therapeutic use and new developments. In: Anaesthesia. Band 59, 2004, S. 364–373.
- B. Bastian, S. Heiderich, Frank Schuster et al.: Kommentar zur Leitlinie der European Malignant Hyperthermia Group zur Verfügbarkeit von Dantrolen für die Behandlung der Malignen Hyperthermie. In: Anaesthesist. Band 69, 2020, S. 751–752.
- B. Bastian, S. Heiderich, Frank Schuster et al.: Kommentar zur Leitlinie der European Malignant Hyperthermia Group zur Verfügbarkeit von Dantrolen für die Behandlung der Malignen Hyperthermie. In: Der Anaesthesist. Band 69, 2020, S. 751–752.
- Deutsche Gesellschaft für Anästhesiologie und Intensivmedizin: S1-Leitlinie: Therapie der malignen Hyperthermie. 2018, S. 205 f.
- Deutsche Gesellschaft für Anästhesiologie und Intensivmedizin: S1-Leitlinie: Therapie der malignen Hyperthermie. 2018, S. 205–207.
- Deutsche Gesellschaft für Anästhesiologie und Intensivmedizin: S1-Leitlinie: Therapie der malignen Hyperthermie. 2018, S. 206 f.
- H. Ording, V. Brancadoro, S. Cozzolino u. a.: In vitro contracture test for diagnosis of malignant hyperthermia following the protocol of the European MH Group: results of testing patients surviving fulminant MH and unrelated low-risk subjects. The European Malignant Hyperthermia Group. In: Acta Anaesthesiol Scand. 1997 Sep;41(8), S. 955–966. PMID 9311391.
- P.M. Hopkins, Henrik Rüffert, M.M. Snoeck, Thierry Girard, K.P.E. Glahn, F.R. Ellis, C.R. Müller, A. Urwyler: European Malignant Hyperthermia Group guidelines for investigation of malignant hyperthermia susceptibility. In: British Journal of Anaesthesia. 115, 2015, S. 531, doi:10.1093/bja/aev225.
- M. G. Larach: Standardization of the caffeine halothane muscle contracture test. North American Malignant Hyperthermia Group. In: Anesth Analg. 1989 Oct;69(4), S. 511–515. PMID 2675676
- Anetseder 2008, S. 1321; Rosenberg 2007.
- Malandrini u. a.: Muscle biopsy and in vitro contracture test in subjects with idiopathic HyperCKemia. In: Anesthesiology. 2008;109(4), S. 625–628. PMID 18813041
- Weglinski u. a.: Malignant Hyperthermia Testing in Patients with Persistently Increased Serum Creatine Kinase Levels. In: Anesth Analg. 1997;84(5), S. 1038–1041. PMID 9141928.
- A. Urwyler, T. Deufel, T. McCarthy, West S; European Malignant Hyperthermia Group: Guidelines for molecular genetic detection of susceptibility to malignant hyperthermia. In: Br J Anaesth. 2001 Feb;86(2), S. 283–287. PMID 11573677
- Maligne Hyperthermie. (PDF) SRH Kliniken Landkreis Sigmaringen, abgerufen am 19. Oktober 2018.
- Deutsche Gesellschaft für Anästhesiologie und Intensivmedizin: S1-Leitlinie: Therapie der malignen Hyperthermie. 2018, S. 208.
- Werner Klingler, F. Lehmann-Horn, U. Schulte-Sasse: Hotline für maligne Hyperthermie. In: Anaesthesist. Band 60, 2011, S. 172–174.
- Jannicke Mellin-Olsen u. a.: The Helsinki Declaration on patient safety in anaesthesiology. In: European Journal of Anaesthesiology. Band 27, 2010, S. 592–597.
- A. F. Arriaga u. a.: Simulation-based trial of surgical-crisis checklists. In: New England Journal of Medicine. Band 368, 2013, S. 246–253.
- Deutsche Gesellschaft für Anästhesiologie und Intensivmedizin: S1-Leitlinie: Therapie der malignen Hyperthermie. 2018, S. 207.
- Rosenberg u. a. 2007, Anetseder und Roewer 2008.
- B. Bastian, S. Heiderich, Frank Schuster et al.: Kommentar zur Leitlinie der European Malignant Hyperthermia Group zur Verfügbarkeit von Dantrolen für die Behandlung der Malignen Hyperthermie. In: Der Anaesthesist. Band 69, 2020, S. 751–752.
- B. Bastian, S. Heiderich, Frank Schuster et al.: Kommentar zur Leitlinie der European Malignant Hyperthermia Group zur Verfügbarkeit von Dantrolen für die Behandlung der Malignen Hyperthermie. In: Der Anaesthesist. Band 69, 2020, S. 751–752.
- B. Bastian, S. Heiderich, Frank Schuster et al.: Kommentar zur Leitlinie der European Malignant Hyperthermia Group zur Verfügbarkeit von Dantrolen für die Behandlung der Malignen Hyperthermie. In: Der Anaesthesist. Band 69, 2020, S. 751–752.
- B. Bastian, S. Heiderich, Frank Schuster et al.: Kommentar zur Leitlinie der European Malignant Hyperthermia Group zur Verfügbarkeit von Dantrolen für die Behandlung der Malignen Hyperthermie. In: Der Anaesthesist. Band 69, 2020, S. 751–752.
- § 630 Abs. 1 BGB.
- Werner Klingler: Maligne Hyperthermie und assoziierte Erkrankungen in Anästhesie und Intensivmedizin. 2016;21-23.
- E. Pfenninger, M. Minde, S. Heiderich, Werner Klingler: SOPs und Guidelines zur malignen Hyperthermie. In: Anästh Intensivmed. Nr. 59, 2018, S. 4–11.
- G. G. Harrison, H. Isaacs: Malignant hyperthermia. An historical vignette. In: Anaesthesia. 1992 Jan;47(1), S. 54–56. PMID 1536407
- Christoph Weißer: Ombrédanne, Louis. In: Werner E. Gerabek, Bernhard D. Haage, Gundolf Keil, Wolfgang Wegner (Hrsg.): Enzyklopädie Medizingeschichte. De Gruyter, Berlin 2005, ISBN 3-11-015714-4, S. 1069.
- Michael Heck, Michael Fresenius: Repetitorium Anaesthesiologie. Vorbereitung auf die anästhesiologische Facharztprüfung und das Europäische Diplom für Anästhesiologie. 3., vollständig überarbeitete Auflage. Springer, Berlin/Heidelberg/ New York u. a. 2001, ISBN 3-540-67331-8, S. 804.
- M. A. Denborough, J. F. Forster, R. R. Lovell, P. A. Maplestone, J. D. Villiers: Anaesthetic deaths in a family. In: Br J Anaesth. 1962 Jun;34, S. 395–396. PMID 13885389
- M. A. Denborough: Malignant hyperthermia. 1962. In: Anesthesiology. Band 108, Nummer 1, Januar 2008, S. 156–157, doi:10.1097/01.anes.0000296107.23210.dd, PMID 18156894.
- L. W. Hall, N. Woolf, J. W. Bradley, D. W. Jolly: Unusual reaction to suxamethonium chloride. In: Br Med J. 1966 Nov 26;2(5525), S. 1305. PMID 5924819
- Gaisford G. Harrison: Control of the malignant hyperpyrexic syndrome in MHS swine by dantrolene sodium. In: Br J Anaesth. 1975 Jan;47(1), S. 62–65. PMID 1148076
- M. E. Kolb, M. L. Horne, R. Martz: Dantrolene in human malignant hyperthermia. In: Anesthesiology. 1982, Apr;56(4), S. 254–262. PMID 7039419
- Michael Heck, Michael Fresenius: Repetitorium Anaesthesiologie. Vorbereitung auf die anästhesiologische Facharztprüfung und das Europäische Diplom für Anästhesiologie. 3., vollständig überarbeitete Auflage. Springer, Berlin/Heidelberg/ New York u. a. 2001, ISBN 3-540-67331-8, S. 804.
- McCarthy u. a.: Localization of the malignant hyperthermia susceptibility locus to human chromosome 19q12-13.2. In: Nature. 1990 Feb 8;343(6258), S. 562–564. PMID 2300206
- MacLennan u. a.: Ryanodine receptor gene is a candidate for predisposition to malignant hyperthermia. In: Nature. 1990 Feb 8;343(6258), S. 559–561. PMID 1967823