Dabigatranetexilat
Dabigatranetexilat ist ein Arzneistoff aus der Gruppe der Gerinnungshemmer (Antikoagulanzien); genauer der nicht-peptidischen Thrombin-Inhibitoren. Die Substanz ist ein Prodrug, das nach Umwandlung in das pharmakologisch aktive Dabigatran den Blutgerinnungsfaktor IIa (Thrombin) direkt hemmt. Nach der Einnahme wird der Stoff in der Niere aus dem Blut gefiltert und über den Urin eliminiert, weshalb Dabigatranetexilat als Gerinnungshemmer für Patienten mit Niereninsuffizienz nicht geeignet ist.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
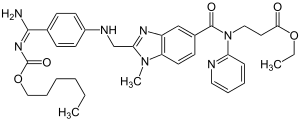 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Dabigatranetexilat | |||||||||||||||||||||
| Andere Namen |
Ethyl-3-{[(2-{[(4-{N′-[(hexyloxy)-carbonyl]carbamimidoyl}-phenyl)-amino]-methyl}-1-methyl-1H-benzimidazol-5-yl)-carbonyl]-(2-pyridinyl)-amino}-propanoat | |||||||||||||||||||||
| Summenformel |
| |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
B01AE07 | |||||||||||||||||||||
| Wirkstoffklasse |
Direkter Thrombin-Inhibitor | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 627,73 g·mol−1 | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| pKS-Wert | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Dabigatranetexilat ist für die perorale Verabreichung geeignet und in dieser Form (Handelsname Pradaxa; Hersteller Boehringer Ingelheim) in der EU zugelassen zur Vorbeugung gegen die Bildung von Blutgerinnseln in den Venen nach elektivem chirurgischen Knie- oder Hüftgelenksersatz, seit 2011 außerdem zur Schlaganfallvorbeugung bei Patienten mit Vorhofflimmern und Schlaganfallrisiko.[4][5]
Pharmakologische Eigenschaften
Dabigatranetexilat selbst ist pharmakologisch inaktiv. Nach Resorption entsteht im Plasma und in der Leber durch eine von Esterasen katalysierte Hydrolyse der Prodrug-Form die wirksame Form Dabigatran. Die absolute Bioverfügbarkeit nach peroraler Gabe liegt bei circa 6,5 %, maximale Plasmaspiegel werden nach 0,5 bis 2 Stunden erreicht. Die terminale Halbwertszeit von Dabigatran lag im Mittel bei 12–14 Stunden (gesunde Probanden) beziehungsweise 14–17 Stunden (Patienten nach einem größeren orthopädischen Eingriff).[6]
Dabigatran bindet kompetitiv und reversibel direkt an Thrombin und blockiert dessen Wirkung, so dass die Umwandlung von Fibrinogen zu Fibrin und damit eine Gerinnselentstehung unterbleibt. Dabigatran verhindert somit auch die Thrombin-induzierte Verklumpung der Blutplättchen (Thrombozytenaggregation). Die gerinnungshemmende (antikoagulatorische) Wirkung des Dabigatran korreliert mit seiner Konzentration im Plasma: die therapeutische Konzentration liegt bei 0,05–0,1 mg/l, messbar als 10–20 % der Norm im neuen F10a/F2a Gerinnungstest EXCA (extrinsic coagulation activity assay).
In-vitro-Wechselwirkungsstudien zeigten, dass Dabigatran die wichtigsten Cytochrome P450 weder inhibiert noch induziert. Dabigatran wird hauptsächlich in unveränderter Form über den Urin ausgeschieden.
Klinische Angaben
Anwendung
Dabigatranetexilat ist zur Anwendung bei Erwachsenen zugelassen. Die Substanz wird in fester Tagesdosis zwei Mal täglich gegeben, ein Gerinnungs-Monitoring ist nicht notwendig.
Ältere Patienten über 75 Jahren sollten mit Vorsicht behandelt werden, da klinische Daten für diese Altersgruppe nur eingeschränkt vorliegen. Patienten mit leichter bis mittelgradiger Niereninsuffizienz sowie Patienten, die Amiodaron einnehmen, sind vorsichtig und mit reduzierter Dosis zu behandeln. Aufgrund des Fehlens von Daten zur Unbedenklichkeit und Wirksamkeit wird Pradaxa nicht empfohlen für die Anwendung bei Patienten unter 18 Jahren. Es liegen keine hinreichenden Daten für die Anwendung von Dabigatranetexilat bei Schwangeren vor. Frauen im gebärfähigen Alter sollten daher während einer Behandlung mit dem Mittel eine Schwangerschaft vermeiden, auch sollte bei einer bestehenden Schwangerschaft Dabigatranetexilat möglichst nicht angewendet werden. Stillende Frauen sollten das Stillen während einer Behandlung mit Dabigatranetexilat unterbrechen.[6]
Die Behandlung mit Dabigatranetexilat sollte bei rückenmarksnahen Anästhesieverfahren wie Spinalanästhesie oder Periduralanästhesie frühestens vier bis sechs Stunden nach der Punktion bzw. nach der Katheterentfernung und bei unauffälligem neurologischen Befund begonnen werden. Vor einer Rückenmarkanästhesie sollten mindestens 34 Stunden seit der letzten Einnahme von Dabigatranetexilat vergangen sein.[7][8]
Gegenanzeigen
Die Behandlung mit Dabigatranetexilat ist kontraindiziert bei akuten Blutungen, schwerer Niereninsuffizienz (Kreatinin-Clearance unter 30 Milliliter/Minute), beeinträchtigter Leberfunktion, künstlicher Herzklappe mit gerinnungshemmender Therapie.[9] Vor Behandlungsbeginn ist in jedem Fall eine Bestimmung der Kreatinin-Clearance notwendig, auch muss die Nierenfunktion während der Behandlung angemessen kontrolliert werden.[10]
Nebenwirkungen
Die häufigsten Nebenwirkungen sind Blutungen.[6] Dabei zeigte die RE-LY-Studie, dass insgesamt das Risiko für schwere Blutungen unter der Gabe von Dabigatranetexilat niedriger ist im Vergleich zu Warfarin. Bei schweren Blutungen besteht für solche mit tödlichem Ausgang unter Behandlung mit Dabigatranetexilat bei einer Dosis von zweimal täglich 150 mg ein vergleichbares Risiko (0,23 % pro Jahr) wie unter der Behandlung mit Warfarin (0,33 % pro Jahr), bei einer niedrigeren Dosis (zweimal täglich 110 mg Dabigatranetexilat) ist das Risiko niedriger (0,19 % pro Jahr) als bei Warfarin.[11] Das relative Blutungsrisiko für Dabigatranetexilat gegenüber Warfarin erhöht sich mit zunehmendem Alter oder bei einer eingeschränkten Nierenfunktion, was bei der Nutzen-Risiko-Abwägung zu berücksichtigen ist. Die Anzahl roter Blutkörperchen im Blut kann abnehmen.
Im September 2013 wiesen die Hersteller der „neuen oralen Antikoagulanzien“ (Apixaban, Dabigatranetexilat und Rivaroxaban) in einem gemeinsamen, mit den zuständigen Arzneimittelbehörden abgestimmten Informationsbrief darauf hin, dass Meldungen unerwünschter Arzneimittelwirkungen (UAW) aus klinischen Studien und aus der Praxis gezeigt haben, dass auch bei den neuen oralen Antikoagulanzien ein signifikantes Risiko für schwere Blutungsereignisse, auch mit Todesfolge, besteht. Um das Blutungsrisiko zu minimieren, müssen die verordnenden Ärzte das Blutungsrisiko der Patienten individuell beurteilen und die Angaben zu Dosierung und Gegenanzeigen sowie Warnhinweise und Vorsichtsmaßnahmen beachten. Gemeinsam sind allen neuen oralen Antikoagulanzien die folgenden Gegenanzeigen:
- akute, klinisch relevante Blutungen
- Läsionen oder klinische Situationen, die als signifikanter Risikofaktor einer schweren Blutung angesehen werden
- gleichzeitige Anwendung von anderen Antikoagulanzien wie zum Beispiel Heparinen oder Vitamin-K-Antagonisten (mit wenigen Ausnahmen).
Auch eine Nierenfunktionsstörung kann eine Gegenanzeige darstellen, allerdings gelten hierbei für die drei Arzneimittel unterschiedliche Empfehlungen.[12]
Als Antidot ist (Idarucizumab, Handelsname: Praxbind) zugelassen, welches die Dabigatran-Wirkung innerhalb von Minuten aufhebt.[13]
Wechselwirkungen mit anderen Mitteln
Die gleichzeitige Einnahme von anderen Hemmern der Blutgerinnung (z. B. Warfarin, Heparine) oder nichtsteroidalen Antirheumatika können zu einer Blutungsgefahr führen, da sich die gerinnungshemmenden Effekte addieren.
Dabigatranetexilat konkurriert mit einigen Medikamenten um den Effluxtransporter P-Glykoprotein, wodurch die Serumspiegel ansteigen. Es ist daher bei gleichzeitiger Einnahme von Chinidin, Ketoconazol, Itraconazol, Cyclosporin oder Tacrolimus kontraindiziert, bei Einnahme von Verapamil soll die Dabigatrandosis reduziert werden. Hingegen induzieren Rifampicin, Carbamazepin und Inhaltsstoffe aus dem Johanniskraut das P-Glykoprotein, so dass die Dabigatranserumspiegel erniedrigt werden. Dabigatran und sein Prodrug Dabigatranetexilat zeigten in vitro keine Wirkung auf menschliche Cytochrom-P450-Enzyme; Studien bestätigten, dass auch in vivo kein Abbau über das Cytochrom-P450-System erfolgt.[6]
Studien
Die Wirksamkeit von Pradaxa wurde in zwei randomisierten, doppelblinden Parallelgruppenstudien mit insgesamt fast 5600 Patienten untersucht, die sich einer Knie- bzw. Hüftgelenkersatzoperation unterzogen. Die Patienten erhielten täglich 150 oder 220 mg Dabigatranetexilat peroral oder einmal täglich 40 mg Enoxaparin subkutan. Primärer Endpunkt war jeweils die Kombination aus der Gesamtzahl venöser Thromboembolien (VTE) und der Gesamtmortalität; ein sekundärer Endpunkt war die Kombination von schweren VTE und VTE-bezogener Mortalität.[2]
In beiden Studien zeigte Dabigatranetexilat die gleiche Wirksamkeit wie Enoxaparin mit Bezug auf die Verhinderung einer Blutgerinnselbildung bzw. auf die Verhinderung von Todesfällen:
- In der Studie mit Patienten nach Kniegelenkersatz erlitten knapp 38 % unter Enoxaparin ein Blutgerinnsel, im Vergleich zu 36 % unter 220 mg Dabigatranetexilat bzw. 40 % unter 150 mg Dabigatranetexilat. In jeder Gruppe gab es einen Todesfall.
- In der Studie mit Patienten nach Hüftgelenkersatz erlitten knapp 7 % unter Enoxaparin ein Blutgerinnsel, im Vergleich zu 6 % unter 220 mg Dabigatranetexilat bzw. 8,7 % unter 150 mg Dabigatranetexilat.
In beiden Studien zeigte die Dosis mit 220 mg tendenziell eine bessere Wirksamkeit als die Dosis mit 150 mg.
Hinsichtlich des Auftretens von starken Blutungen, erhöhten Leberenzymwerten sowie akuten koronaren Ereignissen gab es keine signifikanten Unterschiede zwischen Dabigatranetexilat und Enoxaparin.
In der Indikation Vorhofflimmern wurde Dabigatran in der 2009 abgeschlossenen RELY-Studie im Vergleich zu dem in den USA üblichen Warfarin untersucht.[16] Eine Vergleichsstudie zum in Europa vermehrt verwendeten Phenprocoumon existiert nicht.
Eine Studie für den Einsatz bei Herzklappenpatienten wurde abgebrochen und die European Medicines Agency (EMA) erklärt, wie zuvor schon die US-Arzneibehörde FDA, den Einsatz bei diesen Patienten für kontraindiziert.[17]
Sonstige Informationen
Chemisch-pharmazeutische Informationen
Pharmazeutisch verwendet wird das Mesilat (Methansulfonsäure-Salz) des Dabigatranetexilats. Die Löslichkeit des Salzes, einem gelblichen bis gelben Feststoff, in wässrigem Medium ist stark pH-Wert-abhängig und erhöht bei sauren pH-Werten, die Löslichkeit in Wasser beträgt 1,8 mg/ml. Dabigatranetexilatmesilat ist leicht löslich in Methanol, löslich in Ethanol, wenig löslich im Isopropanol, sehr wenig löslich in Aceton und praktisch unlöslich in Ethylacetat. Dabigatranetexilatmesilat hat keine chiralen Zentren und ist polymorph, es sind zwei Modifikationen bekannt. In der kommerziellen Synthese entsteht die Modifikation I in der wasserfreien Form.[2]
Entwicklung
Die Suche nach einem niedermolekularen, oral verabreichbaren Wirkstoff begann Boehringer Ingelheim 1992 auf der Basis der Struktur des peptidischen Thrombin-Inhibitors N-α-(2-Naphthylsulfonylglycyl)-4-amidinophenylalaninpiperidin (α-NAPAP). Ausgehend von einem dreifachsubstituiertes Benzimidazol als Grundgerüst,[18] wurde das Molekül schrittweise einer optimalen Konformation und Affinität für die Bindung an Thrombin angenähert. Das resultierende stark polare und daher schlecht resorbierbare Dabigatran wurde durch die Einführung von zwei Schutzgruppen (veresterte Carboxygruppe und O-n-Hexylcarbamatgruppe) so modifiziert, dass es ausreichend peroral bioverfügbar ist. „Etexilat“ ist ein Kunstwort aus den beiden Reaktanten Ethanol und Hexansäure. Ab 1996 wurde die antikoagulatorische Wirkung von Dabigatran in vitro und in Tiermodellen untersucht, die klinischen Studien begannen Ende der 1990er Jahre. Im März 2008 wurde Pradaxa durch die EU-Kommission für den europäischen Markt zugelassen, im August 2011 folgte die Zulassung von Indikationserweiterungen.[19][4]
Kritik
Im Zeitraum März 2008 bis November 2011 starben weltweit 260 Menschen in zeitlichem Zusammenhang mit der Einnahme des Medikamentes.[20] Vor allem Patienten mit Nierenversagen kamen ums Leben, da bei ihnen der Wirkstoff Dabigatranetexilat, der über die Niere aus dem Blut und dann über den Urin entsorgt wird, nicht aus dem Blut gefiltert werden konnte. Somit führte ein ansonsten als harmlos eingestufter Bluterguss zu inneren Blutungen bis hin zum Tod, da die Blutung nicht rechtzeitig gestillt werden konnte. Laut einer Studie der amerikanischen Gesundheitsbehörde FDA vom Mai 2014, in der 134.000 Patienten untersucht wurden, ist sowohl das Todesrisiko als auch das Risiko für Schlaganfälle und Hirnblutungen bei Pradaxa im Vergleich zu Cumarin (in diesem Fall das in den USA gebräuchliche Cumarin Warfarin – in Deutschland wird eher Marcumar verabreicht) jedoch geringer. Die Studie zeigte jedoch auch, dass Magen-Darm-Blutungen unter Dabigatran häufiger auftraten.[21] Mehr als 2000 Kläger in den USA machten den Pharmakonzern Boehringer Ingelheim für schwere und zum Teil tödliche Blutungen durch Pradaxa verantwortlich.[22] Statt der für September 2014 angesetzten Schadenersatz-Prozesse hat Boehringer jedoch vorab einen Vergleich über die Summe von 650 Millionen Dollar (etwa 470 Millionen Euro) geschlossen, um einem jahrelangen Rechtsstreit und den „Unwägbarkeiten des US-Rechtssystems“ aus dem Weg zu gehen.[23]
Arzneiverordnungs-Report
Im Arzneiverordnungsreport für das Jahr 2008 wurde Dabigatranetexilat mit der Bewertung B (= Verbesserung pharmakodynamischer oder pharmakokinetischer Eigenschaften) versehen. Von 29 im Jahr 2008 neu zugelassenen Arzneimitteln haben 7 die Bewertung A (= innovative Struktur mit therapeutischer Relevanz), 6 die Bewertung B (= Verbesserung pharmakodynamischer oder pharmakokinetischer Eigenschaften), 15 die Bewertung C (= Analogpräparat mit keinen oder nur geringen Unterschieden) und eines die Bewertung D (= nicht ausreichend gesichertes Wirkprinzip oder unklarer therapeutischer Stellenwert) erhalten.[24]
Weblinks
- Europäischer öffentlicher Beurteilungsbericht (EPAR) und Produktinformation, Übersicht auf der Website der Europäischen Arzneimittelagentur
- Wirkstoff AKTUELL zu Dabigatranetexilat (Memento vom 12. Juni 2011 im Internet Archive) im Arzneimittel-Infoservice der KBV
Einzelnachweise
- N. H. Hauel, H. Nar, H. Priepke, U. Ries, J. M. Stassen, W. Wienen: Structure-based design of novel potent nonpeptide thrombin inhibitors. In: J. Med. Chem. 45 (9), 2002, S. 1757–1766. PMID 11960487.
- Beurteilungsbericht (englisch; PDF; 281 kB) des Ausschusses für Humanarzneimittel (CHMP) der Europäischen Arzneimittelagentur zu Pradaxa, Stand März 2008.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Schlaganfall-Prävention: Pradaxa erhält EU-Zulassung. In: Pharmazeutische Zeitung. 5. August 2011.
- Neue Arzneimittel (PDF; 382 kB), Information der Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ), 18. November 2011.
- Produktinformation der Europäischen Arzneimittelagentur zu Pradaxa, Stand August 2011.
- Wiebke Gogarten, Hugo K. Van Aken: Perioperative Thromboseprophylaxe - Thrombozytenaggregationshemmer - Bedeutung für die Anästhesie. In: AINS - Anästhesiologie · Intensivmedizin · Notfallmedizin · Schmerztherapie. Nr. 4, April 2012, S. 242–254. doi:10.1055/s-002-23167.
- S. A. Kozek-Langenecker, D. Fries, M. Gütl, N. Hofmann, P. Innerhofer, W. Kneifl, L. Neuner, P. Perger, T. Pernerstorfer, G. Pfanner u. a.: Lokoregionalanästhesien unter gerinnungshemmender Medikation. Empfehlungen der Arbeitsgruppe Perioperative Gerinnung (AGPG) der Österreichischen Gesellschaft für Anästhesiologie und Intensivmedizin (ÖGARI). In: Der Anaesthesist. Vol. 54, Nr. 5, 2005, S. 476–484. doi:10.1007/s00101-005-0827-0.
- Rote-Hand-Brief zu Pradaxa vom 7. Januar 2013, abgerufen am 19. März 2016.
- Rote-Hand-Brief von Boehringer Ingelheim am 27. Oktober 2011. (PDF; 497 kB) Abgerufen am 28. Oktober 2011.
- Fachinformation Pradaxa 150 mg Hartkapseln, Stand August 2011.
- Informationsbrief zu Risikofaktoren für das Auftreten von Blutungen vom 5. September 2013. (PDF; 2,5 MB) Abgerufen am 9. September 2013.
- Blutgerinnung: Dabigatran-Antidot ist zugelassen. Abgerufen am 28. August 2017.
- Schlaganfallvorsorge: Erstes spezifisches Antidot zur Aufhebung der Wirkung von Pradaxa® (Dabigatran) in der EU zugelassen vom 26. November 2015. Archiviert vom Original am 8. Dezember 2015; abgerufen am 28. November 2015.
- Zusammenfassung der Merkmale des Arzneimittels, EMA, abgerufen am 23. Mai 2017.
- Dabigatran versus Warfarin in Patients with Atrial Fibrillation. NEJM, September 2009, doi:10.1056/NEJMoa0905561.
- Pradaxa: Explizite Kontraindikation bei künstlicher Herzklappe. In: Deutsches Ärzteblatt. 9. Januar 2013.
- N. H. Hauel, H. Nar, H. Priepke, U. Ries, J. M. Stassen, W. Wienen: Structure-based design of novel potent nonpeptide thrombin inhibitors.] In: J. Med. Chem. 45 (9), 2002, S. 1757–1766. PMID 11960487.
- Neue Indikationen in Sicht. In: Pharmazeutische Zeitung. Nr. 14, 2009.
- Pradaxa ist nicht gefährlicher als andere Blutverdünner. In: Zeit online. 14. November 2011.
- U.S. Department of Health and Human Services: FDA study of Medicare patients finds risks lower for stroke and death but higher for gastrointestinal bleeding with Pradaxa (dabigatran) compared to warfarin. 2014.
- Schlaganfallmittel Pradaxa: Klagewelle überschwemmt Boehringer. n-tv, 13. Februar 2014, abgerufen am 17. Juli 2014.
- Boehringer zahlt 650 Millionen Dollar. In: WirtschaftsWoche Online. 28. Mai 2014, abgerufen am 24. Oktober 2014.
- U. Schwabe, D. Paffrath: Arzneiverordnungs-Report 2009. Springer Medizin Verlag, Heidelberg 2009.