Periduralanästhesie
Die Periduralanästhesie (Abkürzung PDA; von altgriechisch περί perí „neben, rundherum“, lateinisch dura [mater] „harte [Hirnhaut]“ und Anästhesie), synonym Epiduralanästhesie (EDA; altgriechisch ἐπί epí „über, auf“), im Deutschen veraltet auch Extraduralanästhesie (lateinisch extra „außerhalb“), ist eine Form der (rückenmarksnahen) Regionalanästhesie (vergleiche auch Spinalanästhesie). Sie bewirkt die zeitweilige, umkehrbare Funktionshemmung ausgewählter Nervensegmente, führt dabei zu Sympathikolyse, Empfindungslosigkeit, Schmerzfreiheit und Hemmung der aktiven Beweglichkeit im zugehörigen Körperabschnitt und ermöglicht neben schmerzarmen Entbindungen (hier oft auch neuroaxiale Analgesie, seltener auch neuroaxiale Blockade genannt) auch die Durchführung ansonsten schmerzhafter medizinischer Prozeduren oder eine Schmerzbehandlung bei bestimmten Ursachen.
Geschichte
Der Franzose Fernand Cathelin berichtete 1901 über die Injektion des Lokalanästhetikums Kokain über den Hiatus sacralis in den Periduralraum, was als Sakralanästhesie nach der Entdeckung des Procains ein Routineverfahren in der Chirurgie wurde.[1] Im Jahr 1921 beschrieb Fidel Pagés die Anestesia metamérica, sowohl in der Revista Española de Cirugía als auch der Revista de Sanidad Militar, die Periduralanästhesie. Dabei griff er auf die Erfahrungen von 43 durchgeführten Operationen zurück. 1922 wurde er zum Comandante Médico befördert.
Etwa Mitte der 1920er Jahre war es der vielseitige italienische (Herz-)Chirurg Achille Mario Dogliotti (1897–1966)[2] der sich für diese Technik einsetzte. Dogliotti publizierte 1931 seine anatomischen Untersuchungen und eine brauchbare Punktionstechnik als Grundstein zu einer „segmentären Periduralanästhesie“.[3] Im Jahr 1941 entwickelten Robert Andrew Hingson (1913–1996) und Waldo B. Edwards die Technik der kontinuierlichen Kaudalanästhesie mit einer liegenden Kanüle. Im Jahr 1947 war es Manuel Martínez Curbelo (1906–1962)[4] der erstmals die lumbale Platzierung eines Epiduralkatheters beschrieb. In Deutschland werden Karl Julius Anselmino und Mitarbeiter als erste genannt, die die Methode ausführten.[5]
Meist wird eine seit 1942 etablierte[6] und seit etwa 1949 auch für den lumbalen Zugang bewährte[7] Kathetertechnik angewendet. Hierbei wird nach Auffinden des Periduralraums über die Tuohy-Kanüle ein dünner Kunststoffkatheter eingeführt, der einige Tage (und gelegentlich viel länger) im Periduralraum belassen werden kann. Dies ermöglicht einen Therapiezeitraum über den eigentlichen operativen Eingriff hinaus oder auch eine längerfristige Therapie chronischer Schmerzen. Üblicherweise wird an den Katheter eine Pumpe angeschlossen, über die kontinuierlich eine Grundmenge (Basalrate) eines Lokalanästhetikums, oft auch mit Zusatz eines Opioids, zugeführt wird. Diese Pumpen ermöglichen es auch, dass die Patienten sich bei Bedarf per Knopfdruck zusätzliche Dosen geben können (patient controlled epidural analgesia, PCEA) und so unabhängig von Ärzten oder Pflegepersonal selbstständig Schmerzfreiheit herbeiführen können. Eine Überdosierung wird durch die Pumpensoftware weitgehend verhindert, jedoch sind eine tägliche Kontrolle der zugeführten Menge an Schmerzmitteln, sowie des Katheters selbst und seiner Wirkung unabdingbar. Durch diese Maßnahmen ist es möglich, Patienten nach Operationen frühzeitig schmerzfrei wieder zu mobilisieren[8] und durch Bewegungsmangel entstehende Komplikationen (Lungenentzündungen, Thrombosen, Verkürzung von Muskeln, Gelenkversteifungen) zu verhindern.
Im Jahr 2020 wurden in Deutschland, bei steigender Tendenz, etwa 20 % der Geburten mit einer PDA unterstützt, in Frankreich waren es etwa 50 %[9]
Anatomische Grundlagen
Im Bereich des Rückenmarks liegen die Nervenzellen und -fasern geschützt von mehreren Schichten an Bindegewebe, den Rückenmarkshäuten. Von innen nach außen sind dies: die Pia mater, eine dünne Schicht aus Stützzellen, die direkt dem Rückenmark aufliegt und auch in dieses ausstrahlt, die Arachnoidea und als äußere Begrenzung die Dura mater, die harte Rückenmarkshaut. Die Dura mater teilt sich in ein inneres und äußeres Blatt; das äußere Blatt ist gleichzeitig die Knochenhaut der Wirbelkörper des Wirbelkanals. Zwischen innerem und äußerem Blatt der Dura mater liegt der sogenannte Periduralraum, in den bei der Periduralanästhesie das Lokalanästhetikum injiziert wird.
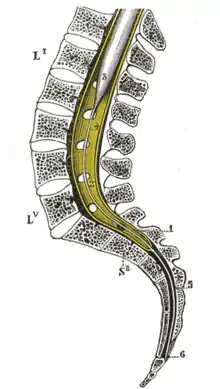
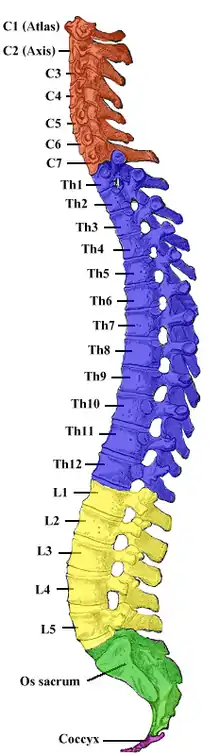
Während des Wachstums des Menschen wächst die Wirbelsäule schneller als das Rückenmark, so dass das Rückenmark auf Höhe des ersten Lendenwirbels endet, die zugehörigen Nervenfasern aber weiter kaudal aus dem Rückenmarkskanal austreten (siehe Abbildung). Dieses ist bei der Wahl des Punktionsortes zu berücksichtigen, da dieser nicht unbedingt auf der gleichen Höhe wie der Ort der Operation liegt. Bei anderen Säugetieren reicht das Rückenmark etwa bis zum Übergang zwischen letztem Lendenwirbel und dem Kreuzbein. Hier werden Periduralanästhesien meist zwischen Kreuzbein und erstem Schwanzwirbel vorgenommen.
Durchführung
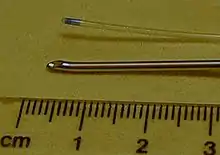
Die Periduralanästhesie (PDA) wird im Sitzen oder in Seitenlage angelegt. Der Patient wird gebeten, seine Schultern zu entspannen und seinen Rücken zu krümmen. Die Wahl der Höhe des Punktionsortes an der Wirbelsäule des Patienten ist in erster Linie abhängig vom Ort der Operation. Nach Desinfektion und Lokalanästhesie der Haut wird zwischen zwei Dornfortsätzen der Wirbelsäule eine Periduralnadel (Tuohy-Nadel (s. Foto) oder die von Günter Sprotte mit der Firma Pajunk entwickelte und 1979 eingeführte Sprotte-Kanüle[10]) in den Rücken des Patienten eingeführt. Die Nadel durchtritt beim Einstechen die folgenden Strukturen: Haut – Zwischenwirbelbänder – Ligamentum flavum. Um den Periduralraum beim Vorschieben dieser Nadel zu identifizieren wird die so genannte „loss-of-resistance“-Technik angewendet. Dabei wird eine Spritze mit Flüssigkeit auf die Nadel aufgesteckt. Liegt die Nadel noch vor dem Periduralraum in Bändern der Wirbelsäule ist das Einspritzen von Flüssigkeit nicht möglich (resistance). Unter ständiger Kontrolle dieses Einspritzwiderstandes wird die Nadel vorsichtig weiter vorgeschoben (meistens ca. 4–5 cm tief), bis plötzlich widerstandsfrei Flüssigkeit eingespritzt werden kann (loss of resistance). Dies kennzeichnet das Austreten der Nadelspitze aus der Bänderstruktur in den Periduralraum. Ein durch die Nadel in den Periduralraum eingespritztes Lokalanästhetikum (beispielsweise Bupivacain) wirkt nun im Wirbelkanal von außerhalb der Dura mater auf die Nervenstrukturen. Die Tuohy-Nadel wird nach der Injektion wieder entfernt.
Unterschied zur Spinalanästhesie
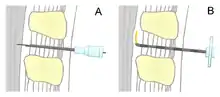
Bei der Spinalanästhesie wird eine wesentlich feinere Nadel tiefer vorgestochen, so dass die harte Hirnhaut (Dura mater) im Gegensatz zur Periduralanästhesie durchdrungen wird. Eingespritztes Lokalanästhetikum breitet sich nun frei im Liquor cerebrospinalis aus und Rückenmark und Nervenfasern im Spinalkanal werden innerhalb weniger Minuten betäubt. Für die Ausschaltung der Empfindung werden im Vergleich zur Periduralanästhesie wesentlich geringere Mengen des Lokalanästhetikums benötigt, da das Ausbreitungsvolumen kleiner und die Diffusionsstrecke geringer ist. Dies erklärt auch den schnelleren Wirkungseintritt der Spinalanästhesie.
Anwendungsgebiete
Die Periduralanästhesie (PDA) kann, je nach verwendeter Konzentration des Lokalanästhetikums, zur Schmerzlinderung und zur kompletten Schmerzausschaltung angewendet werden. Bei größeren bauchchirurgischen, orthopädischen, gynäkologischen oder urologischen Eingriffen wird ein Periduralkatheter präoperativ meist deswegen angelegt, um ihn postoperativ zur Schmerztherapie zu nutzen. Dadurch kann der Bedarf an anderen Schmerzmitteln (z. B. Opioiden) gesenkt werden und die Häufigkeit von Darmmotilitätstörungen gesenkt werden.
Ein weiteres bedeutendes Anwendungsfeld der PDA ist ihr Einsatz in der Geburtshilfe. Mit niedrigen Lokalanästhetika-Konzentrationen kann der Geburtsschmerz der Spontanentbindung erheblich gesenkt werden. Im Falle von Geburtskomplikationen und bereits liegendem Periduralkatheter kann mit einer höheren Konzentration des LA unter kompletter Schmerzausschaltung ein Kaiserschnitt durchgeführt werden. Bei dringlichen Operationen wird wegen der einfacheren Technik und des schnelleren Wirkungseintritts allerdings eine Spinalanästhesie bevorzugt.
Längerfristige Periduralanästhesie (bis zu einigen Monaten) kann bei palliativer Behandlung schwerer chronischer Schmerzen angewendet werden, zum Beispiel auch per patientenkontrollierter Periduralanästhesie. Bei geplant längerer Verweildauer wird der Periduralkatheter oftmals vom Austrittspunkt am Rücken einige Zentimeter unter der Haut „getunnelt“ um eine Infektion des Periduralraumes bei längerem Therapiezeitraum zu vermeiden.
Aufgrund der anatomisch bedingten segmentalen Gliederung und der daraus resultierenden nervalen Versorgung lassen sich die wahrscheinlichen Hauptschmerzzonen einigermaßen sicher vorhersehen. In Abhängigkeit dazu wird der Periduralkatheter in entsprechender Höhe an der Wirbelsäule platziert. Als Orientierung für die Punktionshöhe gilt, dass die Spitze des Periduralkatheters etwa in der Mitte der zu blockierenden Segmente liegen sollte. Zur Orientierung kann folgende Tabelle dienen; Oberbaucheingriffe sind Operationen etwa am Magen, an der Bauchspeicheldrüse oder am Colon transversum oder Querdarm, Unterbaucheingriffe etwa urologische oder gynäkologische Eingriffe,[11] Bruchoperationen, untere Extremität etwa Kniegelenksoperationen.

| Operationsort | Punktionshöhe | Avisierte Ausbreitung der Analgesie |
|---|---|---|
| Thorakotomie | Thorakal Th 6–7 | Thorakal Th 2 – 8 |
| thorako-abdominale Operation (Zweihöhleneingriff) | Th 7–8 und Th 8–9 | Th 4–12 |
| Oberbaucheingriffe | Th 8–9 und Th 9–10 | Th 6–12 |
| Unterbaucheingriff | Th 10–11 und Th 11–12 | Th 8 – Lumbal 2 |
| Operation an der Bauchaorta | Th 10–11 und Th 11–12 | Th 8–L2 |
| Operationen an der unteren Extremität | Lumbal 3–4 | Th 12 – sakral 1 |
Nebenwirkungen und Komplikationen
- Das technische Nichtgelingen oder die suboptimale Wirksamkeit einer Periduralanästhesie sind gelegentlich Ursache von Schmerzen.
- Blutdruckabfall. Durch die Blockierung der Nerven, die die Gefäße engstellen (Vasokonstriktion), kommt es zu einer Weitstellung der Gefäße (Vasodilatation). Die Areale, die unter Einfluss der Periduralanästhesie stehen, fühlen sich durch den vermehrten Blutfluss warm an. Durch die Vasodilatation kommt es gelegentlich zu einem Blutdruckabfall, der allerdings durch Flüssigkeitszufuhr (Infusion) in der Regel vermeidbar ist. Insbesondere bei der thorakalen Periduralanästhesie besteht durch den Wegfall lebenswichtiger Kompensationsmechanismen bei KHK-Patienten die Gefahr bedrohlicher Komplikationen.[14]
- Verletzung der Dura mater mit Tuohy-Nadel (0,6–1,3 %). Dies geschieht, wenn die dicke Tuohy-Nadel zu weit vorgeschoben wird und die Dura mater durchsticht. Durch das verursachte Loch kann nun Zerebrospinal-Flüssigkeit entweichen. Dies führt in 16–86 % zu einem intensiven postpunktionellen Kopfschmerz. Vor allem jüngere Patienten sind hier gegebenenfalls betroffen. Ein solches Risiko kann durch Verwendung atraumatischer pencil-point-Nadeln deutlich reduziert werden.
- Versehentliche totale Spinalanästhesie. Wird die soeben beschriebene Durapunktion vom Anästhesisten nicht bemerkt und die gesamte für den Periduralraum vorgesehene Menge an Lokalanästhetikum nun in den Spinalraum eingespritzt, kann dies zu starken Blutdruckabfällen, Atemlähmung und Verlangsamung des Herzschlages bis zum Herzstillstand führen. Jeder Anästhesist sollte jedoch in der Lage sein, dieser Situation Herr zu werden, ohne dass der Patient bleibenden Schaden nimmt (Beatmung, Vasopressoren, Atropin etc.)
- Verletzung des Rückenmarks. Eine zwar äußerst selten auftretende Komplikation, die aber das Risiko einer bleibenden Querschnittslähmung in sich trägt.
- Periduraler Bluterguss durch Verletzung einer Vene im Periduralraum. Kleinere Blutungen kommen recht häufig vor, stillen sich jedoch selbst und verursachen keine klinischen Symptome. Blutet es jedoch ungehemmt in den Periduralraum ein, kann der Druck des entstehenden Ergusses das Rückenmark dauerhaft schädigen. Ein solcher Bluterguss mit neurologischen Symptomen kommt bei etwa 1:150.000 Periduralanästhesien vor; bei Gerinnungsstörungen besteht ein erhöhtes Risiko (1:3000). Nur eine neurochirurgische Notoperation und Dekompression kann nun dauerhafte Schäden verhindern.
- auch systemische Nebenwirkungen des verwendeten Lokalanästhetikums sind möglich, zum Beispiel neuro- und kardiotoxische Symptome;[15][16] Allergie
- Meningitis (0,02 %)
Voraussetzungen für die Anlage einer Periduralanästhesie
- Einverständnis des Patienten
- intakte Wirbelsäule; nach Operationen an der Lendenwirbelsäule zum Beispiel ist eine Periduralanästhesie manchmal schwierig.
- keine neurologische oder psychiatrische Störung (ansprechbarer Patient); eine Periduralanästhesie für einen Patienten mit Multipler Sklerose zum Beispiel ist kein Problem. Jedoch muss dem Patienten klar sein, dass sich im Rahmen der geplanten Operation vorbestehende neurologische Beschwerden verschlimmern (aber auch verbessern) können, da dies in der Natur dieser Erkrankung liegt. Dies liegt daher nicht per se an der Periduralanästhesie.
- intakte Blutgerinnung
- Quickwert > 50 %
- PTT bis 50
- Thrombozyten > 80 000/μl *
- entsprechender zeitlicher Abstand zu Antikoagulantientherapie,[17] siehe ausführliche Tabelle im nächsten Abschnitt.
- keine Infektion im Injektionsgebiet
- keine Sepsis
- keine schwere Herz-Kreislauf-Erkrankung (z. B. Koronare Herzkrankheit gilt für die Anlage der Periduralanästhesie im Bereich der Lendenwirbelsäule)
- keine Hypovolämie, kein Vorliegen eines Schocks
(*) Ein Mangel an Blutplättchen (Thrombozytopenie) erhöht das Risiko für eine Blutungskomplikation. Eine absolute Untergrenze, bis zu der eine Spinalanästhesie durchgeführt werden kann, ist seitens der Fachgesellschaften nicht festgelegt. Vielmehr muss die Gesamtsituation der Blutgerinnung berücksichtigt werden.[18] Die Transfusion von Thrombozytenkonzentraten zur Erhöhung der Thrombozytenzahl im Blut vor einer Spinalanästhesie, wird ab einem Wert von kleiner 50.000/μl empfohlen, so dass dies als Orientierung für die Untergrenze herangezogen werden kann. Bei der Periduralanästhesie, bei der meist dickere Nadeln verwendet werden, wird schon bei weniger als 80.000/μl eine Transfusion empfohlen.[19]
Kontraindikationen für die Periduralanästhesie
- Ablehnung durch Patienten
- Gerinnungsstörung
- Sepsis
- Lokale Infektion im Injektionsgebiet
- Neurologische Erkrankung (relative Kontraindikation, forensische Gründe)
- Knochenmetastasen
- Hypovolämie
- Herzinsuffizienz
- Allergie auf Materialien oder Anästhetikum
Medikamentöse gerinnungshemmende Therapie
Eine blutgerinnungshemmende Therapie erfordert je nach Arzneistoff einen gewissen zeitlichen Abstand zu rückenmarksnahen Regionalanästhesie-Verfahren wie der Periduralanästhesie. Die folgende Tabelle gibt einen Überblick über die einzuhaltenden Intervalle zwischen der Gabe eines Gerinnungshemmers vor oder nach der Punktion bzw. Katheterentfernung.
| Arzneistoff(e) | Vor Punktion bzw. Katheterentfernung | Nach Punktion bzw. Katheterentfernung |
|---|---|---|
| Unfraktioniertes Heparin (UFH) | 4 – 6 h | 1 h |
| Niedermolekulare Heparine, NMH-Prophylaxe | 12 h | 4 h |
| Niedermolekulare Heparine, NMH-Therapie | 24 h | 4 h |
| Fondaparinux | 36 – 42 h | 6 – 12 h |
| Vitamin-K-Antagonisten | INR < 1,4 | nach Katheterentfernung |
| Clopidogrel | 7 Tage | nach Katheterentfernung |
| Prasugrel | 7 – 10 Tage | 6 h |
| Ticlopidin | 10 Tage | nach Katheterentfernung |
| Abciximab | 48 h | 4 h |
| Tirofiban | 8 h | 4 h |
| Prostacyclin (PGI2) | 0,5 h | sofort |
| Dabigatranetexilat | > 34 h | 4 – 6 h |
| Rivaroxaban | 22 – 26 h | 4 – 6 h |
| Apixaban | 26 – 30 h | 4 – 6 h |
| Ticagrelor | 5 Tage | 6 h |
| Cilostazol | 42 h | 5 h |
| Dipyridamol plus ASS | 48 h | sofort |
Siehe auch
Literatur
- Roulhac D. Toledano, Lawrence C. Tsen: Epidural Catheter Design History, Innovations, and Clinical Implications. In: Anesthesiology, V. 121, No 1, July 2014
- J. Antonio Aldrete: Manuel Martinez Curbelo And Continuous Lumbar Epidural Anesthesia. (PDF) In: Bulletin Of Anesthesia History, Volume 22, Number 4, October 2004
- Arkadiusz Praski: Der unterschiedliche Geburtsverlauf bei Patientinnen mit PDA und ohne PDA, Saarländische Universitäts- und Landesbibliothek, Saarland 2016 DNB 1121581226 (Online-Dissertation Universität des Saarlandes Saarbrücken 2016, 100 Seiten, Akademischer Betreuer: Erich-Franz Solomayer Volltext online PDF, kostenfrei, 100 Seiten, 1,2 MB).
Weblinks
- Periduralanästhesie – Informationen bei Gesundheitsinformation.de (Online-Angebot des Instituts für Qualität und Wirtschaftlichkeit im Gesundheitswesen)
- Periduralanästhesie bei familienplanung.de – Informationsportal der Bundeszentrale für gesundheitliche Aufklärung (BZgA)
Einzelnachweise
- H. Orth, I. Kis: Schmerzbekämpfung und Narkose. In: Franz Xaver Sailer, Friedrich Wilhelm Gierhake (Hrsg.): Chirurgie historisch gesehen. Anfang – Entwicklung – Differenzierung. Dustri-Verlag, Deisenhofen bei München 1973, ISBN 3-87185-021-7, S. 1–32, hier: S. 20.
- Achille Mario Dogliotti: Eine neue Methode der regional Anaesthesie „Die peridurale segmentare Anaesthesie“. In: Zentralfl F Chir 1931, 58, S. 3141–3145
- H. Orth, I. Kis: Schmerzbekämpfung und Narkose. In: Franz Xaver Sailer, Friedrich Wilhelm Gierhake (Hrsg.): Chirurgie historisch gesehen. Anfang – Entwicklung – Differenzierung. Dustri-Verlag, Deisenhofen bei München 1973, ISBN 3-87185-021-7, S. 1–32, hier: S. 20.
- J. Antonio Aldrete: Manuel Martinez Curbelo And Continuous Lumbar Epidural Anesthesia. (PDF) In: Bulletin Of Anesthesia History, Volume 22, Number 4 October, 2004, S. 3–8.
- Siegfried Potthoff, Lutwin Beck: Zur Geschichte der medikamentösen und psychosomatischen Geburtserleichterung. In: Lutwin Beck (Hrsg.): Zur Geschichte der Gynäkologie und Geburtshilfe. Aus Anlaß des 100-jährigen Bestehens der Deutschen Gesellschaft für Gynäkologie und Geburtshilfe. Berlin / Heidelberg / New York 1986, S. 133–141, bes. S. 137. Der entsprechende Aufsatztitel lautet: Karl Julius Anselmino, Gerhard Plaskuda, Rudolf Stewens: Über ein neues Verfahren der protrahierten Leitungsanästhesie des Wehenschmerzes, die segmentäre, peridurale Plombe. In: Klinische Wochenschrift, Band 27, 1949, Heft 5–6, S. 104 ff.
- R.A. Hingson, J.L. Southworth: Continuous caudal anesthesia. In: The American Journal of Surgery. 58 (1942), S. 93ff.
- A. Doughty: Epidural analgesia in labour: the past. the present and future. In: Proceedings R. Soc. Med. 71 (1978), S. 879ff.
- Vgl. etwa W. Seeling, T. Mayer, O. Wörsdorfer: Postoperative Frühmobilisation des Kniegelenkes nach Arthrolyse mit kontinuierlicher Katheterperiduralanaesthesie. In: Regionalanaesthesie. Band 6, 1985, S. 1 ff.
- Schmerzmanagement Bericht der Techniker Krankenkasse vom 18. November 2020, abgerufen am 13. Februar 2022
- 40 Jahre Sprotte®. Eine Erfolgsgeschichte seit vier Jahrzehnten. In: Anästhesiologie & Intensivmedizin. Band 61, Januar 2020, Heftrücken.
- Abbildung der Innervation und regionalanästhesiologischen Möglichkeiten bei einer Gebärenden (Seite nicht mehr abrufbar, Suche in Webarchiven) Info: Der Link wurde automatisch als defekt markiert. Bitte prüfe den Link gemäß Anleitung und entferne dann diesen Hinweis.
- Hans Walter Striebel: Operative Intensivmedizin: Sicherheit in der klinischen Praxis. Schattauer Verlag, 2007, ISBN 978-3-7945-2480-8, S. 22–23.
- Reinhard Larsen: Anästhesie. Elsevier, Urban & Fischer Verlag, München 2011, ISBN 978-3-437-22502-4, S. 591.
- Emery Andrew Rovenstine, E. M. Papper, S. E. Bradley: Circulatory adjustment during spinal anesthesia in normal man with special reference to the autonomy of arteriolar tone. Anesthesiology 3 (1942), S. 442ff.
- W. Zink, B. M. Graf: Toxikologie der Lokalanästhetika Pathomechanismen–Klinik–Therapie. (PDF; 474 kB) Klinik für Anaesthesiologie, Universitätsklinikum Heidelberg. In: Anaesthesist. (2003) 52, S. 1102–1123, doi:10.1007/s00101-003-0617-5, Online publiziert: 18. November 2003.
- Szałata Marek: Lipidgabe bei toxischer Wirkung von Lokalanästhetika. (PDF; 754 kB) In: Lipid Rescue TM.
- Rückenmarksnahe Regionalanästhesien und Thromboembolieprophylaxe /antithrombotische Medikation. (PDF) 2. überarbeitete Empfehlung der Deutschen Gesellschaft für Anästhesiologie und Intensivmedizin.
- Durchführung von Analgesie- und Anästhesieverfahren in der Geburtshilfe 2. überarbeitete Empfehlungen der Deutschen Gesellschaft für Anästhesiologie und Intensivmedizin und des Berufsverbandes Deutscher Anästhesisten in Zusammenarbeit mit der Deutschen Gesellschaft für Gynäkologie und Geburtshilfe Anästh. Intensivmed. 50 (2009) S490–S495
- Querschnitts-Leitlinien (BÄK) zur Therapie mit Blutkomponenten und Plasmaderivaten. 4. überarbeitete und aktualisierte Auflage 2014. In: Deutsches Ärzteblatt, Jg. 112, Heft 6, 6. Februar 2015.
- Wiebke Gogarten, Hugo K. Van Aken: Perioperative Thromboseprophylaxe – Thrombozytenaggregationshemmer – Bedeutung für die Anästhesie. In: AINS – Anästhesiologie • Intensivmedizin • Notfallmedizin • Schmerztherapie. Ausgabe 04, April 2012, S. 242–254, doi:10.1055/s-002-23167.
- S. A. Kozek-Langenecker, D. Fries, M. Gütl, N. Hofmann, P. Innerhofer, W. Kneifl, L. Neuner, P. Perger,T. Pernerstorfer, G. Pfanner u. a.: Lokoregionalanästhesien unter gerinnungshemmender Medikation. Empfehlungen der Arbeitsgruppe Perioperative Gerinnung (AGPG) der Österreichischen Gesellschaft für Anästhesiologie und Intensivmedizin (ÖGARI). In: Der Anaesthesist. Volume 54, Number 5 (2005), S. 476–484, doi:10.1007/s00101-005-0827-0.