Midazolam
Midazolam ist ein Arzneistoff aus der Gruppe der kurzwirksamen Benzodiazepine. Midazolam wirkt schlaffördernd, beruhigend, angstlösend (anxiolytisch) und entspannend (relaxierend) auf die Skelettmuskulatur. Es gibt Darreichungsformen zur bukkalen, oralen, rektalen und parenteralen Verabreichung.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
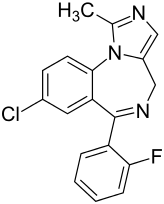 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Midazolam | |||||||||||||||||||||
| Andere Namen |
8-Chlor-6-(2-fluorphenyl)-1-methyl-4H-imidazo[1,5-a][1,4]benzodiazepin | |||||||||||||||||||||
| Summenformel | C18H13ClFN3 | |||||||||||||||||||||
| Kurzbeschreibung |
weißes bis gelbliches, kristallines Pulver[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
N05CD08 | |||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | ||||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit |
löslich in Wasser (Midazolam·Hydrochlorid)[4] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Der Name Midazolam leitet sich von Imidazol ab.
Klinische Angaben
Anwendungsgebiete
Midazolam wird in der Anästhesiologie und im Rettungsdienst eingesetzt. Eine weitere Indikation besteht bei Patienten, die unter Epilepsie leiden, bei Kindern mit Epilepsieformen wie z. B. Westsyndrom und Lennox-Gastaut-Syndrom.
Anästhesiologie und Intensivmedizin
Als Sedativum wird Midazolam in der Anästhesie zur Prämedikation vor Operationen eingesetzt. Midazolam kann auch zur Einleitung und Aufrechterhaltung einer Narkose sowie zur Basissedation bei Regionalanästhesien und diagnostischen Eingriffen verwendet werden. Im Rahmen einer Analgosedierung mit (S)-Ketamin (Esketamin) wird Midazolam gleichzeitig appliziert, um eine anterograde Amnesie (reduzierte Merkfähigkeit für kommende Bewusstseinsinhalte) zu induzieren. Die Leitlinien der Fachgesellschaften der Anästhesisten beschreiben dies als notwendig, da die assoziierten Pseudohalluzinationen durch Esketamin für Patienten eine extreme Belastung darstellen und in der Folge rezidivierende Störungen hervorgehen können, meist posttraumatische Belastungsstörung (PTSD) oder Angsterkrankungen.
Eine weitere Anwendung in der Intensivmedizin ist die Verabreichung einer Dauerinfusion über einen Perfusor (Spritzenpumpe) für eine mehrtägige Sedierung.
Midazolam hat ähnlich wie die (Notfall-)Kurzhypnotika Propofol und Etomidat keine analgetische (schmerzstillende) Wirkung. Die zusätzliche Gabe eines Analgetikums ist daher bei Schmerzzuständen unerlässlich. Eine alleinige Sedierung mit Midazolam ist möglich, stellt jedoch eine eher seltene Indikation dar.
Antikonvulsive Therapie bei Epilepsie
Midazolam kann zur notfallmäßigen Behandlung des Status epilepticus mittels intravenöser oder intramuskulärer Injektion eingesetzt werden. Unter dem Handelsnamen Buccolam wird Midazolam in der Mundhöhle (buccal) angewendet zur Beendigung eines länger anhaltenden Krampfanfalls bei Säuglingen, Kleinkindern, Kindern und Jugendlichen (zwischen 3 Monaten und unter 18 Jahren). Bei Säuglingen im Alter von 3 Monaten bis unter 6 Monaten sollte es nur in einer Klinik angewendet werden, in der Überwachungsmöglichkeiten und eine entsprechende Wiederbelebungsausrüstung vorhanden sind. Dieses Arzneimittel darf von Eltern/Betreuungspersonen nur dann verabreicht werden, wenn bei dem Kind Epilepsie diagnostiziert wurde.[7]
Die nasale Verabreichung im Off-Label-Gebrauch bei jüngeren Patienten ist beschrieben.[8]
Anwendung während Schwangerschaft und Stillzeit
Es gibt klare Hinweise für Risiken des menschlichen Fötus in Verbindung mit Benzodiazepin-Verabreichung während der Schwangerschaft. Besondere Vorsicht ist geboten, wenn gegen Ende der Schwangerschaft und unter der Geburt Benzodiazepine verwendet werden, da es beim Fötus zu unregelmäßiger Herzfrequenz und Hypotonie und beim Neugeborenen unter Umständen zu mangelhaftem Saugen, Atemdepression, verminderter Aktivität, herabgesetztem Muskeltonus (Floppy-infant-Syndrom) sowie Entzugssymptomen und Hypothermie kommen kann. Im Tierversuch gab es zudem Hinweise auf Verhaltensstörungen der Nachkommen von Muttertieren, denen während der Schwangerschaft Benzodiazepine verabreicht wurden. Midazolam sollte deshalb in der Schwangerschaft nicht angewendet werden, es sei denn, es ist klar notwendig. Da Midazolam in geringen Mengen (zu ca. 0,6 %) in die Muttermilch übertreten kann, sollte es bei stillenden Müttern nicht angewendet werden.[9] Nach Gabe einer einmaligen Dosis muss unter Umständen nicht abgestillt werden.[10]
Suchtpotential
Es kann schon nach kurzer Anwendung zu einer psychischen Abhängigkeit kommen.
Einsatz bei Hinrichtungen
Als Ersatzmittel für das zuvor in den Vereinigten Staaten verwendete Pentobarbital wurde Midazolam erstmals am 16. Januar 2014 bei der Hinrichtung von Dennis McGuire injiziert.[11] Obwohl es in der Folge bei mehreren Hinrichtungen 40 Minuten bis zwei Stunden bis zum Todeseintritt dauerte, wies der Oberste Gerichtshof der Vereinigten Staaten am 29. Juni 2015 eine Klage von Todeskandidaten im Bundesstaat Oklahoma ab und erlaubt weiterhin den Einsatz des Mittels bei Hinrichtungen.[12] 2017 ging die Haltbarkeit der US-amerikanischen Midazolambestände ihrem Ende zu. Deshalb wurden erstmals nach 2005 verstärkt Hinrichtungen angesetzt. Pharmahersteller der verwendeten Substanzen versuchten, die Hinrichtungen gerichtlich zu stoppen,[13] und europäische Staaten protestierten gegen das Vorgehen.[14]
Pharmakologische und toxikologische Eigenschaften
Wirkungsmechanismus
Die pharmakologische Wirkung entsteht durch allosterische Modulation spezieller Rezeptoren von Nervenzellen, den α3-GABAA-Rezeptoren, wodurch wie bei allen Benzodiazepinen im zentralen Nervensystem (ZNS) die Wirkung des körpereigenen Überträgerstoffs γ-Aminobuttersäure (GABA) verstärkt wird. GABA wirkt im ZNS meist hemmend auf die Nervenzellen. Midazolam besitzt auch eine moderate antikonvulsive Wirkung.
Aufnahme, Verteilung und Elimination
Midazolam wird rasch resorbiert, maximale Plasmakonzentration werden nach bukkaler, intramuskulärer und rektaler Verabreichung innerhalb von 30 Minuten, nach oraler Gabe nach ungefähr 1 Stunde erreicht. Bei Erwachsenen beträgt die Bioverfügbarkeit nach intramuskulärer Verabreichung über 90 %, nach Anwendung in der Mundhöhle ca. 75 %, nach rektaler Gabe ca. 50 % und nach oraler Gabe – bedingt durch einen hohen First-Pass-Effekt – ca. 30–70 %.[15][9][10]
Midazolam ist sehr lipophil und verteilt sich stark im Fettgewebe. Nach i. v. Injektion zeigen die Plasmakonzentrations-Zeitkurven ein bis zwei deutliche Verteilungsphasen. Das Verteilungsvolumen im Gleichgewichtszustand („Steady-State“) beträgt nach i. v.-Gabe um die 0,7–1,2 l/kg, nach Anwendung in der Mundhöhle schätzungsweise 5,3 l/kg. Durch eine Kumulation kann eine deutliche Verlängerung der Wirkdauer resultieren.[16] Im Plasma liegt Midazolam zu 96–98 % an Plasmaproteine gebunden vor.[15][9][10]
Die Elimination von Midazolam erfolgt größtenteils über Biotransformation, nur weniger als 1 % werden unverändert im Urin gefunden. In den Leberzellen erfolgt zunächst Hydroxylierung mittels des Cytochrom P450-Systems. Hauptmetabolit ist das 1-Hydroxymidazolam, das ebenfalls pharmakologisch (jedoch in geringerem Maß als Midazolam) aktiv ist und zur Wirkung beiträgt. Die Hydroxylierung als erster Schritt der Inaktivierung kann dabei durch andere Medikamente, wie auch durch seltene Erkrankungen wie z. B. das Crigler-Najjar-Syndrom behindert werden. Es folgt Konjugation mit einer Glucuronsäure. Die glucuronierten Metabolite werden über die Galle ausgeschieden. Die Eliminationshalbwertszeit für Midazolam beim gesunden Probanden wird mit 1,5 bis 2,5 Stunden angegeben, für 1-Hydroxymidazolam beträgt sie weniger als 1 Stunde. Nach bukkaler Verabreichung wurde bei Kindern und Jugendlichen eine initiale Halbwertszeit von durchschnittlich 27 Minuten und terminale Halbwertszeit von durchschnittlich 204 Minuten ermittelt.[9][10][15]
In bestimmten Patientengruppen ist die Pharmakokinetik verändert. Die Eliminationshalbwertszeit kann bei Patienten über 60 Jahre bis auf das Vierfache verlängert sein. Bei Kindern ist die Bioverfügbarkeit nach rektaler Resorption niedriger als bei Erwachsenen, die Eliminationshalbwertszeit nach i. v. und rektaler Applikation ist mit 1–1,5 Stunden kürzer im Vergleich zu Erwachsenen. Die Eliminationshalbwertszeit bei Neugeborenen beträgt durchschnittlich 6–12 Stunden. Bei übergewichtigen Patienten ist die mittlere Halbwertszeit im Vergleich zu nicht übergewichtigen Personen größer, bedingt durch eine Zunahme des um das Körpergesamtgewicht korrigierten Verteilungsvolumens. Die Clearance ist bei Über- und Normalgewichtigen vergleichbar.[15][9][10]
Toxikologie
Die Wirkung von Midazolam lässt sich schnell durch die Gabe des Gegenmittels Flumazenil aufheben. Die terminale Halbwertzeit von Flumazenil ist geringer als die von Midazolam. Es kann daher vorkommen, dass die Wirkung von Midazolam wieder einsetzt, weil das Gegenmittel metabolisiert wurde. Die Gabe des Gegenmittels muss überwacht werden.
Auslöser paradoxer Reaktionen
Von 2617 Kindern, die anlässlich endoskopischer Behandlungen Midazolam als Beruhigungsmittel bekommen hatten, zeigten 1,4 % eine Paradoxe Reaktion. Statt dämpfend wirkte das Mittel hier erregend. Des Weiteren gibt es ausführliche Fallbeschreibungen, wo bei Patienten die Erregung bis zu Tränenausbrüchen und aggressivem Verhalten führte. Als erfolgreiches und schnell wirkendes Gegenmittel (Antidot) hat sich in solchen Fällen Flumazenil bewährt. Typischerweise gibt es nach Aufhebung der paradoxen Reaktion bei den Patienten keinerlei Erinnerung an ihr Verhalten unter Midazolam, was der Verhinderung neuer Gedächtnisinhalte (Anterograde Amnesie) durch die Substanz zugeschrieben wird.[17][18]
Chemische und pharmazeutische Aspekte
Midazolam ist ein Derivat aus der Reihe der Imidazobenzodiazepine. Neben der freien Base werden pharmazeutisch auch Salze der Maleinsäure und der Salzsäure eingesetzt, das Midazolammaleat und das Midazolamhydrochlorid. Diese beiden Salze unterscheiden sich in der biologischen Aktivität nicht von der freien Base.
Durch den sauren pH-Wert der Midazolampräparate öffnet sich die Ringstruktur und Midazolam wird wasserlöslich. Bei der intranasalen Anwendung von Midazolampräparaten, die in Ausnahmefällen erfolgen kann, führt die saure Lösung deshalb zu einem unangenehmen Brennen. Nach Einbringen in den Körper schließt sich die Ringstruktur von Midazolam und es wird fettlöslich, so dass es die Bluthirnschranke passieren kann.[19]
Rechtlicher Status
In Deutschland ist Midazolam ein Betäubungsmittel im Sinne des BtMG (Anlage III). Ausgenommen hiervon sind Zubereitungen mit maximal 0,2 % Midazolam bzw. 15 mg Midazolam je abgeteilter Einheit, wie es bei dem zur Beendigung eines länger anhaltenden Krampfanfalls bei Säuglingen, Kleinkindern, Kindern und Jugendlichen zugelassenen Buccolam der Fall ist.[20] Somit sind Midazolam-haltige Medikamente in Deutschland generell verschreibungspflichtig. In den Niederlanden gehört Midazolam zu den Liste-II-Drogen des Opiumgesetzes (Opiumwet). Midazolam ist in den Listen der kontrollierten Substanzen der Konvention über psychotrope Substanzen unter den Tabelle IV-Drogen aufgeführt. In Großbritannien ist Midazolam auf der Liste III der kontrollierten Drogen.
Handelsnamen
Midazolam wird von Roche unter dem Handelsnamen Dormicum als Lösung zur Injektion, Infusion und rektalen Anwendung (Wirkstoff Midazolamhydrochlorid) sowie als Filmtabletten (Wirkstoff Midazolammaleat) vermarktet, ferner sind verschiedene Generika im Handel. Außerdem vertreibt Ratiopharm eine Lösung zum Einnehmen. Von der Firma Laboratorios Lesvi wird Midazolam zur Beendigung eines länger anhaltenden Krampfanfalls (Epilepsie) bei Kindern und Jugendlichen zwischen 3 Monaten und 18 Jahren unter dem Namen Buccolam (Anwendung in der Mundhöhle) vermarktet.
In den USA wurde Midazolam unter dem Namen Versed vertrieben.
Weblinks
- Poisons Information Monograph (PIM) für Midazolam
- Pschyrembel Online
Einzelnachweise
- Datenblatt Midazolam (PDF) beim EDQM, abgerufen am 23. Juni 2008.
- Externe Identifikatoren von bzw. Datenbank-Links zu Midazolam Hydrochlorid: CAS-Nummer: 59467-96-8, EG-Nummer: 261-776-6, ECHA-InfoCard: 100.056.142, PubChem: 43032, ChemSpider: 39217, Wikidata: Q27292444.
- Externe Identifikatoren von bzw. Datenbank-Links zu Midazolam Maleat: CAS-Nummer: 59467-94-6, EG-Nummer: 261-775-0, ECHA-InfoCard: 100.056.141, PubChem: 5384200, ChemSpider: 4531564, Wikidata: Q27266551.
- The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals, 14. Auflage (Merck & Co., Inc.), Whitehouse Station, NJ, USA, 2006; S. 1066, ISBN 978-0-911910-00-1.
- Datenblatt Midazolam hydrochloride bei Sigma-Aldrich, abgerufen am 10. April 2011 (PDF).
- A. Kleemann, J. Engel, B. Kutscher, D. Reichert: Pharmaceutical Substances – Synthesis, Patents, Applications, 4. Auflage (2001) Thieme-Verlag Stuttgart, ISBN 978-1-58890-031-9.
- Gebrauchsinformation Buccolam.
- H. J. Koch, F. Matthiessen: Nasale Applikation – Auf direktem Weg zum Wirkort, Pharmazeutische Zeitung, Ausgabe 50/2006.
- Fachinformation Dormicum Injektionslösung (Roche Pharma (Schweiz) AG); Stand der Informationen: November 2015.
- Fachinformation Dormicum Filmtabletten (Roche Pharma AG); Stand der Informationen: November 2017.
- M. Muskal: Ohio execution: New drug protocol, but 15 minutes to die. In: Los Angeles Times. 16. Januar 2014, abgerufen am 5. Mai 2014.
- Nach qualvollen Hinrichtungen: Höchstes US-Gericht lehnt Klage gegen Beruhigungsmittel ab, Der Spiegel, 29. Juni 2015.
- Todesstrafe: Arkansas richtet erstmals seit zwölf Jahren Häftling hin. In: Zeit Online. 21. April 2017, abgerufen am 21. April 2017.
- https://www.faz.net/aktuell/gesellschaft/kriminalitaet/arkansas-richtet-zwei-haeftlinge-an-einem-tag-hin-14986623
- Fachinformation Buccolam.
- S3-Leitlinie Analgesie, Sedierung und Delirmanagemant in der Intensivmedizin, AWMF-Registriernummer 001/012, online abrufbar als pdf; abgerufen am 12. Dezember 2015.
- C. Robin, N. Trieger: Paradoxical reactions to benzodiazepines in intravenous sedation: a report of 2 cases and review of the literature. In: Anesthesia progress. Band 49, Nummer 4, 2002, S. 128–132, PMID 12779114, PMC 2007411 (freier Volltext) (Review).
- A. A. Weinbroum, O. Szold, D. Ogorek, R. Flaishon: The midazolam-induced paradox phenomenon is reversible by flumazenil. Epidemiology, patient characteristics and review of the literature. In: European journal of anaesthesiology. Band 18, Nummer 12, Dezember 2001, S. 789–797, PMID 11737177 (Review), PDF.
- Franz Kehl: Anästhesie Fragen und Antworten 1655 Fakten für die Facharztprüfung und das Europäische Diplom für Anästhesiologie und Intensivmedizin (DESA). Springer, Berlin 2013, ISBN 978-3-642-35034-4.
- BtMG: Anlage III (zu § 1 Abs. 1) verkehrsfähige und verschreibungsfähige Betäubungsmittel.