Atropin
Atropin (abgeleitet von Atropa, dem Gattungsnamen der Tollkirsche) ist ein sehr giftiges Tropan-Alkaloid; es ist ein Racemat (1:1-Mischung) aus den Isomeren (R)- und (S)-Hyoscyamin, das sich bei der Isolierung durch Racemisierung aus dem Naturstoff (S)-Hyoscyamin bildet. Atropin steht auf der Liste der unentbehrlichen Arzneimittel der Weltgesundheitsorganisation.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
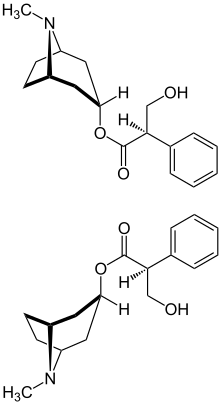 | ||||||||||||||||||||||
| (R)-Form (oben) und (S)-Form (unten) | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Atropin; (±)-Hyoscyamin | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C17H23NO3 | |||||||||||||||||||||
| Kurzbeschreibung |
farblose Prismen[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 289,38 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| pKS-Wert |
9,43[2] | |||||||||||||||||||||
| Löslichkeit |
wenig in Wasser (2,2 g·l−1 bei 25 °C)[2] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Geschichte und Vorkommen

(S)-Hyoscyamin (früher auch „Mandragorin“ genannt[7]) kommt in Nachtschattengewächsen wie Alraunen (Mandragora), Engelstrompete (Brugmansia), Stechapfel (Datura stramonium) und Tollkirschen (Atropa) vor. Seinen Namen verdankt das Alkaloid der Schwarzen Tollkirsche (Atropa belladonna).
Als Entdecker des Atropins gilt der Heidelberger Pharmazeut Philipp Lorenz Geiger (1785–1836).[8] Die Wirkung von Atropin wurde unter anderem von Friedlieb Ferdinand Runge (1795–1867) studiert. Im Jahr 1831 stellte der deutsche Pharmazeut Heinrich F. G. Mein (1799–1864)[9] Atropin in kristalliner Form dar.[10] Ab 1833 produzierte dann die Darmstädter Firma Merck das Atropin aus der Wurzel der Schwarzen Tollkirsche. Die erste Synthese gelang dem Chemiker Richard Willstätter im Jahr 1901.[11][12]
Chemische Struktur
Das (S)-Hyoscyamin ist ein Ester der Tropasäure mit α-Tropin und zählt somit zu den Tropan-Alkaloiden. Atropin ist die racemisierte Form des natürlich vorkommenden (S)-Hyoscyamins. Allein das 1:1-Gemisch von (R)- und (S)-Hyoscyamin wird Atropin genannt (vgl. Cahn-Ingold-Prelog-Konvention zur Benennung). Die Racemisierung findet bereits bei der Isolierung statt, wenn Laugen zum Einsatz kommen; hierbei bildet sich intermediär ein Enolat.[13] Durch eine Aufarbeitung unter neutralen Bedingungen (pH-Wert 7) kann die Racemisierung von (S)-Hyoscyamin unterdrückt werden. Der Bedeutung der Enantiomerenreinheit von Arzneistoffen wird zunehmend Beachtung geschenkt, denn die beiden Enantiomere eines chiralen Arzneistoffes zeigen fast immer eine unterschiedliche Pharmakodynamik und Pharmakokinetik. Dies wurde früher aus Unkenntnis über stereochemische Zusammenhänge oft ignoriert.[14] Arzneimittel enthalten den Arzneistoff Atropin als Racemat (1:1-Gemisch der Enantiomere); aus grundsätzlichen Überlegungen wäre die Verwendung des besser bzw. nebenwirkungsärmer wirksamen Enantiomers zu bevorzugen.
Ein dem Hyoscyamin strukturell nah verwandtes Alkaloid ist das Scopolamin (Hyoscin).
Wirkungen
Atropin gehört zu den Parasympatholytika (auch Anticholinergika genannt). Atropin wirkt demnach antagonistisch und konkurriert somit an den muskarinischen Rezeptoren des Parasympathikus mit dem Neurotransmitter Acetylcholin. Atropin blockiert teilweise die Rezeptoren und hemmt somit den Parasympathikus. Die Wirkung des Acetylcholins sinkt. Der Einfluss des Parasympathikus sinkt, wodurch der Einfluss des Sympathikus überwiegt.
Atropin hat folgende körperliche Wirkungen:
- Beschleunigung der Herzfrequenz (positive Chronotropie)
- Beschleunigung der Erregungsweiterleitung am Herz (positive Dromotropie)
- Weitstellung der Bronchien (Bronchodilatation)
- Weitstellung der Pupillen (= Mydriasis, vgl. Atropa belladonna, Schwarze Tollkirsche)
- stark verminderte Schweißbildung
- verminderte Speichelbildung
- Hemmung der Magen-Darm-Tätigkeit (verminderte Sekretion und Peristaltik)
- Erschlaffung der glatten Muskulatur (Spasmolyse)
- verminderte Sehfähigkeit, insbesondere in der Nähe (Hemmung der Akkommodation)
- starke Lichtempfindlichkeit (Photophobie)
- blockiert Rezeptoren der Nervenzellen (kein Erreichen der Rezeptoren durch Transmitter; Rezeptoren bleiben inaktiv)
Medizinische Verwendung
Kreislaufstillstand
Atropin wurde in der kardio-pulmonalen Reanimation bei Asystolie und pulsloser elektrischer Aktivität (PEA) eingesetzt, Dosen von 0,5 bis maximal 3 mg wurden intravenös verabreicht. Wegen mangelnder Evidenz ist die Gabe von Atropin bei einer Reanimation nach den Richtlinien des European Resuscitation Council nicht mehr empfohlen.[15] Eine zu niedrige Dosierung kann paradoxerweise zu einer schweren Bradykardie führen und sollte entsprechend vermieden werden (mindestens 0,02 mg/kg Körpergewicht).
Einsatz bei Bradykardien
Atropin wird in der Anästhesie, Intensiv- und Notfallmedizin bei der symptomatischen Behandlung einer zu niedrigen Herzfrequenz (Bradykardie) verwendet. Bei fehlender Effektivität, etwa bei höhergradigen AV-Blöcken, ist die Anwendung von Katecholaminen (Adrenalin) und einer Schrittmachertherapie notwendig.[15]
Augenheilkunde
Atropin wird in der Augenheilkunde zur diagnostischen und therapeutischen Akkommodationslähmung eingesetzt. Als Mydriatikum wird Atropin aufgrund seiner langen Wirkdauer zur therapeutischen, jedoch nicht zur kurzzeitigen diagnostischen Erweiterung der Pupillen verwendet.
Weite Pupillen galten besonders während der Renaissance bei Frauen als schön (ital. bella donna „schöne Frau“). Das Einträufeln der (S)-Hyoscyamin enthaltenden Tollkirschen-Extrakte in die Augen bewirkte eine bis zu mehreren Tagen anhaltende Pupillenerweiterung („feuriger Blick“).[1]
Außerdem zeigen durchgeführte Studien die Wirksamkeit von Atropin zur Bremsung einer fortschreitenden Kurzsichtigkeit im Kindesalter.[16]
Verwendung als Gegengift
Atropin hemmt die muscarinerge Wirkung des Acetylcholins durch kompetitive Inhibition der Acetylcholinrezeptoren an der postsynaptischen Membran und unterbricht die Signalübertragung in der Nervenleitung. In sehr hohen Dosen hemmt Atropin vermutlich auch einige Subtypen des nikotinischen Acetylcholinrezeptors.[17]
Auf Grund dieses Wirkungsmechanismus wird Atropin als Gegengift (Antidot) bei Vergiftungen mit bestimmten Pflanzenschutzmitteln (Insektiziden) und Nervenkampfstoffen eingesetzt, deren Giftwirkung auf einer irreversiblen Hemmung der Acetylcholinesterase beruht (z. B. organische Phosphorsäureester und Phosphonsäureester wie Parathion, Tabun oder Paraoxon). Patienten (z. B. mit Sarin kontaminierte Soldaten) werden per Autoinjektor Gaben von 2 mg Atropinsulfat bzw. 2 mg Atropinsulfat plus 220 mg Obidoximchlorid verabreicht.
Prämedikation
Atropin hemmt vor allem die M1-, M2- und M3-Rezeptoren und verursacht so eine Steigerung der Herzfrequenz (M2), eine Reduktion der Magensäureproduktion (M1) sowie eine Speichelreduktion (M3). Zusammen mit einer dezenten Bronchodilatation (M3) sind diese Wirkungen auch von Vorteil für eine Narkoseeinleitung. Ein genereller Einsatz in der Prämedikation (medikamentöse Vorbereitung) von Narkosepatienten wird jedoch heute nicht mehr empfohlen, da das Nutzen-Nebenwirkungs-Verhältnis von Atropin-Sulfat schlecht ist.
Atropin vermindert die Speichel- und Schleimsekretion, was bei Operationen im Mund und Rachenbereich sowie bei fiberoptischen Intubationen und Bronchoskopien genutzt werden kann.
Seltene Anwendungsgebiete
Seltener findet Atropin Anwendung bei der glatten Muskulatur im Bereich des Magen-Darm-Trakts. Auch kann Atropin bei Harninkontinenz und zur Behandlung einer Reizblase gegeben werden. Selten wurde Atropin in der Frauenheilkunde bei Dysmenorrhoe (schmerzhafte Regelblutung) eingesetzt. Den gleichen Effekt erzielt man heute mit Butylscopolamin, einem chemisch weiterentwickelten Derivat des Scopolamins, das entspannend auf die verkrampfte glatte Muskulatur wirkt und aufgrund der geringeren Nebenwirkungen rezeptfrei erhältlich ist. Als Asthmamittel wird Atropin nicht mehr verwendet, stattdessen werden besser verträgliche Arzneistoffe eingesetzt. Der Atropintest kann zur kardiologischen Diagnostik und als Hilfestellung bei der Feststellung des Hirntodes verwendet werden.
Außerdem wird Atropin auch gegen übermäßiges Schwitzen (Hyperhidrose) eingesetzt (Off-Label-Use).
Missbrauch, Überdosierung, Vergiftung
Die Wirkungen auf Herz und Kreislauf stehen schon bei geringen Dosen im Vordergrund (z. B. zur Narkoseeinleitung). Psychische („berauschende“) Wirkungen sind erst bei hohen Dosen zu erwarten, bei denen unangenehme und gefährliche körperliche Nebenwirkungen auftreten.
Als Vergiftungssymptome wird bei hohen Dosen (siehe anticholinerges Syndrom) von Rötungen der Haut, Mydriasis, Herzrasen und Verwirrtheit wie Halluzinationen berichtet. Bei noch höheren Dosen tritt Bewusstlosigkeit ein, die von Atemlähmung gefolgt sein kann; bei einer Atemlähmung sind die Vergiftungen in der Regel tödlich. Die LD50 (oral) beträgt für den Menschen 453 mg.[18] Ab 10 mg treten Delirien und Halluzinationen auf. Ab 100 mg kann eine tödliche Atemlähmung einsetzen. Insbesondere Kinder sind schon bei geringeren Dosen ab 10 mg in Gefahr.
Neben Vergiftungen durch freiwilligen oder unfreiwilligen Verzehr von Pflanzenteilen (zum Beispiel Tollkirsche) kommen medizinale Vergiftungen infolge Überdosierung, Verwechslung oder falscher Anwendung vor. Z. B. hat die Food and Drug Administration (FDA) im Jahre 2016 Globuli im Zusammenhang mit zehn Todesfällen in den USA von Kleinkindern untersucht, die nach der Verabreichung dieses Mittels, das Atropin enthielt, starben. Das Atropin war offenbar in zu hoher Konzentration in den Globuli enthalten. Die Behörde wies die Hersteller an, die Tabletten zurückzurufen.[19]
Die Erste Hilfe bei Atropinvergiftung besteht in sofortiger Entleerung des Magen-Darm-Traktes (Erbrechen, Magenspülung) sowie erforderlichenfalls künstlicher Beatmung bzw. Atemspende. Die erweiterten Maßnahmen zielen auf die medikamentöse Hemmung der Acetylcholinesterase, durch Physostigmin als Antidot, wodurch der Abbau des Acetylcholins verzögert wird. Folglich erhöht sich die Konzentration im synaptischen Spalt. Am Rezeptor selbst wird somit indirekt eine parasympathische Wirkung erzielt. Das Atropin wird aus dem Bereich der Rezeptoren verdrängt und die Reizleitung ist wiederhergestellt.
Handelsnamen
- Monopräparate: Bellafit (CH), Dysurgal (D), Generika (D, A, CH)
- in ehemaligen Kombinationspräparaten: Eucard (D)[20]
Literatur
- Wolf-Dieter Müller-Jahncke: Atropin. In: Werner E. Gerabek, Bernhard D. Haage, Gundolf Keil, Wolfgang Wegner (Hrsg.): Enzyklopädie Medizingeschichte. De Gruyter, Berlin / New York 2005, ISBN 3-11-015714-4, S. 115 f.
Weblinks
Einzelnachweise
- Eintrag zu Atropin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 10. November 2014.
- Eintrag zu Atropine in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM)
- Eintrag zu Atropine im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. August 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Eintrag zu Atropin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- Raymond L. Cahen, Kristen Tvede: Homatropine Methylbromide: A Pharmacological Reevaluation. In: Journal of Pharmacology and Experimental Therapeutics. Bd. 105, Nr. 2, Juni 1952, S. 166–177.
- Daniel Bovet, Filomena Bovet-Nitti: Structure et Activité Pharmacodynamique des Médicaments du Système Nerveux Végétatif. S. Karger, Basel 1948, S. 482.
- Carl Hans Sasse: Geschichte der Augenheilkunde in kurzer Zusammenfassung mit mehreren Abbildung und einer Geschichtstabelle (= Bücherei des Augenarztes. Heft 18). Ferdinand Enke, Stuttgart 1947, S. 27.
- Geiger, Philipp Lorenz. In: Edward Kremers, George Urdang: Kremers and Urdang’s History of Pharmacy. Reprint of the 4th Edition. American Institute of the History of Pharmacy, Madison WI 1986, ISBN 0-931292-17-4, S. 459.
- Biography of Heinrich Friedrich Georg Mein (1799–1864)
- Heinrich Friedrich Georg Mein (1831): Ueber die Darstellung des Atropins in weissen Kristallen, In: Annalen der Pharmacie, 6(1): S. 67–72 (eingeschränkte Vorschau in der Google-Buchsuche).
Unabhängig davon wurde Atropin 1833 von Geiger und Hesse isoliert:- Geiger and Hesse (1833): Darstellung des Atropins, In: Annalen der Pharmacie, 5: S. 43–81 (eingeschränkte Vorschau in der Google-Buchsuche).
- Geiger and Hesse (1833): Fortgesetzte Versuche über Atropin, In: Annalen der Pharmacie, 6: S. 44–65 (eingeschränkte Vorschau in der Google-Buchsuche).
- Richard Willstätter (1901) Synthese des Tropidins, Berichte der Deutschen chemischen Gesellschaft zu Berlin, 34: S. 129–144.
- Richard Willstätter (1901) Umwandlung von Tropidin in Tropin, Berichte der Deutschen chemischen Gesellschaft zu Berlin, 34: S. 3163–3165.
- Woldemar Schneider: Zur Kenntnis des 1-Hyoscyamins und Atropins. In: Archiv der Pharmazie. Bd. 284, Nr. 5/6, 1951, S. 306–318; doi:10.1002/ardp.19512840514.
- E. J. Ariëns: Stereochemistry, a Basis for Sophisticated Nonsense in Pharmacokinetics and Clinical Pharmacology. In: European Journal of Clinical Pharmacology. Bd. 26, Nr. 6, 1984, S. 663–668; doi:10.1007/BF00541922.
- Charles D. Deakin, Jerry P. Nolan, Jasmeet Soar, Kjetil Sunde, Rudolph W. Koster, Gary B. Smith, Gavin D. Perkins: European Resuscitation Council Guidelines for Resuscitation 2010 Section 4. Adult advanced life support. In: Resuscitation. Bd. 81, Nr. 10, Oktober 2010, S. 1305–1352, PMID 20956049, doi:10.1016/j.resuscitation.2010.08.017.
- Deutscher Ärzteverlag GmbH, Redaktion Deutsches Ärzteblatt: Prävention des Fortschreitens einer Myopie: Niedrigdosiertes Atropin ist offenbar guter Kompromiss. 13. Mai 2016, abgerufen am 10. November 2019.
- Ruud Zwart, Henk P. M. Vijverberg: Potentiation and inhibition of neuronal nicotinic receptors by atropine: competitive and noncompetitive effects. In: Molecular Pharmacology. Bd. 52, Nr. 5, November 1997, S. 886–895, PMID 9351980, (Experiment an Frosch-Eizellen).
- E. Goodman, J. Ketchum, R. Kirby: Historical Contributions to the Human Toxicology of Atropine. In: Eximdyne, 2010, ISBN 978-0-9677264-3-4, S. 120.
- Homöopathie: Zehn Kinder starben nach Einnahme von Globuli. Zeit Online, 23. Februar 2017; abgerufen am 10. Mai 2017.
- Eucard. (Anzeige der Südmedica GmbH, München) In: Münchener Medizinische Wochenschrift. Jahrgang 1953, Nr. 1 (Januar) 1953, S. CXXXV.