Ticagrelor
Ticagrelor ist ein Thrombozytenaggregationshemmer, der die Verklebung der Blutplättchen und so die Bildung von Blutgerinnseln hemmt. Er wird zur Verhinderung eines Herzinfarkts eingesetzt. Der Wirkstoff ist seit 2010 in der Europäischen Union und seit 2011 in den Vereinigten Staaten zugelassen.[2][3]
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
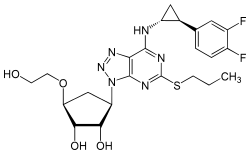 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Ticagrelor | |||||||||||||||||||||
| Andere Namen |
(1S,2S,3R,5S)-3-[7-[(1R,2S)-2-(3,4-Difluorphenyl)cyclopropylamino]-5-(propylthio)-3H-[1,2,3]triazolo[4,5-d]pyrimidin-3-yl]-5-(2-hydroxyethoxy)cyclopentan-1,2-diol | |||||||||||||||||||||
| Summenformel | C23H28F2N6O4S | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
B01AC24 | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 522,57 g·mol−1 | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Wirkmechanismus
Ticagrelor hemmt den ADP-Rezeptor P2Y12 an den Blutplättchen und reduziert damit deren Gerinnungsfähigkeit. Es wird dabei eine eigene Bindungsstelle am Rezeptor für den Wirkstoff angenommen. Die Bindung erfolgt reversibel. Eine kompetitive Hemmung mit ADP liegt nicht vor.[4][5]
Wirkung
Zwei Stunden nach Einnahme der Aufsättigungsdosis ist der Spitzenspiegel des Wirkstoffs bei neun von zehn Menschen erreicht und eine rund 70-prozentige Hemmung der Blutplättchengerinnung feststellbar. Die Bioverfügbarkeit des Wirkstoffes beträgt rund ein Drittel, unabhängig von Nahrungs- oder Flüssigkeitsaufnahme. Ticagrelor hat eine Halbwertszeit von 7 bis 8 Stunden und wird über die Nieren aus dem Körper ausgeschieden. Die Hemmung der Gerinnungsfähigkeit klingt nach 1–3 Tagen ab.[6]
Indikation
Ticagrelor ist zur Behandlung des akuten Koronarsyndroms (instabile Angina Pectoris, NSTEMI, STEMI) in Kombination mit Acetylsalicylsäure zugelassen. Ticagrelor konnte dabei die Rate der Todesfälle über ein Jahr um ein Prozent gegenüber einem Patientenkollektiv mit der Kombination ASS/Clopidogrel reduzieren. Wenn 54 Patienten mit akutem Koronarsyndrom mit Ticagrelor anstelle von Clopidogrel behandelt werden, so verhindert dies ein atherothrombotisches Ereignis (Herzinfarkt, Schlaganfall oder instabile Angina Pectoris); die Behandlung von 91 Patienten verhindert einen kardiovaskulären Tod. Der kardiovaskuläre Schutz ist noch größer, wenn die Tagesgesamtdosis von Acetylsalicylsäure maximal 150 mg beträgt.[7] Auch Patienten, die keine genetische Disposition für eine Clopidogrel-Resistenz aufweisen, haben unter Ticagrelor im Vergleich zu Clopidogrel ein niedrigeres Risiko, einen Herztod, Herzinfarkt oder Schlaganfall zu erleiden.[8] In den Zulassungsstudien kam es unter Ticagrelor zu einer erhöhten Rate behandlungsbedürftiger Blutungen, jedoch zu keiner höheren Rate schwerer oder tödlicher Blutungen.[6]
Nebenwirkungen und Anwendungsbeschränkungen
Eine häufige, oft selbstlimitierende Nebenwirkung ist Atemnot. Es kann zum Auftreten oft bradykarder Herzrhythmusstörungen kommen. Aufgrund der Gefahr einer Nierenschädigung sind laborchemische Kontrollen obligat. Gelegentlich wird eine Gynäkomastie ausgelöst.[6]
Bei rückenmarksnahen Regionalanästhesie-Verfahren (Spinalanästhesie bzw. Periduralanästhesie) sollte Ticagrelor fünf Tage vorher abgesetzt werden und frühestens sechs Stunden nach dem Eingriff wieder gegeben werden.[9]
Gesundheitsökonomie
Ticagrelor, dem als erster Wirkstoff im Rahmen des AMNOG-Verfahrens ein beträchtlicher Zusatznutzen zuerkannt wurde,[10] ist mit Jahrestherapiekosten von 1.092 Euro deutlich teurer als die bisherige Standardtherapie mit Clopidogrel, welches als Generikum nur 32 Euro pro Jahr kostet. Durch Rabattverhandlungen mit dem Hersteller konnte eine Preisreduktion um rund 20 % erzielt werden. Prasugrel, ein weiteres Konkurrenzprodukt, kostet nur geringfügig weniger als Ticagrelor. Die Indikation und Kostenübernahme wurde vom Gemeinsamen Bundesausschuss 2011 bestätigt.[11] Das oberste Regulationskomitee im britischen Gesundheitswesen NICE kam zum selben Ergebnis.[12]
Der Gemeinsame Bundesausschuss hat 2011 für nachfolgende Indikationen einen Zusatznutzen anerkannt: Instabile Angina Pectoris oder Myokardinfarkt ohne ST-Strecken-Hebung im Vergleich zu Clopidogrel, Myokardinfarkt mit ST-Strecken-Hebung und perkutaner Koronarintervention im Vergleich zu Prasugrel, wenn diese Patienten über 74 Jahre alt sind und nicht für eine Therapie mit Prasugrel in Kombination mit Acetylsalicylsäure infrage kommen oder Patienten, die eine transitorische ischämische Attacke oder einen ischämischen Schlaganfall in der Anamnese haben.[13] In diesen Fällen gilt Brilique als Praxisbesonderheit, so dass im Fall einer Richtgrößenprüfung die entsprechenden Verordnungen aus dem Budget der Praxis herausgerechnet werden.[14]
Handelsnamen
- Brilinta (US)
- Brilique (EU, CH)
- Possia (EU)
Weblinks
- FDA: PHARMACOLOGY/TOXICOLOGY REVIEW AND EVALUATION (PDF; 7,3 MB)
- Öffentlicher Beurteilungsbericht (EPAR) der europäischen Arzneimittelagentur (EMA) zu: Ticagrelor
Einzelnachweise
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Publikation der EMA Assessment Report for Brilique International non-proprietary name: ticagrelor Procedure No. EMEA/H/C/1241. abrufbar als (pdf); zuletzt abgerufen am 1. Juni 2012.
- Pressemitteilung der FDA vom 20. Juli 2011 abrufbar als htm; zuletzt abgerufen am 1. Juni 2012.
- J. J. van Giezen, L. Nilsson, P. Berntsson, B. M. Wissing, F. Giordanetto: Ticagrelor binds to human P2Y(12) independently from ADP but antagonizes ADP-inducedreceptor signaling and platelet aggregation. In: J Thromb Haemost. 7(9), Sep 2009, S. 1556–1565. Epub 23. Juni 2009, PMID 19552634.
- S. Husted, J. J. van Giezen: Ticagrelor: the first reversibly binding oral P2Y12 receptor antagonist. In: Cardiovasc Ther. 27(4), Winter 2009, S. 259–274. PMID 19604248.
- Arznei-Telegramm: Ticagrelor (Brilique) bei akutem Koronarsyndrom. a-t 2011; 42: 1-3, online abrufbar als html; zuletzt abgerufen am 1. Juni 2012.
- https://web.archive.org/web/20111030140045/http://ifap.kjm6.de/nlgen/upload/Brilique_April_2011.pdf Fachinformation zu Brilique (PDF; 218 kB).
- L. Wallentin, S. James, R. F. Storey: Effect of CYP2C19 and ABCB1 single nucleotide polymorphisms on outcomes of treatment with ticagrelor versus clopidogrel for acute coronary syndromes: a genetic substudy of the PLATO trial. In: The Lancet. 376, 2010, S. 1320–1328.
- Wiebke Gogarten, Hugo Van Aken: Perioperative Thromboseprophylaxe - Thrombozytenaggregationshemmer - Bedeutung für die Anästhesie. In: AINS - Anästhesiologie · Intensivmedizin · Notfallmedizin · Schmerztherapie. 47, 2012, S. 242–252, doi:10.1055/s-0032-1310414.
- www.monitor-versorgungsforschung.de (abgerufen am 23. März 2013).
- Offizielle Bekanntmachung des Gemeinsamen Bundesausschusses vom 15. Dezember 2011, online verfügbar als (pdf); zuletzt abgerufen am 2. Juni 2012.
- NICE-Guideline: Ticagrelor for the treatment of acute coronary syndromes. Oktober, 2011; zuletzt abgerufen am 2. Juni 2012.
- Erster G-BA-Beschluss zur Bewertung des Zusatznutzens eines neuen Arzneimittels: Ticagrelor hat beträchtlichen Zusatznutzen für bestimmte Patientengruppen. auf: www.g-ba.de, abgerufen am 30. Mai 2013.
- Kosten für ersten Neuling stehen fest. auf: www.pharmazeutische-zeitung.de, abgerufen am 29. Mai 2013.