Cilostazol
Cilostazol (Handelsname Pletal®; Hersteller Otsuka) ist ein Arzneistoff aus der Gruppe der selektiven Phosphodiesterase-3-Hemmer. Er wird eingesetzt zur symptomatischen Behandlung von arteriellen Durchblutungsstörungen (pAVK).[9]
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
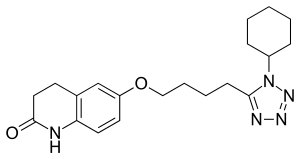 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Cilostazol | |||||||||||||||||||||
| Andere Namen |
6-[4-(1-Cyclohexyl-1H-tetrazol-5-yl)butoxy]-3,4-dihydrochinolin-2-on (IUPAC) | |||||||||||||||||||||
| Summenformel | C20H27N5O2 | |||||||||||||||||||||
| Kurzbeschreibung |
farblose Kristalle[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
B01AC | |||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 369,46 g·mol−1 | |||||||||||||||||||||
| Dichte |
1,26 g·cm−3[2] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit |
9 mg·l−1 in Wasser[6] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Handelsformen
Cilostazol-Tabletten gibt es unter dem Namen Pletal (pharmazeutischer Unternehmer: Otsuka Pharmaceutical Europe) in den Dosierungen 50 mg und 100 mg.[9] Pletal wird in Deutschland von UCB Pharma und deren Tochter Sanol vertrieben.
Wirkmechanismus
Cilostazol ist ein Hemmstoff der Phosphodiesterase vom Typ III. Die Hemmung der Phosphodiesterase erhöht die Konzentration des cyclischen Adenosinmonophosphats (cAMP). Dadurch verbessert sich die Endothelfunktion und die Zusammenballung von Blutplättchen (Thrombozytenaggregation) wird gehemmt. Durch die Wachstumshemmung von Gefäßmuskelzellen kommt es außerdem zu einem gefäßerweiternden Effekt.[9]
Anwendungsgebiete
Cilostazol wird eingesetzt zur Verlängerung der schmerzfreien Gehstrecke bei peripheren arteriellen Durchblutungsstörungen (pAVK) im Stadium 2 (Claudicatio intermittens). Die empfohlene Dosis von Cilostazol beträgt 2 mal täglich 100 mg.[9]
Aufgrund von Meldungen über kardiovaskuläre und hämorrhagische Reaktionen sowie Wechselwirkungen hat die Europäische Arzneimittel-Agentur Nutzen und Risiken von Cilostazol überprüft. Die Indikation wurde daraufhin eingeschränkt und die Empfehlungen hinsichtlich der Dosierung, Gegenanzeigen und der besonderen Warnhinweise geändert:[10]
Cilostazol sollte nur bei Patienten verordnet werden, bei denen Änderungen des Lebensstils (zum Beispiel Einstellung des Rauchens, Bewegung, Diät) die Symptome der Claudicatio intermittens nicht ausreichend verbessert haben („second line use“). Es sollte nicht verabreicht werden bei Patienten, die zwei oder mehr Thrombozytenaggregationshemmer oder Gerinnungshemmer einnehmen sowie bei Patienten mit instabiler Angina Pectoris oder einem Myokardinfarkt oder einer Koronarintervention in den letzten sechs Monaten oder mit einer schweren Tachyarrhythmie in der Vorgeschichte.[11]
Bei mit Cilostazol behandelten Patienten soll routinemäßig überprüft werden, ob die Behandlung noch angebracht ist und mit den überarbeiteten Gegenanzeigen, besonderen Warnhinweisen und Vorsichtsmaßnahmen übereinstimmt.
Nebenwirkungen
Die häufigsten beschrieben Nebenwirkungen sind Kopfschmerzen und Durchfall.[9] Es wurden ferner schwerwiegende unerwünschte kardiovaskuläre und hämorrhagische Wirkungen berichtet, weswegen die europäische Arzneimittelagentur im Mai 2011 ein Risikobewertungsverfahren eingeleitet hat.[12]
Bei rückenmarksnahen Regionalanästhesie-Verfahren (Spinalanästhesie bzw. Periduralanästhesie) sollte Cilostazol 42 Stunden vorher abgesetzt werden und frühestens fünf Stunden nach dem Eingriff wieder gegeben werden.[13]
Einzelnachweise
- Chandgude, A.L.; Dömling, A.: Convergent Three-Component Tetrazole Synthesis in Eur. J. Org. Chem. 2016, 2383–2387, doi:10.1002/ejoc.201600317.
- Whittall, L.B.; Whittle, R.R.; Stowell, G.W.: Polymorphic forms of cilostazol in Acta Cryst. C 58 (2002) o525–o527, doi:10.1107/S0108270102012544.
- Nishi, T.; Tabusa, F.; Tanaka, T.; Shimizu, T.; Kanbe, T.; Kimura, Y.; Nakagawa, K.: Studies on 2-Oxoquinoline Derivatives as Blood Platelet Aggregation Inhibitors. II. 6-[3-(1-Cyclohexyl-5-tetrazolyl) propoxy]-1, 2-dihydro-2-oxoquinoline and Related Compounds in Chem. Pharm. Bull. 31 (1983) 1151–1157, doi:10.1248/cpb.31.1151, pdf.
- Komasaka, T.; Fujimura, H.; Tagawa, T.; Sugiyama, A.; Kitano, Y.: Practical Method for Preparing Nanosuspension Formulations for Toxicology Studies in the Discovery Stage: Formulation Optimization and in Vitro/in Vivo Evaluation of Nanosized Poorly Water-Soluble Compounds in Chem. Pharm. Bull. 62 (2014) 1073–1082, doi:10.1248/cpb.c14-00232, pdf.
- Stowell, G.W.; Behme, R.J.; Denton, S.M.; Pfeiffer, I.; Sancilio, F.D., Whittall, L.B.; Whittle, R.R.: Thermally-Prepared Polymorphic Forms of Cilostazol in J. Pharm. Sci. 91 (2002) 2481–2488, doi:10.1002/jps.10240.
- Takács-Novák, K.; Urac, M.; Horváth, P.; Völgyi, G.; Anderson, B.D.; Avdeef, A.: Equilibrium solubility measurement of compounds with low dissolution rate by Higuchi's Facilitated Dissolution Method. A validation study in Eur. J. Pharm. Sci. 106 (2017) 133–144, doi:10.1016/j.ejps.2017.05.064.
- Datenblatt Cilostazol, ≥98% (HPLC), powder bei Sigma-Aldrich, abgerufen am 1. Dezember 2019 (PDF).
- A. Kleemann, J. Engel, B. Kutscher, D. Reichert: Pharmaceutical Substances - Synthesis, Patents, Applications, 4. Auflage (2001) Thieme-Verlag Stuttgart, ISBN 978-1-58890-031-9.
- Fachinformation Pletal 50 mg und 100 mg Tabletten, Stand März 2009, Otsuka Pharmaceutical Europe Ltd. Abrufbar auf dem Portal des Bundes und der Länder, PharmNet.Bund.
- European Medicines Agency recommends restricting use of cilostazol-containing medicines
- Rote-Hand-Brief vom 1. Mai 2013 (PDF; 3,1 MB) Rote-Hand-Brief des Herstellers Otsuka vom 1. Mai 2013.
- Europäische Arzneimittelagentur: Meeting highlights from the Committee for Medicinal Products for Human Use (CHMP), 16-19 May 2011.
- Wiebke Gogarten, Hugo Van Aken: Perioperative Thromboseprophylaxe - Thrombozytenaggregationshemmer - Bedeutung für die Anästhesie In: AINS - Anästhesiologie · Intensivmedizin · Notfallmedizin · Schmerztherapie. 47, 2012, S. 242–252, doi:10.1055/s-0032-1310414.
Weblinks
- S3-Leitlinie Diagnostik und Therapie der peripheren arteriellen Verschlusskrankheit (PAVK) der Deutschen Gesellschaft für Angiologie - Gesellschaft für Gefäßmedizin. In: AWMF online (Stand 11/2015)
- Einträge im NIH-Studienregister Abgerufen am 1. März 2010