VX
Die Substanz VX ist ein chemischer Kampfstoff und zählt dort innerhalb der Nervengifte zur V-Reihe (V für viscous, viskos).
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
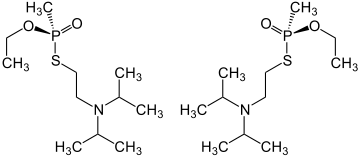 | |||||||||||||
| 1:1-Gemisch aus der (R)-Form (links) und der (S)-Form (rechts) | |||||||||||||
| Allgemeines | |||||||||||||
| Name | VX | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | C11H26NO2PS | ||||||||||||
| Kurzbeschreibung |
farb- und geruchlose, ölige Flüssigkeit[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 267,37 g·mol−1 | ||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||
| Dichte |
1,01 g·cm−3[2] | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Siedepunkt |
298 °C[2] (Zersetzung) | ||||||||||||
| Dampfdruck | |||||||||||||
| Löslichkeit | |||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Toxikologische Daten | |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Weitere Bezeichnungen für den Stoff sind TX 60, EA 1701 (Edgewood Arsenal Code) oder systematisch O-Ethyl-S-2-diisopropylaminoethylmethylphosphonothiolat (IUPAC).
VX dringt über die Haut, die Augen und die Atemwege in den Körper ein und verursacht zunächst Husten und Übelkeit. Dann lähmt es die Atemmuskulatur und führt innerhalb weniger Minuten unter starken Krämpfen und Schmerzen zum Tod.
Herstellung und Struktur
Zur Synthese von VX wird O-Ethyl-O-2-diisopropylaminoethylmethyl-phosphonit[8] mit Schwefel umgesetzt. VX ist somit ein binärer Kampfstoff, der leicht aus den beiden Vorläufersubstanzen erzeugt werden kann (z. B. in einer Kampfstoffgranate durch einfaches Vermischen der Komponenten beim Abschuss).[9]
Stereoisomerie
VX besitzt ein Stereozentrum am Phosphoratom, es gibt also zwei Enantiomere in (R)- und (S)-Konfiguration. Übliche Herstellungsverfahren liefern racemisches VX, also ein 1:1-Gemisch aus (R)-O-Ethyl-S-2-diisopropylamino-ethylmethylphosphonothiolat und (S)-O-Ethyl-S-2-diisopropylamino-ethylmethylphosphonothiolat.
Die Toxizität der Isomere unterscheidet sich in Abhängigkeit von der Stereochemie am P-Atom. Für die intravenöse Applikation wurden bei Mäusen folgende LD50-Werte bestimmt:[10]
- (RS)-(±)-VX: 20,1 µg/kg
- (S)-(–)-VX: 12,6 µg/kg
- (R)-(+)-VX: 165 µg/kg
Das giftigere Isomer ist (S)-VX [(–)-VX], das etwa 1,6-mal toxischer als racemisches (±)-VX ist.
Eigenschaften
Es handelt sich in reiner Form um eine farb- und geruchlose, durch Verunreinigungen oft leicht gelbliche, ölige Flüssigkeit.[1] Je nach Herstellungsverfahren und Reinheit kann VX einen schwachen Geruch nach fauligem Fisch und Mercaptan aufweisen.[11]
Während sich Nervenkampfstoffe der G-Reihe (G für Germany) wie Tabun (GA) oder Sarin (GB) binnen Stunden bis Tagen verflüchtigen, hat VX eine weitaus größere Persistenz. Die Volatilität von VX ist verglichen mit Sarin etwa 2000-mal geringer.[11] VX kann unter geeigneten Bedingungen Wochen am Einsatzort verbleiben und ist zudem wesentlich giftiger als die Kampfstoffe der G-Reihe.
Von den großtechnisch produzierten chemischen Kampfstoffen ist VX der mit der höchsten Toxizität. Lediglich einige Toxine sind deutlich giftiger; diese zählen jedoch als ABO (Agents of Biological Origin) definitionsgemäß nicht zu den C-, sondern den B-Kampfstoffen, auch wenn sie in der Chemiewaffenkonvention reguliert werden.
Hydrolyse
Im sauren pH-Bereich wird unter Abspaltung von Diisopropylaminoethanthiol der toxikologisch vergleichsweise unbedenkliche Methanphosphonsäuremonoethylester gebildet. Die basische Hydrolyse im pH-Bereich von pH 7–10 führt dagegen unter Abspaltung des Ethoxy-Restes zum Methanphosphonsäure-diisopropylaminoethanthiolester (EA 2192), bzw. dessen Salz.[12]
EA 2192 und dessen Salze sind ebenfalls äußerst giftig und wirken wie VX als Cholinesterase-Hemmer. Die Toxizität von EA 2192 ist nur etwa 2–3 fach geringer als die Toxizität von VX. EA 2192 wird im Gegensatz zu VX aber praktisch kaum über die Haut aufgenommen. EA 2192 und dessen Salze sind Feststoffe und gaschromatographisch nicht ohne weiteres detektierbar.
Wirkung
Die Aufnahme von VX findet überwiegend über die Haut statt, da VX wegen seines äußerst geringen Dampfdruckes als sesshafter Kampfstoff gilt; nur im Falle der Ausbringung als Aerosol besteht eine relevante Gefährdung durch Aufnahme über die Atemwege. Die Kontamination kann nur durch einen adäquaten Individualschutz verhindert werden. Einmal in den Körper aufgenommen, blockiert VX die Acetylcholinesterase in den Synapsen des parasympathischen vegetativen Nervensystems, den acetylcholinvermittelten Synapsen des sympathischen Anteils des vegetativen Nervensystems (Sympathikus) und an der neuromuskulären Endplatte (motorische Endplatte). Es kommt dadurch zu einem Anstieg des Neurotransmitters Acetylcholin (ACh) in der Synapse und damit zu einer Dauerreizung der betroffenen Nerven.
In der Folge treten, abhängig von der Höhe der Vergiftung, die folgenden Symptome auf: Nasenlaufen, Sehstörungen, Pupillenverengung, Augenschmerzen, Atemnot, Speichelfluss, Muskelzucken und Krämpfe, Schweißausbrüche, Erbrechen, unkontrollierbarer Stuhlabgang, Bewusstlosigkeit, zentrale und periphere Atemlähmung und letztlich der Tod. Die Wirkung am Auge tritt bereits bei geringeren Konzentrationen ein als die Wirkung im Atemtrakt. Daher treten Akkommodationsstörungen und eine Miosis bereits bei Konzentrationen und Expositionszeiten auf, bei denen andere Vergiftungszeichen noch nicht zu beobachten sind.
Schon bei einer AChE-Hemmung von weniger als 50 % treten erste Vergiftungssymptome auf, bei einer Hemmung von 90 % sind die Vergiftungssymptome lebensbedrohlich und können innerhalb weniger Minuten zum Tod führen.[13]
Der LD50-Wert für einen durchschnittlichen Erwachsenen liegt bei etwa 1 mg bei respiratorischer Aufnahme (über die Atemwege), beziehungsweise 10 mg bei Aufnahme über die Haut. Es sind jedoch auch Todesfälle bei Aufnahme deutlich geringerer Dosen (4 μg/kg oral[14][3] und 86 μg/kg dermal[15]) beschrieben.
Die Wirkung ähnelt der anderer phosphororganischer Verbindungen wie Tabun, Soman und Sarin, aber auch verschiedener Insektizide wie Parathion (E605). Andere Pestizide beruhen auf demselben Wirkprinzip, wirken aber auf Insekten um Größenordnungen stärker als auf Menschen. Beispiele hierfür sind Malathion, Disulfoton und ähnliche Substanzen.
Humanstudien mit VX
Ab 1959 erfolgten zahlreiche Humanversuche mit racemischem (±)-VX, bei denen die Toxizität und die Wirkung bei verschiedenen Applikationsarten (intravenös, oral, percutan, inhalativ) untersucht wurden.
Intravenöse Applikation:[16] Den Versuchen zufolge treten erste physiologische Effekte wie Kopfschmerzen, Benommenheit, Schweißausbrüche und Bauchkrämpfe im Dosisbereich von 0,06–0,1 µg/kg (das sind bei einem 80–90 kg schwerem Mann etwa 5–8,5 µg) auf. 1,3–1,5 µg/kg (105–135 µg) führen zu Schwindel, Zittern, Benommenheit, starker Übelkeit, Erbrechen und abdominalen Krämpfen. Die Aktivität der Cholinesterase fällt in diesem Dosisbereich innerhalb von 15 Minuten auf 45–17 % ab. Eine Regenerierung der Cholinesterase erfolgt die ersten ein bis zwei Tage mit einer Rate von etwa 1 % pro Stunde. Mengen im Bereich von etwa 150–210 µg führen zu einer Cholinesterasehemmung von etwa 85 % und zur weitgehenden Handlungsunfähigkeit mit teilweisem Verlust des Kontaktes zur Umwelt.
Percutane Applikation:[16] Percutan führen 5–35 µg/kg (etwa 0,4–3 mg) zu Schwitzen, Müdigkeit, Schwäche, Übelkeit, Erbrechen und Kopfschmerzen. Bei Aufnahme über die Haut treten erste Symptome stark verzögert je nach Ort der Applikation im Zeitraum von 5 bis 10 Stunden nach Hautkontakt auf. Versuchen mit radioaktiv markiertem VX (32P) zufolge wird über die Handfläche weniger als 1 % resorbiert, über die Haut am Rücken etwa 8 % und 15 % über die Unterarme.
Orale Applikation:[16] Oral führen Mengen von 0,2–0,4 mg zu einer Hemmung der Cholinesterase um 50–80 %.
Therapie
Atropin ist eine Möglichkeit, bei einer VX-Vergiftung die Wirkung an den muskarinischen Acetylcholinrezeptoren kompetitiv zu unterbrechen. Es muss ca. alle zehn Minuten in einer Dosis von 2–5 mg gegeben werden. Zusätzlich muss Obidoximchlorid gegeben werden, um die Acetylcholinesterase zu reaktivieren. Die Oximtherapie ist jedoch bei VX nur kurze Zeit nach der Vergiftung erfolgreich, da nach der Bindung an die Cholinesterase durch Reaktion mit Wasser ein Alkoxyrest vom Organophosphat – also dem gebundenen VX – abgespalten wird, was als „Alterung“ bezeichnet wird.[17]
Entdeckung und Verbreitung
Die Phosphorylthiocholin-Klasse wurde unabhängig voneinander durch Ranaji Goshem von Imperial Chemical Industries Limited (USA) und von Lars-Erik Tammelin vom Schwedischen Institut für Verteidigungsforschung 1952 entdeckt.[18]
1955 wurde der erste „V“-Kampfstoff VG (Amiton) hergestellt. Später wurden noch weit giftigere Substanzen in dieser Gruppe entwickelt, wie VM, VE und VS.[19][20]
VX wurde bis zur Unterzeichnung der Chemiewaffenkonvention 1997, in der die Zerstörung aller Vorräte verlangt wird, auch von den Vereinigten Staaten produziert. Die Sowjetunion verfügte über eine chemisch sehr nahe verwandte Substanz (VR – oder auch „russisches VX“).
Anwendung/Einsatz
Es ist umstritten, ob Saddam Hussein 1988 beim Giftgasangriff auf Halabdscha im Nordirak VX gegen die kurdische Bevölkerung eingesetzt hat. Bei dem Angriff starben etwa 5000 Menschen, meist Kinder, Frauen und alte Männer, qualvoll. Viele tausend weitere starben danach oder erlitten dauerhafte Gesundheitsschäden.[21]
Am 13. Februar 2017 wurde Kim Jong-nam, der Halbbruder des nordkoreanischen Staatschefs Kim Jong-un und Sohn von Kim Jong-il, bei einem Attentat auf dem Flughafen von Kuala Lumpur mutmaßlich mit VX ermordet.[22] Laut Autopsiebericht wurden Rückstände dieses Nervenkampfstoffs bei ihm nachgewiesen, die binnen weniger Minuten zum Tode führten.[23] Auf dem T-Shirt einer der beiden Angeklagten wurden später von einem Gutachter ebenfalls Spuren von VX nachgewiesen.[24]
Analytik
Der sichere Nachweis von VX kann in unterschiedlichen Untersuchungsmaterialien wie Blutproben,[25][26][27] Urin[28] Bodenproben[29] oder Trinkwasser[30] nach angemessener Probenvorbereitung durch HPLC auch in Kopplung mit Massenspektrometrie erfolgen.
Nachweis über Phosphyl-Addukte mit endogenen Proteinen
Phosphororganische Cholinesterase-Hemmer (Phosphor- und Phosphonsäure-Derivate) bilden mit zahlreichen Proteinen kovalente Phosphyl Addukte (Phosphoryl- oder Phosphonyl-Addukte) über reaktive nukleophile Gruppen wie OH-Gruppen in den Seitenketten der Aminosäuren Serin (bei AChE und BChE) und Tyrosin (bei Albumin), sowie ferner NH2-Gruppen bei der Aminosäure Lysin (bei Ubiquitin, Albumin, Kreatin, Thubulin, Actin und Transferin). Diese Phosphyl-Addukte können als Biomarker zur Identifizierung der Cholinesterase-Hemmer herangezogen werden. Insbesondere betreffen dies Addukte mit BChE- und Albumin, für deren Nachweis mittlerweile gut optimierte Methoden existieren.[31][32][33][34][35][36][37]
Cholinesterasen
P-Ester können in Abhängigkeit der Stereochemie am Phosphor-Atom und der Struktur des Alkoxy-Restes (bei G-Stoffen) bzw. Dialkylaminoethanthiolat-Restes (bei V-Stoffen) unterschiedlich schnell mit den Cholinesterasen reagieren. Wegen der kleineren Acyl-Bindungstasche bei der Acetylcholinesterase ist die Stereoselektivität bei der Acetylcholinesterase ausgeprägter als bei der Butyrylcholinesterase. Auch die Alterung der Cholinesterase-Addukte ist abhängig von der Stereochemie am Phosphor-Atom. Außerdem kann das Vorhandensein beider Enantiomere die Stereoselektivität der Cholinesterasen verändern. Bei Einwirkung von razemischem (±)-VX reagiert vorrangig das VXR-(+)-Isomer mit der Butyrylcholinesterase, das BChE-VXR-(+)-Addukt altert langsam mit t1/2 = 77h. Bei Einwirkung der reinen Enantiomere ist die Stereoselektivität dagegen für das VXS-(−)-Isomer etwas höher, das BChE-VXS-(−)-Addukt altert mit t1/2 = 50h, während das BChE-VXR-(+)-Addukt keine Alterung zeigt.[38]
Butyrylcholinesterase-(BChE)-Phosphyl-Biomarker
Butyrylcholinesterase-Phosphyl-Biomarker wurden zur Identifizierung von Nervenkampfstoffen bisher am intensivsten untersucht und zahlreiche optimierte Methoden in der wissenschaftlichen Literatur publiziert. Die Butyrylcholinesterase kommt im Vergleich zur Acetylcholinesterase im Blut in deutlich höheren Konzentrationen vor und ist leichter zu isolieren. Die Konzentration der BChE liegt bei ca. 3-5 mg/L Plasma oder Serum. Die Halbwertszeit der BChE (bzw. BChE-Phosphyl-Addukte) liegt bei 6-10 d, so dass eine Identifizierung der BChE-Phosphyl-Biomarker mindestens 16 Tage nach einer Intoxikation noch möglich ist. Trotz der (im Vergleich zu Albumin) sehr geringen Konzentration im Blut werden BChE-Biomarker häufiger verwendet, da die BChE mit Nervenkampfstoffen etwa 500 Mal schneller reagiert als Albumin. Dadurch ist die Identifizierung von Cholinesterase-Hemmern auch nach Einwirkung sehr geringer Mengen möglich. Problematisch ist eine vorherige Oximtherapie bei Vergiftungsopfern, weil durch diese Behandlung der Phosphyl-Rest wieder vom Enzym verdrängt wird (bei Albumin ist das nicht der Fall). Ein signifikanter Nachteil gegenüber den Albumin-Biomarkern ist außerdem die sogenannte Alterung des gebundenen Phosphyl-Restes, bei der es (auch enzymkatalysiert) zu einer Abspaltung des RO-Restes und damit zum Verlust struktureller Information kommt. Nach Alterung ist eine Identifizierung des ursprünglichen Cholinesterase-Hemmers [bis auf eine Eingrenzung der Substanzklasse (beispielsweise Methanphosphonsäure-Derivate; der Methanphosphonyl-Rest ist typisch für Nervenkampfstoffe)] nicht mehr möglich. Zur Identifizierung der Cholinesterase-Hemmer wird die BChE zunächst aus Plasma/Serum isoliert. Dafür existieren mittlerweile diverse gut optimierte Methoden. Nach Isolierung der BChE wird diese mit Pepsin proteolytisch gespalten, wodurch kleinere Peptid-Fragmente entstehen. In der BChE binden die Cholinesterase-Hemmer am Serin-198 (aktives Zentrum des Enzyms). Nach Proteolyse mit Pepsin ist das phosphylierte Serin immer in dem gebildeten Nonapeptid FGES198[Phosphyl]AGAAS vorhanden. Man erhält exemplarisch auf diese Weise folgende Nonapeptide:
- bei Intoxikation mit VX: FGES198[MeP(O)(OC2H5)-]AGAAS
- bei Intoxikation mit RVX: FGES198[MeP(O){OCH2CH(CH3)2}-]AGAAS
- bei Intoxikation mit CVX: FGES198[MeP(O){O-n-C4H9}-]AGAAS
- bei Intoxikation mit Sarin: FGES198[MeP(O){OCH(CH3)2}-]AGAAS
- bei Intoxikation mit Soman: FGES198[MeP(O){OCH(CH3)C(CH3)3}-]AGAAS
Nach Alterung (Abspaltung des Alkoxy-Restes) liegt in allen Fällen das Nonapeptid FGES198[MeP(O)(OH)-]AGAAS vor. Die Alterung erfolgt beim Soman innerhalb von 1-2 min, bei Sarin, Cyclosarin und vor allem VX auch deutlich langsamer im Zeitraum von mehreren Stunden bis Tagen. Das jeweilige phosphylierte Nonapeptid wird über LC/MS/MS-Kopplung bestimmt. Mit gut optimierten Methoden ist eine Extraktion und Spaltung der BChE im Zeitraum von ca. 40 min möglich. Mit dem oben beschrieben Verfahren kann nur die Struktur des Phosphyl-Restes, nicht aber die der Abgangsgruppe (Cyanid bei Tabun und Analoga, Fluorid bei Sarin, Soman, Cyclosarin und Analoga, bzw. Dialkylaminoalkylthiolat bei V-Stoffen) ermittelt werden, so dass eine zweifelsfreie Identifizierung des ursprünglichen Nervenkampfstoffs nicht gegeben ist. Werden allerdings ein O-Isopropyl-methanphosphonyl-, O-Pinacolyl-methanphosphonyl- oder O-Cyclohexyl-methanphosphonyl-Rest identifiziert, kann mit relativ hoher Wahrscheinlichkeit von einer Vergiftung durch Sarin, Soman oder Cyclosarin ausgegangen werden, da diese Alkoxy-Reste bei militärisch relevanten V-Stoffen eher untypisch sind. Ein O-Ethyl-methanphosphonyl-Rest deutet zwar eher auf eine Vergiftung mit V-Stoffen (insbesondere VX) hin, allerdings würde man das gleiche Fragment auch bei einer Vergiftung durch Ethylsarin (O-Ethyl-Sarin, Methanphosphonsäureethylesterfluorid) identifizieren. Werden an Stelle von Pepsin zur Proteolyse der BChE andere Enzyme verwendet, erhält man andere Peptidfragmente:[39]
- bei Spaltung mit Chymotrypsin: GES[Phosphyl]AGAASVSL (Dodecapeptid)
- bei Spaltung mit Trypsin: SVTLFGES[Phosphyl]AGAASVSLHLLSPGSHSLFTR (29-Peptid)
Acetylcholinesterase-(AChE)-Phosphyl-Biomarker
Bei der hAChE binden die Nervenkampfstoffe am aktiven Zentrum Ser-203 (bei Torpedo californica TcAChE: Ser-200). Zur Identifizierung der Biomarker wird die AChE im ersten Schritt isoliert. Nach Isolierung der AChE ist die Verfahrensweise analog zur BChE. Nach Proteolyse mit Pepsin wird das gleiche Nonapeptid FGES203[Phosphyl]AGAAS erhalten. AChE-Biomarker eignen sich zur Identifizierung von Cholinesterase-Hemmern allerdings weniger, da die Konzentration der AChE mit etwa <0,01 mg/L Plasma und 0,5 mg/L in den Membranen der Erythrozyten deutlich geringer ist und die in den Erythrozyten enthaltene AChE deutlich schwieriger zu isolieren ist.
Albumin-Phosphyl-Biomarker
Auch Albumin-Addukte wurden als Biomarker zum Nachweis von Nervenkampfstoffen untersucht.[40][41]
Die Konzentration von Albumin im Blut liegt bei 40 g/L (HZ 20d). Die deutlich höhere Konzentration ist im Vergleich zur BChE ein Vorteil. Des Weiteren altern die an Albumin gebundenen Phosphyl-Reste nicht und werden auch durch eine Oxim-Antidot-Therapie nicht verdrängt. Nachteil ist allerdings die im Vergleich zur BChE etwa 500-mal geringere Reaktivität, womit eine Bestimmung bei einer Intoxikation mit sehr geringen Mengen eines Cholinesterase-Hemmers problematisch, bzw. unmöglich wird. Selbst bei lethalen Konzentrationen eines Cholinesterase-Hemmers, die 95 % der BChE im Plasma blockieren, wird weniger als 1 % des Albumins phosphyliert.[36] Die Phosphylierung von Albumin erfolgt an verschiedenen Tyrosin-Resten, wobei Tyrosin-411 am reaktivsten ist. Zur Identifizierung eines Cholinesterase-Hemmers wird das Albumin isoliert, proteolytisch gespalten und die gebildeten phosphylierten Fragmente durch LC/MS/MS analysiert. Durch Spaltung mit Pronase wird immer ein Phosphyl-Tyrosin-411 erhalten. Exemplarisch erhält man
- bei VX: MeP(O)(OC2H5)-Tyr411
- bei Sarin: MeP(O){OCH(CH3)2}-Tyr411
- bei Soman: MeP(O){OCH(CH3)C(CH3)3}-Tyr411
Werden zur Proteolyse andere Enzyme verwendet, erhält man andere Peptid-Fragmente. Trypsin führt zur Bildung des phosphylierten Tripeptids Y[Phosphyl]TK. Spaltung mit Pepsin führt zum Hexadecapeptid LVRY[Phosphyl]TKKVPQVSTPTL. Bei der Identifizierung von Nervenkampfstoffen über Albumin-Phosphyl-Biomarker gilt das gleiche wie bei den BChE-Biomarkern: Es kann nur der Phosphyl-Rest, nicht aber die Abgangsgruppe des ursprünglichen Cholinesterase-Hemmers bestimmt werden.
Albumin-Biomarker für die Dialkylaminoethylthiolat-Seitenkette von V-Stoffen
Neben den Biomarkern für den Phosphyl-Rest von Nervenkampfstoffen wurden auch Biomarker für die Dialkylaminoalkylthiolat-Abgangsgruppe der V-Stoffe gefunden.[42]
Während die Fluorid-Abgangsgruppe bei Sarin, Cyclosarin, Soman und Strukturanaloga und auch die Cyanid-Abgangsgruppe bei Tabun und Analoga nicht identifiziert werden kann, bildet die Thiolat-Abgangsgruppe der V-Stoffe mit cysteinhaltigen Proteinen ebenfalls Addukte. Die Dialkylaminoethylthiolat-Seitenketten der V-Stoffe werden im Albumin über Disulfid-Brücken an Cystein-Resten (Cys-34, Cys-448 und Cys-514) gebunden. Nach Spaltung mit Pronase erhält man kleinere Peptide, welche über LC/MS/MS-Kopplung identifiziert werden. Bei VX sind das:
- (iPr)2N-CH2CH2-S-S-Cys34Pro
- (iPr)2N-CH2CH2-S-S-Cys448ProMet
- (iPr)2N-CH2CH2-S-S-Cys514IleAsp
Erst durch Identifizierung der Phosphyl-Gruppe in Phosphyl-Biomarkern zusammen mit Biomarkern der Thiolat-Seitenkette von V-Stoffen ist der eindeutige Nachweis für einen V-Kampfstoff erbracht.
Weblinks
- Labor Spiez: Datenblatt VX (PDF; 194 kB)
- Saskia Eckert: Entwicklung eines dynamischen Modells zum Studium der Schutzeffekte reversibler Acetylcholinesterase-Hemmstoffe vor der irreversiblen Hemmung durch hochtoxische Organophosphate. München 2006, DNB 982657064, urn:nbn:de:bvb:19-61966 (Dissertation).
Einzelnachweise
- D. H. Ellison: Handbook of Chemical and Biological Warfare Agents. 2. Auflage. CRC Press, 2007, ISBN 978-0-8493-1434-6, S. 27.
- Eintrag zu VX. In: Römpp Online. Georg Thieme Verlag, abgerufen am 25. Dezember 2014.
- Eintrag zu VX in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM)
- Günter Hommel: Handbuch der gefährlichen Güter. Band 6, Springer, Berlin/ Heidelberg 2012, ISBN 978-3-642-25051-4, S. 2286.
- Neurotoxicology. Vol. 7, 1986, S. 225.
- Appendix D: Health Risk Assessment for the Nerve Agent Vx. In: Journal of Toxicology and Environmental Health, Part A. Band 59, Nr. 5–6, 2000, S. 439–469, doi:10.1080/713852146.
- J. S. Wiles, T. B. Alexander: Comparative toxicity of VX applied to the unclipped and clipped skin of bare and clothed rabbits. AD839329. US Army Chemical Research and Development Laboratories, Aberdeen Proving Ground, MD 1960.
- Externe Identifikatoren von bzw. Datenbank-Links zu O-Ethyl-O-2-diisopropylaminoethylmethyl-phosphonit: CAS-Nummer: 57856-11-8, PubChem: 170325, ChemSpider: 148925, Wikidata: Q3491298.
- Steven L. Hoenig: Compendium of Chemical Warfare Agents. Springer Science & Business Media, New York 2006, ISBN 0-387-69260-6, S. 162 (eingeschränkte Vorschau in der Google-Buchsuche).
- H. P. Benschop, L. P. A. De Jong: Nerve agent stereoisomers: analysis, isolation and toxicology. In: Acc. Chem. Res. Band 21, Nr. 10, 1988, S. 368–374, doi:10.1021/ar00154a003.
- William S. Augerson: Chemical and Biological Warfare Agents (= Gulf War illnesses series. Band 5). Rand, Santa Monica, CA 2000, ISBN 978-0-8330-2680-4, S. 201 (health.mil [PDF]).
- David J. McGarvey, William R. Creasy, Jill L. Ruth, Kevin M. Morrissey, John R. Stuff: Chemical Analysis and Reaction Kinetics of EA-2192 in Decontamination Solution for the MMD-1 Project. ADA416809. Mai 2003 (dtic.mil [PDF]).
- Brooke G. Pantazides, Caroline M. Watson, Melissa D. Carter, Brian S. Crow, Jonas W. Perez, Thomas A. Blake, Jerry D. Thomas, Rudolph C. Johnson: An enhanced butyrylcholinesterase method to measure organophosphorus nerve agent exposure in humans. In: Anal. Bioanal. Chem., 2014, 406, S. 5187-5194
- Frederick R. Sidell, William A. Groff: The reactivatibility of cholinesterase inhibited by VX and sarin in man. In: Toxicology and Applied Pharmacology. Band 27, Nr. 2, 1974, S. 241–252, doi:10.1016/0041-008X(74)90195-1.
- Twenty-third report (= Technical report series. Band 23, Nr. 463). World Health Organization, Geneva, Switzerland 1970, OCLC 56103048, S. 24 (who.int [PDF]).
- Timothy C. Marrs, Robert L. Maynard, Frederick R. Sidell: Chemical Warefare Agents - Toxicology and Treatment. John Wiley & Sons, Chichester 1998, ISBN 0-471-95994-4, S. 243.
- Klaus Aktories, Ulrich Förstermann, Franz Hofmann, Klaus Starke (Hrsg.): Allgemeine und spezielle Pharmakologie und Toxikologie. 11., überarb. Auflage. Elsevier, Urban & Fischer, München 2013, ISBN 978-3-437-42523-3, S. 1058.
- Eric Croddy, James J. Wirtz (Hrsg.): Weapons of mass destruction: an encyclopedia of worldwide policy, technology and history. Band 2, ISBN 1-85109-490-3, S. 313. (Eingeschränkte Vorschau in der Google-Buchsuche)
- Nerve Agents – Lethal organo-phosphorus compounds inhibiting cholinesterase. In: Organisation for the Prohibition of Chemical Weapons website. Abgerufen am 7. Oktober 2006.
- Nerve Agents: General. (Nicht mehr online verfügbar.) In: The site for information about chemical and biological weapons for emergency, safety and security personnel. Archiviert vom Original am 12. Oktober 2006; abgerufen am 7. Oktober 2006.
- Stephen C. Pelletiere: A War Crime Or an Act of War? In: New York Times. 31. Januar 2003.
- Ermittler finden Nervengift an Kim Jong Nams Leiche. Spiegel Online; abgerufen am 24. Februar 2017.
- Fabian Kretschmer: Der qualvolle Tod des Kim Jong-nam durch Nervengas VX. In: Der Standard. 24. Februar 2017.
- Mordfall Kim Jong Nam: Nervengas auf T-Shirt von Angeklagter entdeckt. In: Spiegel Online. 5. Oktober 2017, abgerufen am 5. Oktober 2017.
- S. J. Stubbs, R. W. Read: Liquid chromatography tandem mass spectrometry applied to quantitation of the organophosphorus nerve agent VX in microdialysates from blood probes. In: J Chromatogr B Analyt Technol Biomed Life Sci. 878(17-18), 15. Mai 2010, S. 1253–1256. PMID 20034857
- G. Reiter, J. Mikler, I. Hill, K. Weatherby, H. Thiermann, F. Worek: Simultaneous quantification of VX and its toxic metabolite in blood and plasma samples and its application for in vivo and in vitro toxicological studies. In: J Chromatogr B Analyt Technol Biomed Life Sci., 879(26), 15. Sep 2011, S. 2704–2713. PMID 21862421
- B. S. Crow, B. G. Pantazides, J. Quiñones-González, J. W. Garton, M. D. Carter, J. W. Perez, C. M. Watson, D. J. Tomcik, M. D. Crenshaw, B. N. Brewer, J. R. Riches, S. J. Stubbs, R. W. Read, R. A. Evans, J. D. Thomas, T. A. Blake, R. C. Johnson: Simultaneous measurement of tabun, sarin, soman, cyclosarin, VR, VX, and VM adducts to tyrosine in blood products by isotope dilution UHPLC-MS/MS. In: Anal Chem., 86(20), 21. Okt 2014, S. 10397–10405. PMID 25286390
- J. R. Barr, W. J. Driskell, L. S. Aston, R. A. Martinez: Quantitation of metabolites of the nerve agents sarin, soman, cyclohexylsarin, VX, and Russian VX in human urine using isotope-dilution gas chromatography-tandem mass spectrometry. In: J Anal Toxicol., 28(5), Jul-Aug 2004, S. 372–378. PMID 15239858
- M. R. Gravett, F. B. Hopkins, A. J. Self, A. J. Webb, C. M. Timperley, J. R. Riches: Fate of the chemical warfare agent O-ethyl S-2-diisopropylaminoethyl methylphosphonothiolate (VX) on soil following accelerant-based fire and liquid decontamination. In: Anal Bioanal Chem., 406(21), Aug 2014, S. 5121–5135. PMID 24972874
- J. S. Knaack, Y. Zhou, M. Magnuson, E. Silvestri, R. C. Johnson: Performance of a novel high throughput method for the determination of VX in drinking water samples. In: Anal Chem., 85(5), 5. Mar 2013, S. 2611–2616. PMID 23402290
- Harald John, Horst Thiermann: Poisoning by organophosphorus nerve agents and pesticides: An overview of the principle strategies and current progress of mass spectrometry-based procedures for verification. In: Journal of Mass Spectrometry and Advances in the Clinical Lab 2021, 19, 20-31
- Robin M. Black, Robert W. Read: Biological markers of exposure to organophosphorus nerve agents. In: Arch. Toxikol. 2013, 87, 421-437
- Maud Bonichon, Valentina Valbi, Audrey Combès, Charlotte Desoubries, Anne Bossée, Valérie Pichon: Online coupling of immunoextraction, digestion, and microliquid chromatography-tandem mass spectrometry for the analysis of sarin and soman-butyrylcholinesterase adducts in human plasma. In: Anal. Bioanal. Chem., 2018, 410, S. 1039-1051
- Harald John, Felicitas Breyer, Christian Schmidt, Boris Mizaikoff, Franz Worek, Horst Thiermann: Small-scale purification of butyrylcholinesterase from human plasma and implementation of a μLC-UV/ESI MS/MS method to detect its organophosphorus adducts. In: Drug Test. Analysis, 2015, 7(10), S. 947-956
- Thomas P. Mathews, Melissa D. Carter, Darryl Johnson, Samantha L. Isenberg, Leigh Ann Graham, Jerry D. Thomas, and Rudolph C. Johnson: High-Confidence Qualitative Identification of Organophosphorus Nerve Agent Adducts to Human Butyrylcholinesterase. In: Anal. Chem., 2017, 89, S. 1955–1964
- Yaroslav Dubrovskii, Ekaterina Murashko, Olga Chuprina, Petr Beltyukov, Andrey Radilov, Nikolay Solovyev, Vladimir Babakov: Mass spectrometry based proteomic approach for the screening of butyrylcholinesterase adduct formation with organophosphates. In: Talanta, 2019, 197, S. 374–382
- Patrick Masson, Eugénie Carletti, Florian Nachon: Structure, Activities and Biomedical Applications of Human Butyrylcholinesterase. In: Protein Peptide Letters, 2009, 16(10), S. 1215–1524
- Marielle Wandhammer, Eugenie Carletti, Marcel Van der Schans, Emilie Gillon, Yvain Nicolet, Patrick Masson, Maurice Goeldner, Daan Noort, Florian Nachon: Structural Study of the Complex Stereoselectivity of Human Butyrylcholinesterase for the Neurotoxic V-agents. In: J. Biol. Chem., 2011, 286, S. 16783-16789
- Uma K. Aryal, Chiann-Tso Lin, Jong-Seo Kim, Tyler H. Heibeck, Jun Wang, Wei-Jun Qian, Yuehe Lin: Identification of phosphorylated butyrylcholinesterase in human plasma using immunoaffinity purification and mass spectrometry. In: Analytica Chimica Acta. Band 723, 20. April 2012, S. 68–75, doi:10.1016/j.aca.2012.02.023 (englisch).
- Nichola H. Williams, John M. Harrison, Robert W. Read, Robin M. Black: Phosphylated tyrosine in albumin as a biomarker of exposure to organophosphorus nerve agents. In: Arch. Toxicol., 2007, 81, S. 627–639
- Robert W. Read, James R. Riches, Jacqueline A. Stevens, Sarah J. Stubbs, Robin M. Black: Biomarkers of organophosphorus nerve agent exposure: comparison of phosphylated butyrylcholinesterase and phosphylated albumin after oxime therapy. In: Arch. Toxicol., 2010, 84, S. 25–36
- Andreas Kranawetvogl, Jim Küppers, Markus Siegert, Michael Gütschow, Franz Worek, Horst Thiermann, Paul W. Elsinghorst, Harald John: Bioanalytical verification of V-type nerve agent exposure: simultaneous detection of phosphonylated tyrosines and cysteine-containing disulfide-adducts derived from human albumin. In: Analytical and Bioanalytical Chemistry, 2018, 410, S. 1463-1474
