Acetylcholinesterase
Die Acetylcholinesterase (AChE) ist ein Enzym aus der Gruppe der Cholinesterasen, welches spezifisch den Neurotransmitter Acetylcholin (ACh) in Essigsäure und Cholin hydrolysiert.
| Acetylcholinesterase | ||
|---|---|---|
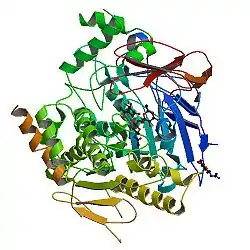
| ||
| Bändermodell des Monomers der AChE vom Menschen im Komplex mit Fasciculin (ein Schlangentoxin), nach PDB 1B41 | ||
|
Vorhandene Strukturdaten: 1b41, 1f8u, 1vzj, 1PUV, 1PUW, 2CLJ, 2X8B, 3LII 4BDT, 4EY4, 4EY5, 4EY6, 4EY7, 4EY8, 4M0E, 4M0F, 4PQE | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 58,4 bis 67,4 Kilodalton / 526 bis 617 Aminosäuren (je nach Isoform) | |
| Sekundär- bis Quartärstruktur | Homotetramer | |
| Isoformen | 4 | |
| Bezeichner | ||
| Gen-Namen | AChE ; ARAChE; N-AChE; YT | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 3.1.1.7, Esterase | |
| Reaktionsart | Hydrolyse | |
| Substrat | Acetylcholin + H2O | |
| Produkte | Cholin + Acetat | |
| Vorkommen | ||
| Homologie-Familie | Carboxylesterase | |
| Übergeordnetes Taxon | Chordatiere | |
| Orthologe | ||
| Mensch | Hausmaus | |
| Entrez | 43 | 11423 |
| Ensembl | ENSG00000087085 | ENSMUSG00000023328 |
| UniProt | P22303 | P21836 |
| Refseq (mRNA) | NM_000665 | NM_001290010 |
| Refseq (Protein) | NP_000656 | NP_001276939 |
| Genlocus | Chr 7: 100.89 – 100.9 Mb | Chr 5: 137.29 – 137.29 Mb |
| PubMed-Suche | 43 | 11423 |
Wirkung
Die AChE wirkt vor allem im Zentralnervensystem (ZNS), an neuromuskulären Synapsen (wie der motorischen Endplatte) sowie im vegetativen Nervensystem, da hier bevorzugt ACh als Neurotransmitter zur Exozytose verwendet wird. Die Acetylcholinesterase ist eines der schnellsten Enzyme überhaupt (diffusionskontrolliert, siehe Enzymkinetik und Diffusion). Die große Geschwindigkeit ist erforderlich, um den Zeitabstand der von den Neuronen übertragenen Erregungen durch sofortigen Abbau des Neurotransmitters so kurz wie möglich zu halten.
Struktur des aktiven Zentrums des Enzyms
Das Aktive Zentrum liegt in einer 20 Ångström (2 Nanometer) tiefen Tasche im Enzym (im Englischen auch als gorge, also Schlucht, bezeichnet) und besteht aus einer katalytischen Triade (Teil der esteratischen Stelle ES), bestehend aus den Aminosäuren Serin, Histidin und Glutaminsäure, an der die Spaltung des Acetylcholins stattfindet, und an der gegenüberliegenden Seite (in etwas über 4 Ångström (0,4 nm) Abstand), einer anionischen Stelle (AS), an der das Stickstoffatom des Acetylcholins anbindet. In der Nähe der ES gibt es weitere Bindungsstellen, wie einer Tasche für die Acylgruppe des Acetylcholins.[1] Die Bezeichnungen stammen noch aus der Zeit vor der genauen dreidimensionalen Strukturbestimmung des Enzyms: ES (esteratic site) mit dem aktiven Zentrum, anionischer Stelle AS (anionic site) und außerhalb der tiefen Tasche an deren äußerem Rand die periphere anionische Stelle (PAS),[2] die für die Bindung einer Reihe von AChE-Hemmern von Bedeutung ist (wie dem Schlangengift Fasciculin) und für allosterische Modulation der Enzymfunktion.
Cholinesteraseinhibitoren
Hemmstoffe der Cholinesterase erhöhen die Konzentration von Acetylcholin sowohl an der motorischen Endplatte von Muskelzellen als auch im parasympathischen Nervensystem. Ihre Anwendung ist in der Medizin weit verbreitet.
- Neostigmin wird oftmals am Ende einer Narkose verabreicht um die Wirkung von Muskelrelaxanzien aufzuheben. Dazu wird es mit Atropin kombiniert um gezielt nur auf Muskelzellen zu wirken.
- Das länger wirksame Pyridostigmin wird in Form des nicht ZNS-gängigen Salzes Pyridostigminiumbromid bei Myasthenia gravis angewandt.
- Physostigmin ist im Gegensatz zu Neostigmin ZNS-gängig und dient zur Therapie bei zentral anticholinergem Syndrom.
- Donepezil, Rivastigmin, Tacrin und Galantamin, die für die symptomatische Behandlung der Alzheimer-Krankheit zugelassen sind, sind Cholinesteraseinhibitoren.
Laut einer schwedischen Studie wirken Donepezil, Rivastigmin und Galantamin auch kardioprotektiv. Patienten, welche diese Medikamente gegen ihre Alzheimer-Krankheit einnahmen, erlitten zu einem Drittel weniger einen Herzinfarkt. Auch die Mortalität war in dieser Gruppe geringer.[3] Darüber hinaus hemmen möglicherweise manche Bestandteile von Harpagophytum procumbens (Teufelskralle) die Cholinesterasen, darunter auch die Acetylcholinesterase.[4]
Eine weitere Anwendung von Cholinesterasehemmstoffen sind Insektizide, wie
und chemische Kampfstoffe wie
- Sarin, Tabun, Soman, VX und Nowitschok.
Die Acetylcholinesterase wird unter anderem durch Organophosphorsäureester durch Phosphorylierung des Serins gehemmt. Das Enzym wird unwirksam, kann also das ACh nicht mehr hydrolysieren, und ACh wird im synaptischen Spalt in höherer Konzentration angereichert. Die Erhöhung des Parasympathikotonus führt zur motorischen und sensitiven Überstimulation innerer Organe, insbesondere zu Krämpfen des Magen-Darm-Traktes, und kann Tod durch Atemlähmung zur Folge haben. Analog wirken verschiedene als Insektizide eingesetzte Carbamate, die ihre Carbamatgruppe auf das Serin übertragen und das Enzym so deaktivieren. Weitere AChE-Hemmstoffe sind z. B. Diisopropylfluorphosphat (DIFP), 4-Chlormercuribenzoesäure und Huperzin A.
Eine Reihe von Nervenkampfstoffen vom Typ organischer Phosphorsäureester wie Sarin, VX und Nowitschok wirken als besonders effiziente AChE-Hemmer, bei denen sich die Moleküle in die tiefe Tasche des Enzyms selbst einpassen mit Mimese der Bindung des Acetylcholins an ES und AS selbst. Die Aminogruppe von VX und Nowitschok bindet dabei an die AS, die Phosphorsäureestergruppe an die ES. Die Kampfstoffe phosphorylieren das Serin im aktiven Zentrum und bilden mit ihm eine kovalente Bindung. In einer für den jeweiligen Nervenkampfstoff spezifischen Weise folgt ein mehr oder weniger schnell einsetzender Alterung genannter Prozess, der zu irreversiblem Funktionsverlust des Enzyms führt.[5] Der sich bei der Alterung durch Dealkylierung an der Phosphorgruppe ausbildende Komplex mit Konformationsänderung ist dann widerstandsfähig gegen spontane Hydrolyse und die als Gegenmittel verabreichten starken Nukleophile (Oxime).
Sonstige Verwendung
Acetylcholinesterase wird auch in Geräten zur Trinkwasserkontrolle beziehungsweise zur Untersuchung von Proben auf Insektizide oder andere acetylcholinesterasehemmende Giftstoffe verwendet.
Siehe auch
Literatur
- Hay Dvir, Israel Silman, Michal Harel, Terrone Rosenberry, Joel Sussman: Acetylcholinesterase: From 3D Structure to Function. In: Chem. Biol. Interact., Band 187, 2010, S. 10–22, PMC 2894301 (freier Volltext)
Weblinks
- Acetylcholinesterase. Proteopedia; mit manipulierbaren 3D-Modellen (englisch)
Einzelnachweise
- Hay Dvir, Israel Silman, Michal Harel, Terrone Rosenberry, Joel Sussman: Acetylcholinesterase: From 3D Structure to Function. In: Chem. Biol. Interact., Band 187, 2010, S. 10–22, Figure 7,8, PMC 2894301 (freier Volltext).
- Siehe Figur 2 in Dvir u. a.: Acetylcholinesterase. In: Chem. Biol. Interact., Band 187, 2010.
- P. Nordstrom, D. Religa, A. Wimo, B. Winblad, M. Eriksdotter: The use of cholinesterase inhibitors and the risk of myocardial infarction and death: a nationwide cohort study in subjects with Alzheimer’s disease. In: European Heart Journal. 34, 2013, S. 2585–2591. doi:10.1093/eurheartj/eht182
- M. I. Georgiev, K. Alipieva, I. E. Orhan: Cholinesterases inhibitory and antioxidant activities of Harpagophytum procumbens from in vitro systems. In: Phytother. Res. Februar 2012, S. 313–316, doi:10.1002/ptr.3555, PMID 21721061.
- Horst Thiermann, Nadine Aurbek, Franz Worek: Treatment of Nerve Agent Poisoning. In: Franz Worek, John Jenner, Horst Thiermann (Hrsg.): Chemical Warfare Toxicology. Royal Society of Chemistry, Band 2, 2016, S. 4.