Propionaldehyd
Propionaldehyd (nach IUPAC-Nomenklatur: Propanal, gelegentlich auch als Propylaldehyd bezeichnet) ist eine organisch-chemische Verbindung aus der Stoffgruppe der Aldehyde. Es ist ein wichtiges Grund- und Zwischenprodukt der Chemischen Industrie, welches breite Anwendung findet.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
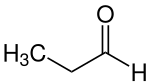 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Propionaldehyd | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C3H6O | ||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit stechendem Geruch[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 58,08 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[2] | ||||||||||||||||||
| Dichte |
0,81 g·cm−3[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
49 °C[2] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Brechungsindex |
1,3650[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
−215,6 kJ/mol[5] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Gewinnung und Darstellung
Propanal kann durch Hydroformylierung von Ethen hergestellt werden.[6]
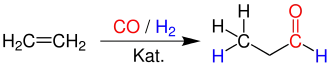
Die Oxidation von n-Propanol mit Kaliumdichromat und Schwefelsäure führt ebenfalls zu Propanal.[7] Als Oxidationsmittel kann auch Luftsauerstoff in Gegenwart der Katalysatoren Kupfer[8] oder Platin[9] eingesetzt werden.
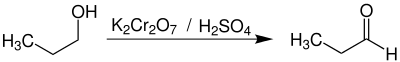
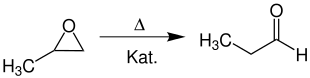
Auch durch Isomerisierung von Propylenoxid bei 300 °C über Silicagel kann Propanal synthetisiert werden:[7]
Eine weitere Synthesemöglichkeit ist die katalytische Hydrierung von Acrolein:[10]

Schließlich ist auch durch eine Grignard-Reaktion von Ethylmagnesiumbromid mit Ameisensäureethylester die Synthese von Propanal möglich.[7]

Eigenschaften
Physikalische Eigenschaften
Propanal ist eine leicht flüchtige, farblose Flüssigkeit mit stechendem Geruch. Sie siedet bei Normaldruck bei 49 °C.[2] Die molare Verdampfungsenthalpie beträgt am Siedepunkt 28,3 kJ·mol−1.[11] Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in Torr, T in °C) mit A = 7,26342, B = 1277,1176 und C = 242,556 im Temperaturbereich von −38,65 bis 231,25 °C.[12] Sie besitzt bei 20 °C eine dynamische Viskosität von 0,375 mPa·s.[2]
| Eigenschaft | Typ | Wert [Einheit] | Bemerkungen |
|---|---|---|---|
| Standardbildungsenthalpie | ΔfH0liquid ΔfH0gas |
−218,3 kJ·mol−1[13] −188,7 kJ·mol−1[13] |
|
| Standardentropie | S0l S0g |
212,9 J·mol−1·K−1[14] 304,4 J·mol−1·K−1[15] |
als Flüssigkeit als Gas |
| Verbrennungsenthalpie | ΔcH0liquid | −1816,5 kJ·mol−1[16] | |
| Wärmekapazität | cp | 159,1 J·mol−1·K−1 (25 °C)[14] 80,73 J·mol−1·K−1 (25 °C)[17] |
als Flüssigkeit als Gas |
| Kritische Temperatur | Tc | 504,4 K[18] | |
| Kritischer Druck | pc | 52,6 bar[18] | |
| Kritische Dichte | ρc | 4,91 mol·l−1[19] | |
| Schmelzenthalpie | ΔfH | 8,59 kJ·mol−1[14] | beim Schmelzpunkt |
| Verdampfungsenthalpie | ΔVH0 | 29,96 kJ·mol−1[20] |
Chemische Eigenschaften
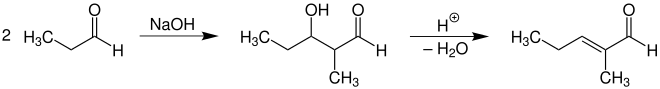
Die Aldoladdition von zwei Molekülen Propanal liefert 2-Methyl-3-hydroxypentanal, das unter Wasserabspaltung im Rahmen der Aldolkondensation zu 2-Methyl-2-pentenal weiterreagieren kann. Diese β-Dehydratisierung läuft insbesondere unter Säurekatalyse sowie Erhitzen ab.
Verwendung
Propionaldehyd ist ein wichtiges Vor- und Zwischenprodukt in der industriellen organischen Chemie. Es dient vorwiegend zur Herstellung von Kunststoffen, Weichmachern, Kautschuk-Hilfsprodukten, Vulkanisationsbeschleunigern, Phenolharzen, Demulgiermitteln, Aroma- und Duftstoffen, Agrochemikalien, Schädlingsbekämpfungs- und Arzneimitteln. Technisch werden aus Propionaldehyd zahlreiche Produkte synthetisiert. Darunter zählen vor allem 1-Propanol, 1-Propylamin, Propionsäure, Trimethylolethan, Methacrolein und Propionitril. Außerdem wird Propionaldehyd mit Acetaldehyd zu Copolymeren umgesetzt. Ferner ist Propionaldehyd ist ein wichtiger Ausgangsstoff zur Produktion von Alkylpyridinen, Imidazolen, 3-Methylindol und anderen Heterocyclen. In der organischen Synthesechemie findet Propionaldehyd bei Acetalisierungen, Iminbildungen, Olefinierungen, metallorganischen sowie Aldolreaktionen Verwendung.[3]
Nachweis
Propanal reagiert mit dem Indikator Schiffsches Reagenz. Das Reagenz wird durch diesen Aldehyd rosa bis violett gefärbt.
Sicherheitshinweise
Die Dämpfe von Propionaldehyd bilden mit Luft explosive Gemische. Auch bei der Verteilung auf großen Oberflächen kann Selbstentzündung eintreten. Hauptsächlich wird Propanal über den Atemtrakt und die Haut aufgenommen. Des Weiteren wurde eine Resorption über den Verdauungstrakt belegt. Bei Aufnahme oder Exposition kann es akut zu Reizwirkungen auf Augen, Atemwege und Haut kommen.[2] Beim längeren Einatmen ist eine narkotisierende Wirkung möglich. Chronisch können Leber- und Nierenschäden auftreten.[3] Zur Reproduktionstoxizität und Kanzerogenität liegen keine ausreichenden Angaben vor, jedoch wurde in einigen Tests eine gewisse mutagene Wirkung ermittelt, welche jedoch uneinheitlich ist und daher kontrovers diskutiert wird. Propionaldehyd weist eine untere Explosionsgrenze (UEG) von 2,3 Vol.-% (55 g/m3) und eine obere Explosionsgrenze (OEG) von 21,0 Vol.-% (510 g/m3) auf. Die Zündtemperatur beträgt 190 °C. Der Stoff fällt somit in die Temperaturklasse T4 und in die Explosionsgruppe IIB. Die Grenzspaltweite wurde mit 0,84 mm bestimmt. Mit einem Flammpunkt von −40 °C gilt Propionaldehyd als sehr leicht entflammbar.[2]
Weblinks
Einzelnachweise
- Eintrag zu PROPIONALDEHYDE in der CosIng-Datenbank der EU-Kommission, abgerufen am 30. Dezember 2021.
- Eintrag zu Propionaldehyd in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- Eintrag zu Propionaldehyd. In: Römpp Online. Georg Thieme Verlag, abgerufen am 19. April 2019.
- Eintrag zu Propionaldehyde im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 19. April 2019. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-24.
- J. D. Unruh, D. Pearson: n-Propyl Alcohol. In: Kirk-Othmer Encyclopedia of Chemical Technology. doi:10.1002/0471238961.1618151621141821.a01.
- C. D. Hurd, R. N. Meinert: Propionaldehyde In: Organic Syntheses. 12, 1932, S. 64, doi:10.15227/orgsyn.012.0064; Coll. Vol. 2, 1943, S. 541 (PDF).
- P. Sabatier, J.-B. Sanderens: Dédoublement catalytique des alcools par les métaux divisés: alcools primaires forméniques. In: Compt. Rend. Hebd. 136, 1903, S. 921ff. (Volltext)
- A. Trillat: Étude de l'oxydation catalytique des alcools (cas de la spirale de platine). In: Bull. Soc. Chim. 3, 29, 1903, S. 35ff. (Volltext)
- P. Sabatier, J.-B. Senderens: Nouvelles méthodes générales d'hydrogénation. In: Ann. phys. chim. 8, 4, 1905, S. 398. (Volltext)
- J. F. Counsell, D. A. Lee: Thermodynamic properties of organic oxygen compounds 30. Vapour heat capacity and enthalpy of vaporization of propanal. In: J. Chem. Thermodyn. 4, 1972, S. 915–917, doi:10.1016/0021-9614(72)90013-4.
- Carl L. Yaws: The Yaws Handbook of Vapor Pressure - Antoine Coefficients. 2. Auflage. Elsevier, 2015, ISBN 978-0-12-802999-2, S. 13, doi:10.1016/B978-0-12-802999-2.00004-0.
- K. B. Wiberg, L. S. Crocker, K. M. Morgan: Thermochemical studies of carbonyl compounds. 5. Enthalpies of reduction of carbonyl groups. In: J. Am. Chem. Soc. 113, 1991, S. 3447–3450.
- A. D. Korkhov, I. A. Vasil'ev: Heat capacity and thermodynamic functions of propanal at low temperatures. In: Termodin. Org. Soedin. 6, 1977, S. 34–37.
- J. E. Connett: Chemical equilibria. 5. Measurement of equilibrium constants for the dehydrogenation of propanol by a vapour flow technique. In: J. Chem. Thermodyn. 4, 1972, S. 233–237.
- J. Tjebbes: Heats of combustion of propanal and 2-methyl propanal. In: Acta Chem. Scand. 16, 1962, S. 953–957.
- J. Chao: Thermodynamic properties of key organic oxygen compounds in the carbon range C1 to C4. Part 2. Ideal gas properties. In: J. Phys. Chem. Ref. Data. 15, 1986, S. 1369–1436.
- A. S. Teja, D. J. Rosenthal: The Critical Pressures and Temperatures of Twelve Substances Using A Low Residence Time Flow Apparatus. In: AIChE Symp. Ser. 86, 279, 1990, S. 133–137.
- M. J. Anselme, A. S. Teja: The critical properties of rapidly reacting substances. In: AIChE Symp. Ser. 86, 279, 1990, S. 128–132.
- V. Majer, V. Svoboda: Enthalpies of Vaporization of Organic Compounds: A Critical Review and Data Compilation. Blackwell Scientific Publications, Oxford 1985, S. 300.


