Verbrückte Kohlenwasserstoffe
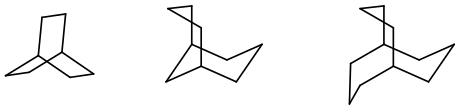
Unter dem Begriff Verbrückte Kohlenwasserstoffe werden in der organischen Chemie gesättigte und ungesättigte Kohlenwasserstoffe mit mehreren verknüpften Ringstrukturen zusammengefasst. Man kann sie von Cycloalkanen ableiten, bei denen zwei nicht benachbarte Kohlenstoffatome direkt oder mit einer, bzw. mit mehreren Methylengruppen verbunden sind. Dadurch erhält man bicyclische Kohlenwasserstoffe (Bicycloalkane).

Die verbindenden Kohlenstoffatome werden Brücke genannt, die beiden Verknüpfungsstellen (tertiäre Kohlenstoffatome) Brückenköpfe oder Brückenkopfatome.
Zur Charakterisierung der Brücken kann man die von den Alkanen abgeleiteten Bezeichnungen Methano- (–CH2–), Ethano- (–CH2CH2–), Propano- (–CH2CH2CH2–) usw. verwenden. Sind die Brückenkopfatome direkt aneinander gebunden, bezeichnet man diese Verknüpfung als „Null-Brücke“ und es liegt eine Verbindung mit kondensierten Ringen vor.
Nomenklatur
Die Benennung der überbrückten Kohlenwasserstoffe erfolgt nach der Von-Baeyer-Nomenklatur, die ursprünglich für bicyclische Verbindungen entwickelt und später für polycyclische Verbindungen erweitert wurde. Diese Nomenklatur ist Bestandteil der IUPAC-Regeln. Insbesondere für die bicyclischen Kohlenwasserstoffe sind oftmals Trivialnamen gebräuchlich, die sich in vielen Fällen von Naturstoffen ableiten.
Gesättigte bicyclische Kohlenwasserstoffe
Nach der Von-Baeyer-Nomenklatur werden die gesättigten bicyclischen Kohlenwasserstoffe als Bicycloalkane (Bicyclobutan, Bicyclopentan, Bicyclohexan usw.) bezeichnet. Die Anzahl der Kohlenstoffatome in den drei Brücken wird in eckigen Klammern in fallender Reihenfolge nach dem Wortteil „Bicyclo“ angegeben; die Zahlen werden durch Punkte getrennt.[1]
Beispiele:
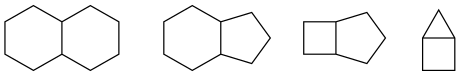
Bicyclo[2.2.2]octan, Bicyclo[3.3.1]nonan und Bicyclo[3.3.3]undecan
Kondensierte bicyclische Verbindungen: Bicyclo[4.4.0]decan, Bicyclo[4.3.0]nonan, Bicyclo[3.2.0]heptan und Bicyclo[2.1.0]pentan
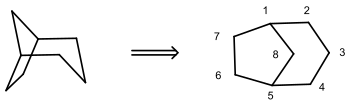
Für die Bezifferung der Ringpositionen (Lokanten) gilt die IUPAC-Regel A-31.2:
„Die Numerierung eines verbrückten Kohlenwasserstoffs beginnt an einem Brückenkopf; man numeriert auf dem längstmöglichen Weg zum anderen Brückenkopf, von diesem Atom aus auf dem längeren der beiden restlichen Wege zum ersten Brückenkopf zurück und dann auf dem kürzesten Weg zu Ende.“[1]
Beispiel: Bicyclo[3.2.1]octan
Dieses Molekül hat die links dargestellte räumliche Struktur (Stereo-Skelettformel). Rechts ist die planare Formel mit Nummerierung angezeigt. Sie entsteht, wenn man das Molekül „von oben“ in die Zeichenebene projiziert.
Ungesättigte bicyclische Kohlenwasserstoffe
Bicyclische Kohlenwasserstoffe enthalten oft eine oder mehrere C=C-Doppelbindungen. Wie bei den Cycloalkenen werden sie durch die Endung „-en“ charakterisiert. Von den an Doppelbindungen beteiligten Kohlenstoffatomen wird – wie üblich – nur die niedrigste Position angegeben. „Wenn für die Numerierung mehrere Möglichkeiten bestehen, erhalten die Mehrfachbindungen die niedrigsten Nummern.“[1]
Beispiel: ungesättigte Bicyclo[3.2.1]octane:
Bicyclo[3.2.1]oct-6-en und Bicyclo[3.2.1]octa-2,6-dien. Die durchgestrichene Formel soll eine falsche Bezifferung erläutern
Polycyclische Kohlenwasserstoffe
Werden in bicyclische Kohlenwasserstoffe weitere Brücken eingeführt, so erhält man polycyclische Verbindungen. Mit einer Brücke entstehen so tricyclische Systeme; zweifache Überbrückung führt zu tetracyclischen Kohlenwasserstoffen und so fort.
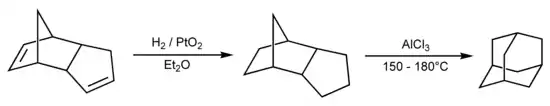
Als Beispiele für tricyclische Kohlenwasserstoffe sollen Adamantan und seine Synthesevorstufen Dicyclopentadien und Tetrahydrodicyclopentadien betrachtet werden:
Synthese von Adamantan (rechts) durch Hydrierung von Dicyclopentadien (links) und Isomerisierung der Tetrahydro-Verbindung (Mitte).
Zur Ermittlung des systematischen Namens von Adamantan, wird zunächst ermittelt, wie viele Ringe das Molekül enthält.
IUPAC-Regel A-32.12:
„Als Zahl der Ringe eines polycyclischen Systems ist die Anzahl der Schnitte anzusehen, die zur Überführung des Systems in eine offenkettige Verbindung nötig sind“[1]
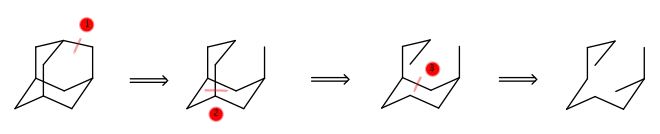
Bei Adamantan sind drei Schnitte nötig, um zu einer offenkettigen Verbindung zu gelangen. Da das Molekül aus zehn Kohlenstoffatomen besteht, ist es demnach ein Tricyclodecan.
Als nächster Schritt wird der sogenannte Hauptring, die Zweige des Hauptrings, und die „Nebenbrücke“ ermittelt.
- Nach dem ersten Schnitt erkennt man, dass der Hauptring acht C-Atome enthält; seine längsten Zweige bestehen aus jeweils drei Kohlenstoffatomen.
- Hauptbrücke ist C1, also handelt es sich um ein Bicyclo[3.3.1]-System.
- Nebenbrücke ist ebenfalls C1, also liegt ein Tricyclo[3.3.1.1]-System vor.
- Die Nebenbrücke verknüpft C-3 mit C-7.
Somit lautet der systematische Name: Tricyclo[3.3.1.13,7]decan.
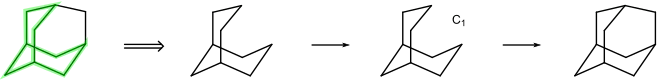
Tetrahydrodicyclopentadien (siehe oben) enthält eine „Nullbrücke“. Von den beiden möglichen Stereoisomeren ist in der Abbildung (links) das endo-Stereoisomer gezeigt. Nach ihrer Definition unterscheidet die Von-Baeyer-Nomenklatur jedoch nicht zwischen Stereoisomeren.
Drei Schnitte (rot) durch die Bindungen sind nötig, um ein offenkettiges Alkan (rechts) zu erzeugen. Schneidet man die Nullbrücke auf, so erhält man das Bicyclo[5.2.1]-System. Durch Verknüpfung der Kohlenstoffatome C-2 und C-6 findet man den systematischen Namen: Tricyclo[5.2.1.02,6]decan.
Dicyclopentadien enthält noch zwei Doppelbindungen, die bei C-3 sowie C-8 beginnen: Tricyclo[5.2.1.02,6]deca-3,8-dien.
Einzelnachweise
- Internationale Union für Reine und Angewandte Chemie (IUPAC): Regeln für die Nomenklatur der organischen Chemie, Deutsche Ausgabe (Hrsg. H. Grünewald), Bd. 1, Abschnitt A – Kohlenwasserstoffe, Verlag Chemie, Weinheim, 1975.
Literatur
- Internationale Union für Reine und Angewandte Chemie (IUPAC): Regeln für die Nomenklatur der organischen Chemie. Band 1, Abschnitt A – Kohlenwasserstoffe, Verlag Chemie, Weinheim, 1975.
- Dieter Hellwinkel: Die systematische Nomenklatur der organischen Chemie: eine Gebrauchsanweisung, 5. Auflage, Springer, Berlin, Heidelberg u. a. O., 2006, ISBN 3-540-26411-6.