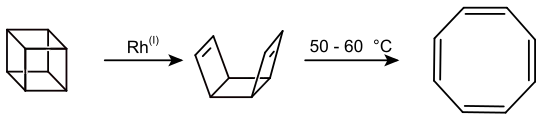Cuban
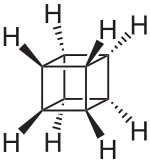
Cuban ist ein synthetischer Kohlenwasserstoff, dessen Molekül aus acht in Form eines Würfels angeordneten Kohlenstoffatomen mit jeweils einem zugehörigen Wasserstoffatom besteht. Das Kohlenstoffgerüst umschließt einen Hohlraum, daher gehört Cuban zur Klasse der Käfigverbindungen, genauer zu den platonischen Kohlenwasserstoffen. Es galt bis zu seiner Erstsynthese im Jahre 1964 zunächst nur als in der Theorie existent und wegen der ungewöhnlich spitzen 90-Grad-Bindungswinkel der Kohlenstoffatome als instabil. Durch diese 90-Grad-Winkel speichert Cuban viel Energie in diesen Bindungen, daher kann es als Grundkörper hochenergetischer Treibstoffe oder Sprengstoffe dienen (siehe auch Tetranitrocuban, Octanitrocuban).
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||
| Allgemeines | ||||||||||
| Name | Cuban | |||||||||
| Andere Namen |
Pentacyclo[4.2.0.02,5.03,8.04,7]octan | |||||||||
| Summenformel | C8H8 | |||||||||
| Kurzbeschreibung |
schimmernde, farblose Rhomben[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 104,14 g·mol−1 | |||||||||
| Aggregatzustand |
fest | |||||||||
| Dichte |
1,29 g·cm−3[2] | |||||||||
| Schmelzpunkt | ||||||||||
| Siedepunkt |
200 °C (Zersetzung)[1] | |||||||||
| Dampfdruck |
146,7 Pa (25 °C)[4] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Geschichte
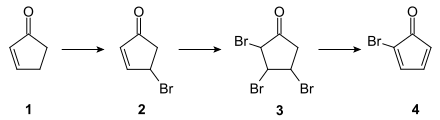
Die Darstellung von Cuban in einer dreizehnstufigen Synthese durch Philip Eaton wurde erstmals 1964 publiziert.[6][7] Die Originalsynthese geht von 2-Cyclopenten-1-on (1) aus, das zunächst in einer Wohl-Ziegler-Reaktion mit N-Bromsuccinimid zu (2) monobromiert wird. Die Tribromverbindung (3) wird durch Weiterbromierung mit elementarem Brom erhalten, aus der die eigentliche Ausgangsverbindung der Cuban-Synthese 2-Bromcyclopentadienon (4) durch Dehydrohalogenierung gewonnen wird:
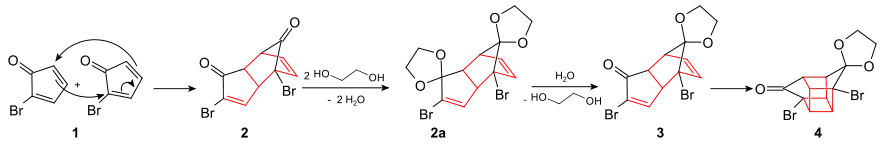
Diese Ausgangsverbindung (2-Bromcyclopentadienon) wird in einem ersten Schritt über eine Diels-Alder-Reaktion zu (2) dimerisiert. Beide Carbonylgruppen in (2) werden mit Ethylenglycol geschützt (2a). Anschließend wird die endo-ständige Acetal-Gruppe selektiv unter Bildung der Verbindung (3) hydrolysiert. Es schließt sich eine intramolekulare photochemische [2+2]-Cycloaddition zum Bromketon (4) an:
Das so gewonnene Bromketon wird über eine Faworski-Umlagerung durch Ring-Kontraktion zur Carbonsäure (5) umgelagert. Die freie Carbonsäure (5) wird in einen Peroxycarbonsäureester (6) überführt und danach thermisch zu (7) decarboxyliert:
Zuletzt wird die verbliebene Acetal-Gruppe ebenfalls hydrolysiert, das Bromketon (8) in einer zweiten Faworski-Reaktion umgelagert und die dabei entstehende Carbonsäure (9) in den entsprechenden Peroxycarbonsäureester (10) überführt. Das Zielmolekül Cuban (11) wird nach einer thermischen Decarboxylierung von (10) erhalten:
Synthese
Der Aufbau der Cubanstruktur kann in einer einfacheren fünfstufigen Synthese zunächst zur Cuban-1,4-dicarbonsäure erfolgen.[8][9] Die Startverbindung der Synthese ist hier Cyclopentanon, welches im ersten Schritt mittels Ethylenglycol zum cyclischen Ketal umgewandelt wird. Durch Bromierung entsteht ein dreifach bromiertes Cyclopentanonketal, welches nach Dehydrohalogenierung und Diels-Alder-Reaktion in ein polycyclisches Diels-Alder-Zwischenprodukt überführt wird. Eine intramolekulare photochemische [2+2]-Cycloaddition führt zu einer teilweisen Cubanstruktur, welche durch eine Reaktion unter Rückfluss in Gegenwart von Natronlauge vervollständigt wird. Die Gesamtausbeute beträgt über alle Reaktionsstufen etwa 25 %.[9] Die Synthese wurde bis in den Kilogrammmaßstab durchgeführt.[9]
Cuban-1,4-dicarbonsäure ist eine Basisverbindung für die Synthese weiterer substituierter Cubanverbindungen.[9] Die Decarboxylierung zum Cuban erfolgt in zwei Schritten über den tert-Butylperester.[6] Eine nahezu quantitative Synthese gelingt durch den photochemischen Abbau eines Thiohydroxamsäureesters.[10][9]
Eigenschaften
Physikalische Eigenschaften
 Raumfüllendes Modell von Cuban
Raumfüllendes Modell von Cuban
Cuban ist bei Raumtemperatur eine feste, kristalline Substanz, die in zwei polymorphen Kristallformen auftritt.[11] Bei Raumtemperatur liegt die Kristallform II vor, die sich bei 121,9 °C in einem Phasenübergang erster Ordnung in die Kristallform I umwandelt.[11] Diese Kristallform liegt in plastisch kristalliner Form vor.[11] Das bedeutet, die Verbindung befindet sich zwischen den beiden Phasenübergängen in einem mesomorphen Zustand. Bei 131,8 °C wird die flüssige Phase erreicht.[11] Die Dampfdruckfunktion ergibt sich nach August entsprechend log10(P) = −A/T+B (P in Torr, T in K) mit A = 2200 und B = 8.[11] Die Verbindung ist mit einer Standardbildungsenthalpie von ΔfHsolid = 542 kJ·mol−1 beziehungsweise ΔfHgas = 622 kJ·mol−1 stark endotherm.[12] Die Standardverbrennungsenthalpie ΔcHsolid beträgt −4833,27 kJ·mol−1.[12]
Bei Raumtemperatur kristallisiert Cuban in trigonaler Kristallstruktur mit der Raumgruppe R3 mit einem Molekül pro Elementarzelle.[13] Die mittels Elektronenbeugung bestimmten Bindungslängen betragen für die C–C-Bindung 157,27±0,19 pm, für die C–H-Bindung 111,8±0,8 pm und unterscheiden sich nur wenig von denen im Cyclobutan mit 155,1 pm für die C–C-Bindung und 109 pm für die C–H-Bindung.[4][14][15]
Chemische Eigenschaften
Trotz der hochgespannten Bindungen ist die Verbindung stabil. Eine messbare Zersetzung wird erst bei Temperaturen oberhalb von 200 °C beobachtet.[9] Die Aktivierungsenergie für die Thermolyse ist mit einem Wert von 180,5 kJ·mol−1 relativ hoch.[16] Gegenüber Licht, Luft und Wasser ist Cuban ebenfalls relativ stabil.[9] Cuban kann intramolekulare metallkatalysierte Bindungsumlagerungen eingehen. Die Reaktion führt in Gegenwart von Silber- oder Palladiumkatalysatoren zum Cunean.[17]
Mit Rhodiumkatalysatoren wird zunächst syn-Tricyclooctadien gebildet, welches thermisch bei 50–60 °C zum Cyclooctatetraen umgewandelt werden kann.[18]
Literatur
- P. E. Eaton: Cubane: Ausgangsverbindungen für die Chemie der neunziger Jahre und des nächsten Jahrhunderts. In: Angew. Chem. Band 104, 1992, S. 1447–1462, doi:10.1002/ange.19921041105.
Einzelnachweise
- Eintrag zu Cuban. In: Römpp Online. Georg Thieme Verlag, abgerufen am 28. Dezember 2014.
- Jai Prakash Agrawal: High Energy Materials: Propellants, Explosives and Pyrotechnics , Wiley-VCH Verlag GmbH & Co. KGaA 2010, ISBN 978-3-527-32610-5, S. 138.
- The Merck Index. An Encyclopaedia of Chemicals, Drugs and Biologicals. 14. Auflage, 2006, ISBN 978-0-911910-00-1, S. 439.
- L. Hedberg, K. Hedberg, E. P. E Kenneth, N. Nodari, A. G. Robiette: Bond lengths and quadratic force field for cubane. In: J. Am. Chem. Soc. 113, 1991, S. 1514–1517, doi:10.1021/ja00005a007.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- P. E. Eaton, T. W. Cole: Cubane. In: J. Am. Chem. Soc. 86 1964, S. 3157–3158, doi:10.1021/ja01069a041.
- P. E. Eaton, T. W. Cole: The Cubane System. In: J. Am. Chem. Soc. 86, 1964, S. 962–964, doi:10.1021/ja01059a072.
- N. B. Chapman, J. M. Key, K. J. Toyne: The Preparation and Properties of Cage Polycyclic Systems – I. Pentacyclo[5.3.0.02,5.03,9.04,8]decane and Pentacyclo[4.3.0.02,5.03,8.04,7]nonane Derivatives. In: J. Org. Chem. 35, 1970, S. 3860–3867. doi:10.1021/jo00836a062.
- P. E. Eaton: Cubane: Ausgangsverbindungen für die Chemie der 1990er Jahre und des nächsten Jahrhunderts. In: Angew. Chem., 104, 1992, S. 1447–1462, doi:10.1002/ange.19921041105.
- D. H. R. Barton, D. Crich, W. B. Motherwell: New and improved methods for the radical decarboxylation of acids. In: J. Chem. Soc., Chem. Commun. 1983, S. 939–941, doi:10.1039/C39830000939.
- M. A. White, R. E. Wasylishen, P. E. Eaton, Y. Xiong, K. Pramod, N. Nodari: Orientational Disorder in Solid Cubane: A Thermodynamic and 13C NMR Study. In: J. Phys. Chem., 96, Nr. 1, 1992, S. 421–425, doi:10.1021/j100180a078.
- B. D. Kybett, S. Carroll, P. Natalis, D. W. Bonnell, J. L. Margrave, J. L. Franklin: Thermodynamic Properties of Cubane. In: J. Am. Chem. Soc., 88, 1966, S. 626–626, doi:10.1021/ja00955a056.
- E. B. Fleischer: X-Ray Structure Determination of Cubane. In: J. Am. Chem. Soc., 86, 1964, S. 3889–3890, doi:10.1021/ja01072a069.
- N. L. Allinger, P. E. Eaton: The geometries of pentaprismane and hexaprismane insights from molecular mechanics. In: Tetrahedron Lett., 24, 1983, S. 3697–3700, doi:10.1016/S0040-4039(00)94512-X.
- N. L. Allinger: Conformational Analysis. 130. MM2. A Hydrocarbon Force Field Utilizing V1 and V2 Torsional Terms. In: J. Am. Chem. Soc., 99, 1977, S. 8127–8134, doi:10.1021/ja00467a001.
- H.-D. Martin, T. Urbanek, P. Pföhler, R. Walsh: The pyrolysis of cubane; an example of a thermally induced hot molecule reaction. In: J. Chem. Soc., Chem. Commun., 1985, S. 964–965, doi:10.1039/C39850000964.
- P. E. Eaton, L. Cassar, J. Halpern: Silver(I)- and Palladium(II)-Catalyzed Isomerizations of Cubane. Synthesis and Characterization of Cuneane. In: J. Am. Chem. Soc., 92, 1970, S. 6366–6368, doi:10.1021/ja00724a061.
- L. Cessar, P. E. Eaton, J. Halpern: Catalysis of Symmetry-Restricted Reactions by Transition Metal Compounds. The Valence Isomerization of Cubane. In: J. Am. Chem. Soc., 92, 1970, S. 3515–3518, doi:10.1021/ja00714a075.